人源锌指蛋白ZNF24及其锌指结构域的表达、纯化及DNA结合性质的研究
苏晓琴,高宝才,纪 锐,王 森,李继喜
(复旦大学 生命科学学院,上海 200438)
转录因子是控制基因表达的关键蛋白,能够以序列特异性方式结合DNA,直接参与激活或抑制基因的转录过程[1]。在真核细胞中,经典的C2H2型锌指结构域是最常见的DNA结合基序,经常作为转录因子的关键部位与DNA结合,调控基因的表达[2],人类基因组包含650多个C2H2锌指蛋白[3]。C2H2型锌指结构域最初是在非洲爪蟾转录因子ⅢA蛋白(TFⅢA)中发现的,该蛋白含有9个重复的串联C2H2基序,通过中心锌离子的配位来稳定其折叠,每个单元由大约30个氨基酸残基组成[4]。C2H2型锌指结构域同源保守序列是(F/Y)-X-C-X2-5-C-X3-(F/Y)-X5-L-X2-H-X3-5-H[5],其中X表示任意氨基酸,两个保守的半胱氨酸和组氨酸与锌离子配位形成ββα折叠结构。C2H2锌指结构域经常以串联的形式出现,介导与DNA相互作用,结合基因的启动子、增强子或抑制区域,每个锌指结构结合3个或者更多的碱基,DNA序列偏好结合锌指α螺旋的-1、+2、+3和+6的氨基酸[6]。除了串联锌指基序外,C2H2型锌指蛋白通常在其N末端还含有其他功能结构域,包括BTB(BRoad-Complex,TramTrack和Bric-a-brac)/POZ(痘病毒和锌指)[7],Krüppel-associated box(KRAB)[8]以及SCAN结构域[9]。这些功能结构域可能通过调控转录因子之间或其他细胞成分选择性结合来调控亚细胞定位、DNA结合和基因表达[10]。
锌指蛋白ZNF24(Zinc finger protein 24),也称为ZNF191或KOX17,属于锌指转录因子家族成员。ZNF24蛋白的N端含有一个SCAN结构域,该结构域在锌指蛋白中主要参与蛋白质之间的相互作用,选择性地介导蛋白的寡聚,但它在ZNF24中的作用仍然未知。C末端含有4个连续的Krüppel样C2H2锌指结构域,作为DNA结合结构域[13]。ZNF24锌指结构域与位于酪氨酸羟化酶基因(TH基因,编码合成儿茶酚胺的限速酶)第一内含子的HUMTH01微卫星的TCAT重复序列相结合,HUMTH01的等位基因变异对TH基因表达有一定的沉默效应,并影响与ZNF24的结合[14]。此外,ZNF24能直接与CTNNB1启动子结合,激活β-catenin的表达,促进肝癌细胞增殖[15]。ZNF24还可直接与VEGF近端启动子的11 bp片段结合抑制VEGF转录,并通过抑制血管生成作为肿瘤生长的负调控因子[16]。ZNF24在胚胎发育过程中和成人组织中均有广泛地表达[17],ZNF24基因敲除会导致小鼠胚胎过早死亡[18],表明ZNF24在胚胎发育和细胞增殖过程起重要作用。此外,在神经前体细胞中研究发现ZNF24表达上调会使这些细胞保持在活跃的增殖状态,并抑制神经元的分化,表明ZNF24作为促进细胞周期的重要因子,维持神经细胞在祖细胞阶段[19]。ZNF24是一种多效性因子,能调控多个基因的表达,在造血、大脑发育和肿瘤生长中发挥作用[20]。但是目前转录因子ZNF24识别和结合DNA的机制还不清楚,因此我们对ZNF24的DNA结合性质进行研究,寻找与ZNF24结合的DNA序列,对理解ZNF24调控下游靶基因的类型和调控机制具有重要的意义。
本文中,我们构建了人源锌指蛋白ZNF24和其锌指结构域ZNF24(243~368)原核表达载体,在大肠杆菌中成功表达并获得了高纯度可溶性的目的蛋白。凝胶迁移实验(Electrophoretic Mobility Shift Assay, EMSA)进一步验证ZNF24全长蛋白和其锌指结构域与双链DNA底物结合情况,为后续锌指蛋白ZNF24的结构和功能研究提供理论基础。
1 材料和方法
1.1 材料和主要试剂
1.1.1 材料
原核表达载体pSMT3为实验室库存质粒,感受态细胞E.coliDH5α和E.coliBL21(DE3)购于上海唯地生物公司,Ni-NTA Superflow购于Qiagen,SP阳离子交换层析柱和凝胶过滤层析柱购于GE Healthcare,DNA底物由上海生工生物工程有限公司合成。
1.1.2 主要试剂
限制性内切酶(BamH Ⅰ和XhoⅠ)购于NEB公司,同源重组酶购于Novoprotein公司,PrimeStar GXL DNA聚合酶购于TaKaRa公司,质粒小提试剂盒购于Axygen,HEPES、氯化锌、IPTG、DTT粉末均购于上海生工,β-巯基乙醇购于Sigma,蛋白Marker购于Thermo Fisher,蛋白高速离心浓缩管(10 kDa/30 kDa)购于Millipore公司。
1.2 方法
1.2.1 锌指蛋白ZNF24全长和ZNF24(243~368)原核表达载体的构建
以含有ZNF24基因(NP_008896.2)的质粒作为模板,引物5’端引入载体同源序列,通过PCR反应扩增目的基因,选择BamH Ⅰ和XhoⅠ酶切大肠杆菌表达载体pSMT3,采用同源重组的方法将PCR扩增产物与线性化载体连接,连接产物转化到E.coliDH5α感受态细胞中。通过菌落PCR鉴定阳性克隆,选取2~3个阳性克隆送至擎科生物公司测序。
1.2.2 锌指蛋白ZNF24全长和ZNF24(243~368)蛋白的表达与纯化
将构建好的重组质粒转化到E.coliBL21(DE3)细胞中,挑取生长较好的菌落接种至含有50 μg/mL卡那霉素抗性的LB液体培养基中,37 ℃条件下220 r/min振荡过夜培养。再将过夜培养的菌液按每15 mL转接至1 L含有20 μmol/L ZnCl2和50 μg/mL卡那霉素抗性的LB液体培养基,37 ℃条件下220 r/min培养。待菌液浓度OD600达到0.6~0.8时,降温至16 ℃,加入IPTG至终浓度为0.3 mmol/L培养20 h。诱导表达结束后,4 ℃条件下6 000 r/min离心15 min收集菌体,用缓冲液A(50 mmol/L Tris pH 8.0,500 mmol/L NaCl,10 mmol/L咪唑,5%甘油,2 mmol/L β-巯基乙醇)充分重悬后经高压破菌仪破碎,于4 ℃ 18 000 r/min离心1 h去除细胞碎片,留取上清。
收集到的上清流过缓冲液A平衡的Ni介质后,用50 mmol/L咪唑缓冲液(50 mmol/L Tris pH 8.0,500 mmol/L NaCl,50 mmol/L咪唑,5%甘油,2 mmol/L β-巯基乙醇)洗掉结合介质的杂蛋白,再用缓冲液B(50 mmol/L Tris pH 8.0,500 mmol/L NaCl,250/500 mmol/L咪唑,5%甘油,2 mmol/L β-巯基乙醇)洗脱目的蛋白。经ULP1酶切透析后再通过Ni-NTA亲和层析去除6×His-Sumo标签。
ZNF24(243~368)可通过阳离子交换柱进行纯化除去标签杂蛋白。首先将蛋白溶液盐浓度稀释到100 mmol/L,然后上样到缓冲液(50 mmol/L Tris pH 8.0,100 mmol/L NaCl,5%甘油)平衡好的SP阳离子交换柱上,标签蛋白不结合阳离子柱,结合S柱的目的蛋白通过KTA pure系统用高盐缓冲液进行梯度洗脱,将目的蛋白与标签蛋白分离。最后将纯化得到的ZNF24全长和锌指结构域蛋白浓缩至2 mL,上样至缓冲液(20 mmol/L HEPES pH 7.5,100 mmol/L NaCl,20 μmol/L ZnCl2,2 mmol/L DTT)平衡好的Superdex200 16/600凝胶过滤层析柱上进一步纯化ZNF24全长和锌指结构域蛋白,收集蛋白出峰样品。以上各组分均进行SDS-PAGE电泳,检测蛋白表达及纯度,方法见文献[21]。
1.2.3 蛋白质免疫印迹(Western blot)
Ni-NTA亲和层析纯化的蛋白经SDS-PAGE电泳分离后,300 mA恒流条件下湿转1 h到硝酸纤维素(NC)膜上。转膜结束后,用5%脱脂牛奶(1×TBST)室温下封闭1 h,1×TBST洗膜5 min,重复3次。加入一抗(Anti-6×His tag鼠抗)室温孵育2 h或4 ℃过夜孵育,洗膜3次;加入二抗(HRP标记的羊抗鼠二抗)室温孵育1 h,洗膜3次后滴加显影液进行显色。
1.2.4 动态光散射分析
动态光散射(Dynamic Light Scattering, DLS)测定步骤参考文献[22],在DynaProStar(Wyatt Technology, USA)的DYNAMICS软件上完成,光源波长为658 nm,固定散射角为90°,将高纯度的蛋白样品稀释至1 mg/mL,稀释缓冲液成分为20 mmol/L HEPES pH 7.5,100 mmol/L NaCl,20 μmol/L ZnCl2,2 mmol/L DTT,每个样品测量10次。
1.2.5 凝胶迁移实验(EMSA)
Zhao等[23]发现ZNF24锌指结构域倾向于结合AT和AGGG的DNA序列,因此本实验合成了DNA序列5’-GAAATAATGTTA-3’和5’-GGAGGGTGGTTA-3’及其互补序列,退火形成的双链DNA底物分别用S1、S2表示。通过凝胶迁移实验验证ZNF24全长蛋白和锌指结构域ZNF24(243~368)蛋白与核酸底物的结合能力。将合成好的单链DNA用缓冲液(20 mmol/L HEPES pH 7.5,100 mmol/L NaCl)稀释,在PCR管中等体积加入两条互补配对的DNA单链,吹打混匀后放入PCR仪中,运行如下退火程序: 95 ℃加热5 min后开始逐步降温,每降1 ℃维持90 s,直到温度降至4 ℃,退火成双链的DNA底物保存于-20 ℃。
将双链DNA底物稀释为4 μmol/L,蛋白稀释为4、8、16、32、64 μmol/L,然后将蛋白与双链DNA底物各取5 μL混合后,放冰上孵育1 h。反应结束后,加入2 μL 6×EMSA Loading buffer进行凝胶电泳。整个电泳过程在低温条件下进行,电压设置为100 V,电泳进行30~45 min。电泳结束后,将凝胶用GelRed核酸染料置于暗处染色5 min,磷屏压片放射自显影后,用Typhoon FLA9000扫描凝胶成像。
1.2.6 生物信息学分析
通过Expasy ProtParam(https:∥web.expasy.org/protparam/)计算蛋白的分子量、理论等电点和消光系数。IUPred2(http:∥iupred2a.elte.hu.)是目前常用的用于预测蛋白质内部无序区域的网站,将蛋白序列提交后,IUPred2可以对每一个氨基酸残基在0到1之间打分,得分在0.5以上的残基为无序度较高的残基。二级结构比对是通过Clustal W(https:∥www.genome.jp/tools-bin/clustalw)网站进行,然后用ESPript 3.0(https:∥espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)进行显示。
2 结果与分析
2.1 人源锌指蛋白ZNF24生物信息学分析
ZNF24全长共含有368个氨基酸,理论相对分子量约为42.1 kDa,等电点为5.82。它的N端包含一个SCAN结构域,C端为锌指区,由4个连续的锌指结构组成(图1(a),见第170页)。将人源ZNF24的SCAN结构域与人源ZNF305、ZNF500、ZNF213、ZNF174、ZNF197以及鼠源ZFP206的SCAN结构域序列进行比对分析可知,ZNF24的SCAN序列在α3螺旋区域的氨基酸序列非常保守(图1(b),见第170页)。ZNF24每个锌指均有两个保守的半胱氨酸和组氨酸,属于典型的C2H2型锌指,其中F/Y/L氨基酸构成锌指结构域的疏水核(图1(c),见第170页)。IUPred2预测结果显示ZNF24蛋白N端氨基酸23~45、110~140得分(Score)高于0.5,表明这两处均存在无序区域;C端锌指结构域得分在0.5以下,表明整体有序度较高(图1(d),见第170页)。
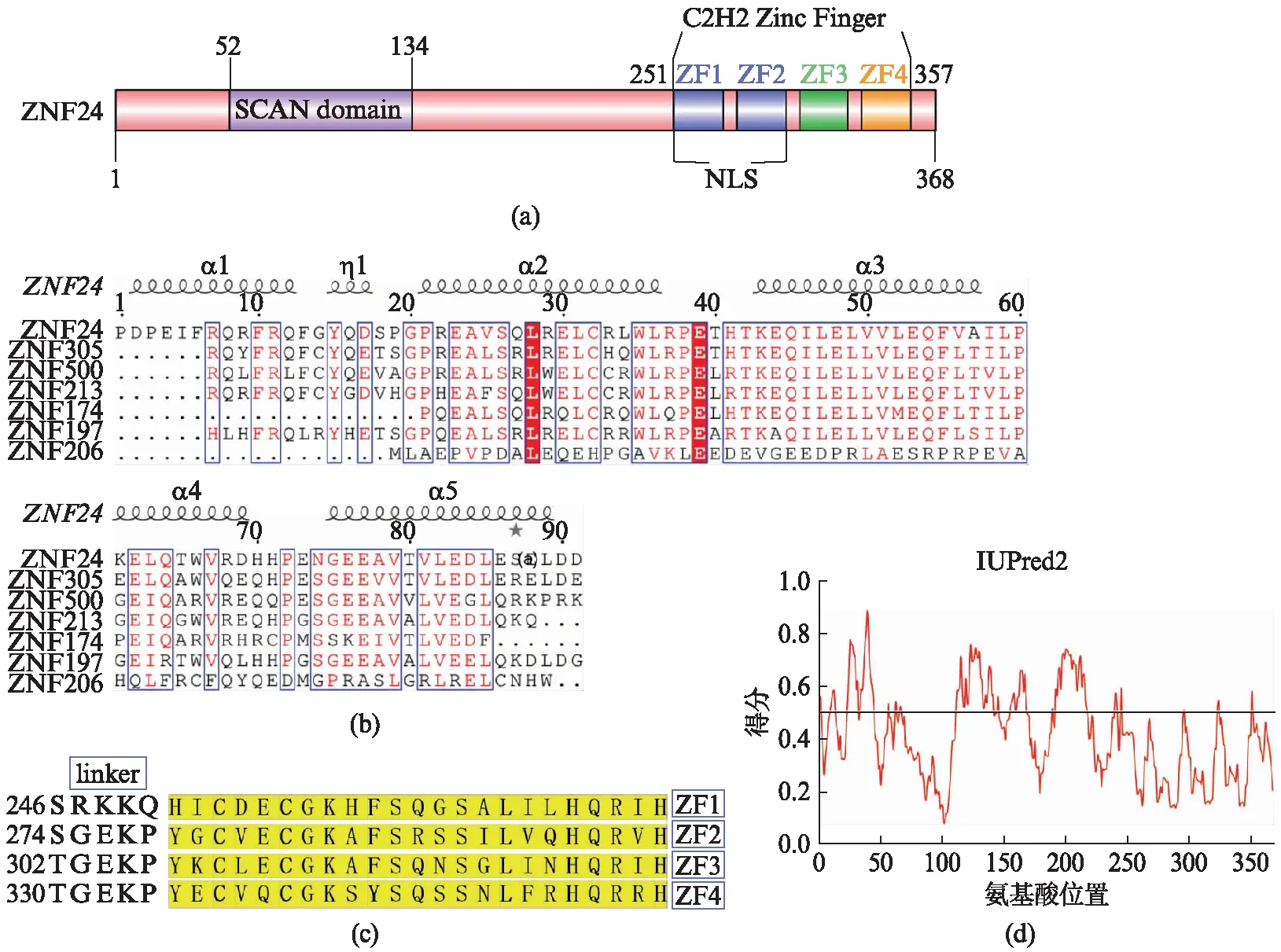
图1 人源锌指蛋白ZNF24序列分析Fig.1 Sequence analysis of Zinc finger protein 24(a) ZNF24全长蛋白结构域组成示意图;(b) 不同锌指蛋白SCAN结构域多重序列比对;(c) ZNF24锌指结构域氨基酸序列;(d) ZNF24蛋白有序度分析结果。
2.2 ZNF24的表达与纯化
测序结果表明目的基因成功连接到载体上,构建好的重组质粒可用于下一步目的蛋白的表达。重组质粒表达的目的蛋白N端带有6×His-Sumo标签,因此先通过Ni-NTA亲和层析进行蛋白纯化。6×His-Sumo标签包含122个氨基酸,带有标签的ZNF24蛋白含有490个氨基酸,其相对分子量为约为55.9 kDa,理论等电点为5.87。将蛋白样品进行Western blot验证,诱导后ZNF24蛋白在大肠杆菌中高效表达,蛋白条带在55~70 kDa之间,且大部分目的蛋白均在可溶性的上清中(图2(a))。将洗脱的目的蛋白纯度加入ULP1过夜酶切透析,切掉N端的6×His-Sumo标签,再经2次Ni-NTA亲和层析纯化,将目的蛋白与标签分离(图2(b))。最后利用凝胶过滤层析进一步纯化目的蛋白,ZNF24蛋白出峰位置在66.53 mL(图2(c)),推算其相对分子量约为135 kDa,因此可以判断ZNF24全长蛋白在溶液中以三聚体形式存在,且峰形较为对称,SDS-PAGE结果显示最终得到的ZNF24蛋白纯度在90%左右(图2(d))。
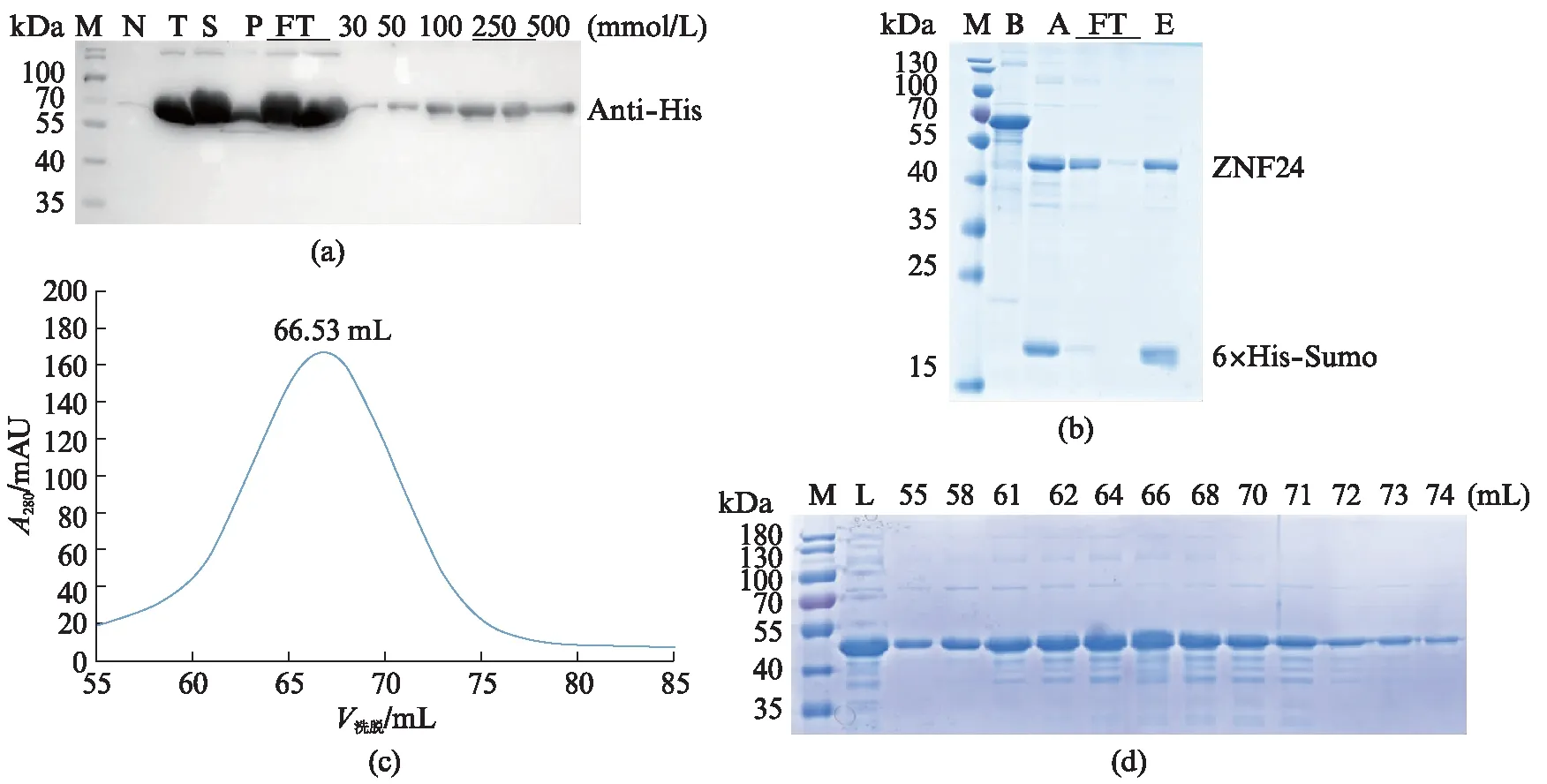
图2 ZNF24蛋白纯化结果Fig.2 Purification results of ZNF24 protein(a) Western blot检测结果。M为蛋白Marker,N为未诱导全菌,T为诱导后全菌,S为破菌离心后的上清,P为离心后的沉淀,FT为上清流过Ni介质的组分,泳道30、50、100、250、500为不同浓度咪唑缓冲液洗脱的蛋白组分。(b) ZNF24蛋白ULP1酶切和2次Ni-NTA亲和层析纯化结果。M为蛋白Marker,B为ULP1酶切前蛋白,A为酶切后蛋白,FT为切后流穿,E为250 mmol/L咪唑缓冲液洗脱样品。(c) ZNF24蛋白凝胶过滤层析纯化蛋白峰图。66.53 mL为蛋白的出峰位置的体积。(d) SDS-PAGE检测结果。泳道M表示蛋白Marker,L表示分子筛上样时样品,数字表示的是收集的样品对应的体积。
2.3 ZNF24(243~368)蛋白的表达与纯化
ZNF24的锌指结构域包含C端243~368位,共126个氨基酸残基,相对分子量约为14.4 kDa,理论等电点为9.6。通过Ni-NTA亲和层析、ULP1酶切、阳离子交换层析和凝胶过滤层析纯化后,获得高纯度可溶性的ZNF24(243~368)蛋白,凝胶过滤层析蛋白出峰体积在67.31 mL(图3(a)),可以判断ZNF24(243~368)蛋白在溶液中以单体形式存在,SDS-PAGE结果显示蛋白纯度在95%以上(图3(b))。
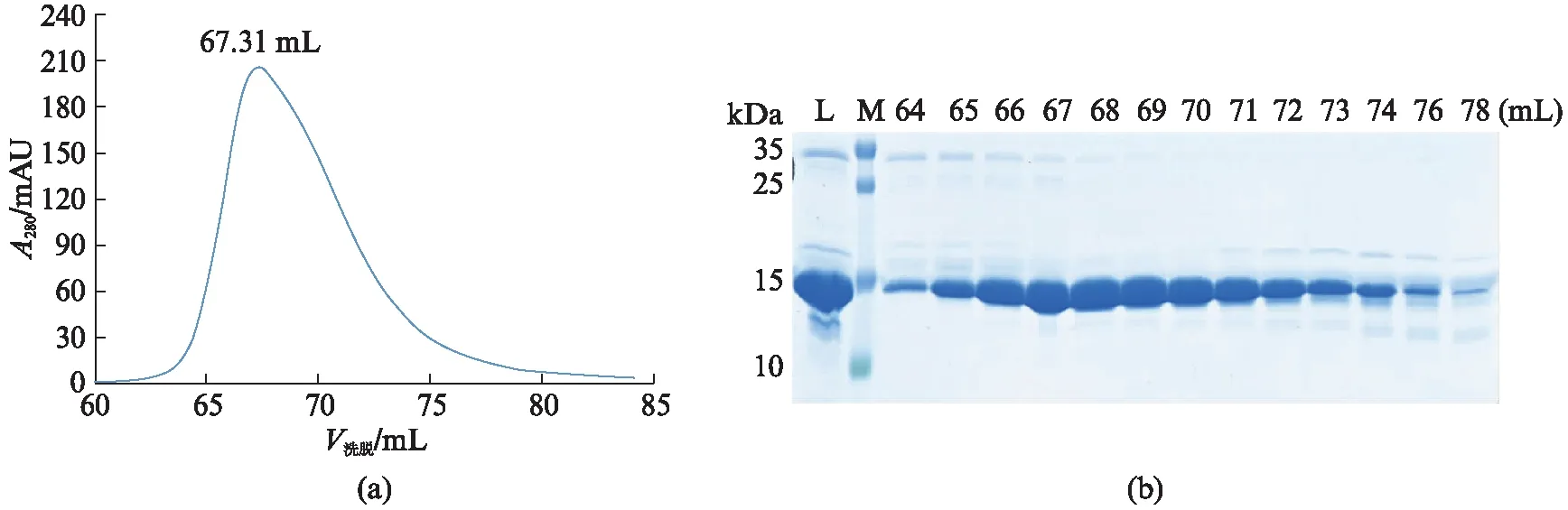
图3 ZNF24(243~368)纯化结果Fig.3 Purification results of ZNF24(243~368)protein(a) ZNF24(243~368)凝胶过滤层析纯化结果;(b) SDS-PAGE检测结果。
2.4 动态光散射分析
DLS测定用于确定蛋白在溶液中的颗粒粒径分布,分布系数(Particle Dispersion Index, PDI)<20时,可将体系看作单分散系。DLS结果表明ZNF24蛋白在溶液中粒径(Radius,R)为5.4 nm的颗粒质量分数(w)为99.9%,PDI值为31.2(图4(a)),高于单一分散系的临界点20,说明蛋白在溶液聚合状态不均一。ZNF24(243~368)蛋白在溶液中粒径为2.7 nm的颗粒质量分数(w)为92.1%,PDI值为2.8,说明蛋白在溶液中是均匀分布的(图4(b))。
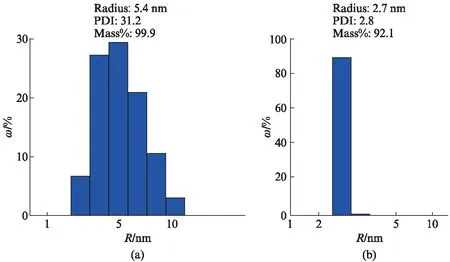
图4 ZNF24蛋白DLS测定结果Fig.4 DLS analysis of ZNF24 protein(a) DLS分析ZNF24全长蛋白在溶液中的分布;(b) DLS分析ZNF24(243~368)在溶液中的分布。
2.5 全长ZNF24和ZNF24(243~368)与DNA底物结合
凝胶迁移实验(EMSA)用于体外验证蛋白质与核酸结合活性的研究,主要基于蛋白质与核酸结合形成蛋白质-核酸复合物,分子量变大,在凝胶电泳过程中迁移速率慢,未结合蛋白的核酸分子量小,迁移速率快,从而出现条带的迁移。因此我们根据条带的迁移可以判断蛋白质与核酸是否有相互作用,依据蛋白与核酸的浓度可以估算其结合的比例。
将全长ZNF24和ZNF24(243~368)分别与双链DNA底物S1、S2进行孵育,待反应结束后,进行凝胶电泳。随着ZNF蛋白浓度的提高,游离的DNA底物S1、S2量没有减少(图5(a,d)),说明ZNF24全长蛋白几乎不结合底物S1、S2。随着ZNF24(243~368)浓度的提高,游离的DNA底物S1、S2的量明显减少(图5(b,e))。由于蛋白在缓冲液中带正电,不能进入到胶孔中,因此与蛋白结合的DNA底物有一部分滞留在胶孔,还有一部分随着蛋白跑向内槽电泳液中,因此EMSA实验结果说明ZNF24(243~368)能与双链DNA底物S1、S2发生结合。全长蛋白相较于锌指结构域与底物S1、S2的结合比例存在明显差异,锌指结构域蛋白与底物S1、S2的结合能力相近(图5(c,f))。
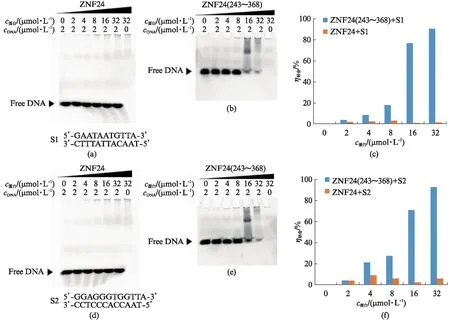
图5 锌指结构域ZNF24和锌指结构域ZNF24(243~368)与DNA底物结合情况Fig.5 Interaction of ZNF24 and ZNF24(243~368) protein with DNA substrate(a) ZNF24与底物S1 EMSA实验结果;(b) ZNF24(243~368)与底物S1 EMSA实验结果;(c) ZNF24和ZNF24(243~368)与底物S1结合百分比,通过Imag J软件计算胶图中每个泳道游离DNA底物条带的灰度值,结合比例=1-相应蛋白浓度泳道的灰度值/泳道1的灰度值;(d) ZNF24与底物S2 EMSA实验结果;(e) ZNF24(243~368)与底物S2 EMSA实验结果;(f) ZNF24和ZNF24(243~368)与底物S2结合百分比。
3 讨 论
本文中,我们构建了人源锌指蛋白ZNF24和锌指结构域ZNF24(243~368)原核表达载体,并在大肠杆菌中成功表达目的蛋白。通过Ni-NTA亲和层析、阳离子交换层析和凝胶过滤层析纯化手段,获得了高纯度的可溶性目的蛋白。我们发现ZNF24全长蛋白在溶液中以三聚体形式存在,而ZNF24的锌指结构域在溶液中为单体。研究表明SCAN结构域是一个高度保守富含亮氨酸的结构域,一般含有84个氨基酸,位于C2H2锌指蛋白家族的N端附近[24]。生化结合实验表明ZNF24的SCAN结构域是一个选择性寡聚结构域,单独的SCAN结构域蛋白在溶液中可形成不对称的同源二聚体[12],这表明ZNF24蛋白N端的SCAN结构域能够促进全长蛋白的寡聚化,因此ZNF24全长蛋白在溶液中是多聚体的形式。同时SCAN结构域与锌指结构之间的序列为固有无序区域(图1(d)),无序区域容易形成无规则卷曲,可能会引起蛋白的聚合[25-26]。
通过EMSA实验体外验证了锌指结构域ZNF24(243~368)蛋白能够结合双链DNA序列5’-GAAATAATGTTA-3’和5’-GGAGGGTGGTTA-3’,但全长ZNF24蛋白不能与这两个双链DNA底物结合,表明全长蛋白的寡聚可能会导致与DNA底物结合的锌指结构域氨基酸位点被隐藏,使ZNF24全长蛋白与DNA结合的能力变弱,这也预示着ZNF24蛋白N端的SCAN结构域会影响ZNF24调控基因表达作用的发挥。通过对锌指蛋白ZNF24体外纯化和DNA结合性质的研究,为进一步研究锌指蛋白ZNF24调控基因表达提供基础,同时表明SCAN结构域介导的蛋白寡聚可能代表了一种新的转录活性调节机制。

