链脲佐菌素腹腔注射制作大鼠2型糖尿病模型的方式与剂量研究*
张秋林,林慧婷,周格,温紫凌,李书稳,甘海宁
(1.广东省第二中医院(广东省中医工程技术研究院),广东广州 510095;2.广州中医药大学,广东广州 510006)
糖尿病是由多因素引起的、胰岛素分泌或作用不足所致的、以高血糖为主要特征的慢性代谢紊乱性疾病,其对人类健康的影响巨大,若不加以控制或控制不佳,可引发心脑血管、肝脏、肾脏、神经等其他系统的急慢性并发症,是继心脑血管疾病和恶性肿瘤之后的第三大危害人类健康的重要慢性非传染性疾病[1]。随着人们生活水平的提高、饮食条件和习惯的改变及人口老龄化的快速加剧,该病的患病率正在逐年上升,并已成为全球性的公共卫生问题之一。根据国际糖尿病联盟发布的糖尿病地图集显示:至2017年,全球糖尿病患者已达到4.51亿人,并且至2045年将增加至6.93亿人[2];而在我国,糖尿病人数早已超过了1.4亿,其中以2型糖尿病为主要类型,相关报道显示其可占90%以上[3-4]。由此可见,2型糖尿病的防控形势严峻,但其病因病机却至今尚未完全阐明,因此建立可靠的、能较好地模拟2型糖尿病的动物模型对其发病机制、防治及药物开发具有重要意义。
目前,在高糖高脂饲料喂养的基础上进行链脲佐菌素腹腔注射是建立大鼠2型糖尿病模型常见而成熟的方法,具有操作简单、短周期、性价比高等优点,但不同文献所报道的注射剂量差异较大,范围多在30~65mg/kg[5-8]。由于具体制作方法常常会影响到模型制作的成效、血糖稳定性、死亡率等,甚至成为决定实验能否顺利进行的关键因素,因此在制作大鼠2型糖尿病模型时如何选择链脲佐菌素的注射剂量、第一次注射量不足时如何处理等问题就显得极其重要。本研究拟探索制作大鼠2型糖尿病模型的链脲佐菌素腹腔注射方式及剂量,以及第一次注射量不足时的处理方法,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF级成年(6~8周龄)雄性SD大鼠,体重200±20g,购自广东省实验动物中心,许可证号:XCXK(粤)2018-0002。饲养于广东省第二中医院(广东省中医药工程技术研究院)SPF级动物实验室,标准化饲养房笼子喂养,饲以高糖高脂饲料,自由摄食饮水,环境温度20℃~25℃、湿度45%~55%,12h光照周期,每天75%乙醇消毒。所有动物相关的实验过程均经过广东省第二中医院(广东省中医工程技术研究院)伦理委员会批准,符合伦理学要求。
1.1.2 喂养饲料 常规饲料为SPF级实验动物饲料,由广东省实验动物中心提供,许可证号:粤饲证(2019)05073,执行标准:GB14924-2010,成分:粗蛋白≥180g/kg、粗纤维≤50g/kg、粗脂肪≥40g/kg。高糖高脂饲料购自常州鼠一鼠二生物科技有限公司(货号:D12451i),其中含蛋白质20%、碳水化合物35%、脂肪45%。
1.1.3 实验试剂 链脲佐菌素购自北京索莱宝科技有限公司(型号:S8050,规格:1g/瓶),-20℃保存;0.1mol/L、pH 4.5无菌柠檬酸缓冲液购自北京索莱宝科技有限公司(型号:C1013,规格:500mL/瓶)。
1.2 实验方法 本实验在广东省第二中医院(广东省中医药工程技术研究院)SPF级动物实验室进行,许可证号:SYXK(粤)2020-0059。
1.2.1 药品及制备 使用0.1mol/L、pH 4.5无菌柠檬酸缓冲液兑入链脲佐菌素粉剂配置成30mg/mL、20mg/mL、10mg/mL三种规格的链脲佐菌素溶液,随用随配,配置完成后即时使用。
1.2.2 第一批大鼠 选取100只大鼠在饲养笼中饲养1周,并随机分为正常对照组(20只)和糖尿病模型组(80只),均在造模前称体重及查血糖、尿常规、肾功能等指标,留取标本前一天禁食不禁水,尿液在代谢笼中留取。模型组大鼠高糖高脂饲料喂养4周后,一次性腹腔注射链脲佐菌素50mg/kg,每天观察其状态、测量微量血糖(尾部取血)、记录死亡情况等,72h后以血糖值高于16.7mmol/L作为成模标准。正常对照组则自始至终喂养常规饲料,腹腔注射相当容积的0.1mol/L、pH 4.5无菌柠檬酸缓冲液。
1.2.3 第二批大鼠 由于第一批大鼠注射链脲佐菌素3天后开始死亡,至注射4周后80只大鼠死亡达52只,故购买了第二批84只大鼠再次进行实验,随机分为正常对照组8只、模型组76只。正常对照组处理方式与第一批大鼠相同;模型组大鼠则高糖高脂饲料喂养4周后,一次性腹腔注射链脲佐菌素30mg/kg,观察大鼠状态、每天测量微量血糖等,72h后血糖未达16.7mmol/L者,自小剂量至较大剂量分别补充注射链脲 佐 菌 素10mg/kg、15mg/kg、35mg/kg,直 至 血 糖≥16.7mmol/L。
1.3 观察指标每天测量微量血糖,统计微量血糖≥16.7mmol/L的比例,以及造模成功情况和死亡率。
1.4 统计方法 采用SPSS 22.0软件进行数据分析。计量资料以均值加减标准差(±s)表示,两组间均值比较采用两独立样本t/t′检验。无序计数资料以频数(f)、构成比(P)表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 第一批大鼠 采用高糖高脂饲料喂养4周后,一次性腹腔注射链脲佐菌素(50mg/kg)的80只大鼠在72h后微量血糖≥16.7mmol/L的大鼠有75只,其中7只微量血糖超过33.3mmol/L,平均24.70±5.67mmol/L,显著高于正常对照组的5.86±0.93mmol/L,差异有统计学意义(P<0.01),造模成功率达93.75%。然而,大鼠造模后精神状态变差,不活跃,毛发不柔顺,出现腹泻、脱水,进食减少,部分大鼠出现阴囊水肿、血尿等;造模3天后,大鼠开始出现死亡,至注射链脲佐菌素4周时,大鼠死亡率达65.00%(52/80)。
2.2 第二批大鼠 采用高糖高脂饲料喂养4周后,一次性腹腔注射链脲佐菌素(30mg/kg)的76只大鼠在72h后微量血糖多数升高,但最高仅有14.9mmol/L,虽与正常对照组血糖值差异有统计学意义(P<0.01),但造模成功率为0;于1周后第二次补充腹腔注射链脲佐菌素(10mg/kg),72h后仅有1只大鼠微量血糖超过16.7mmol/L,达到20.6mmol/L;于第3周给血糖未达标的大鼠第三次补充腹腔注射链脲佐菌素(15mg/kg),72h后测定大鼠微量血糖无明显变化,无大鼠血糖值达到16.7mmol/L,且均在5.3~7.9mmol/L;于第4周给血糖未达标的大鼠第四次补充腹腔注射链脲佐菌素(35mg/kg),72h后有70只大鼠微量血糖≥16.7mmol/L,造模成功率达92.11%;两组各阶段血糖情况比较见表1。在死亡情况方面,第一次注射链脲佐菌素(30mg/kg)后第6天及第四次补充注射链脲佐菌素(35mg/kg)后3天、第8周后分别死亡1只(血糖14.7mmol/L)、2只(血 糖26.9mmol/L和20.7mmol/L)和2只(血 糖27.8mmol/L和29.6mmol/L),共5只大鼠死亡,死亡率为6.58%,显著低于第一批的65.00%;而成功率为92.11%,与第一批的93.75%相近,差异无统计学意义(P>0.05),详见表2。
表1 第二批大鼠腹腔注射链脲佐菌素各阶段的微量血糖情况比较(±s)
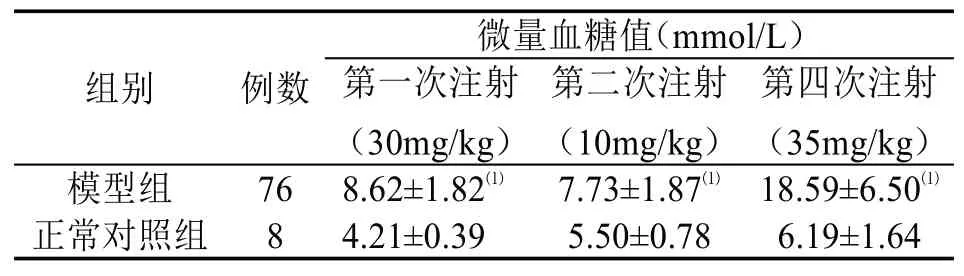
表1 第二批大鼠腹腔注射链脲佐菌素各阶段的微量血糖情况比较(±s)
注:与正常对照组比较,⑴P<0.01
?
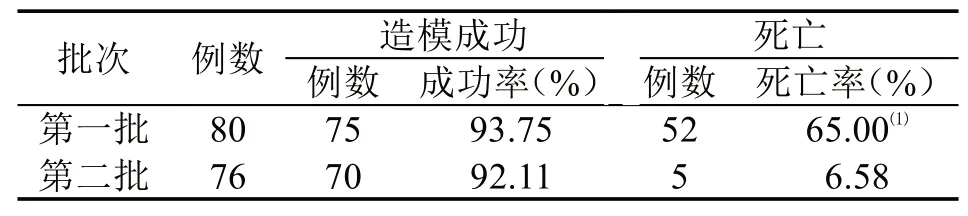
表2 两批大鼠造模结果比较(f,P)
3 讨论
2型糖尿病是人体内胰岛素缺乏或相对缺乏所致的、以高血糖为主要特征的慢性内分泌代谢性疾病,其中胰岛素抵抗在其发生、发展中具有重要作用,内脏脂肪过度堆积可促使脂肪细胞因子的分泌,与葡萄糖代谢、胰岛素敏感性相关的瘦素、脂联素、抵抗素、锌-α2-糖蛋白等在糖脂代谢中发挥特定作用的脂肪细胞因子的失调致使胰岛素抵抗的发生[9],从而使胰岛素作用下降,体内代偿性分泌胰岛素而出现高胰岛素血症;加之长期、过量高糖高脂饮食易损伤胰岛细胞,影响胰岛β细胞对胰岛素抵抗的代偿能力,糖耐量迅速恶化,形成恶性循环,最终导致糖尿病的发生[10]。2型糖尿病具有发病率和致残率高、并发症多等特点,且其发病率越来越高,但其病因病机及有效的防治措施仍在探索当中,因此稳定的糖尿病动物模型的建立对糖尿病及其并发症的发病机制、药物的疗效及其作用机制等方面的研究具有重要的科研和临床意义。
目前,在高糖高脂饲料喂养基础上联合链脲佐菌素注射是糖尿病动物模型构建的主流方法。链脲佐菌素是一种DNA烷基化试剂(氨基葡萄糖-亚硝基脲),其亚硝基脲部分是胰岛β细胞毒性的关键,可通过葡萄糖转运蛋白2(GLUT-2)进入胰岛β细胞并发挥破坏作用,影响糖代谢水平,从而诱导糖尿病的发生[11-12]。与其他药物相比,链脲佐菌素损伤胰岛β细胞的威力大且具有高选择性,对肝肾的危害较小,其诱发的2型糖尿病更好地模拟了人类的发病过程,故被大范围使用[13];但其在水溶液中见光会因变旋而失效,成模率会随着时间延长而逐渐降低,相关研究显示链脲佐菌素放置1.5h后成模率仅为60%[14],因此应现配现用。
尽管链脲佐菌素腹腔注射建立糖尿病模型已经非常成熟且广泛应用,但如何有效提高建模的成功率、降低死亡率且血糖能长期稳定在较高水平,在实际操作中还是存在困难,其涉及的因素较多,如实验动物和方法的选择,以及注射的方式、时机及剂量等等。首先,大鼠是链脲佐菌素诱导糖尿病最常用的动物模型,而大鼠的品种、年龄、性别等均会对建模产生影响:根据不同的实验目的和要求,国内通常会选择SD或Wistar大鼠,实践结果显示SD大鼠对于实验过程中出现的症状有比Wistar大鼠更强的抵抗力和更低的病死率,且自发缓解现象更少[5];此外,成年大鼠、雄性大鼠的成模率分别高于幼鼠和雌性大鼠,雄性大鼠还可以避免受孕对实验数据的影响[15],因此选用了成年雄性SD大鼠构建动物模型。其次,通过查阅相关文献发现,随着高糖高脂饲料喂养的时间延长,成模率也会降低,喂养周期大多在4~8周内[13]。为了提高成模率,本实验在高糖高脂饲料喂养4周后即开始行链脲佐菌素注射。另外,链脲佐菌素注射通常有腹腔注射或尾静脉注射两种方式,虽然尾静脉注射所诱导的糖尿病模型更稳定且重复性较好[16],但其操作难度更大,且若注射过快可能会对心脏造成负担,甚至导致心力衰竭[17],因此选择操作更简便、方法更易掌握的腹腔注射。
链脲佐菌素的注射剂量是对大鼠糖尿病模型成模率影响最大的因素,尽管有大量文献报道可供借鉴,但依照其造模方法在实践过程中也常常会遇到一些问题,如本实验注射链脲佐菌素剂量稍大则一次性成模率非常高,但大鼠死亡率随之升高,对后续实验带来了不良影响,甚至难以为继;若注射剂量太小,一次性成模率又很低,也会影响后续实验。如前所述,链脲佐菌素一次性腹腔注射剂量范围多在30~65mg/kg,也有分次注射不同剂量造模者[18],联合高糖高脂饲料喂养可在减少注射量的同时提高成模率。
本实验第一批大鼠采用高糖高脂饲料喂养4周后,一次性腹腔注射链脲佐菌素50mg/kg,成模率高达93.75%,但造模后第3天即开始大量死亡,死亡率高达65.00%,以至于研究无法继续进行。很显然,50mg/kg的注射剂量明显过大,虽然成模率高,但会导致胰岛β细胞大量破坏,使血糖迅速升高,引起酮症酸中毒而死亡[19-20],致使大鼠死亡率过高,不可取。
在吸取第一批大鼠的教训后,第二批大鼠在同等条件下一次性腹腔注射链脲佐菌素30mg/kg,虽然造模后血糖明显升高,但无一达到成模标准,显然该剂量太低,亦不可取;随后分别补充注射10mg/kg、15mg/kg的链脲佐菌素,血糖均无法达标。因此,一次性腹腔注射链脲佐菌素30mg/kg无法达到造模要求,1周内补充注射10mg/kg、15mg/kg剂量也不能成功造模。第四次注射35mg/kg剂量72h后,大鼠成模率达到了92.11%,成模率与第一批相近,但大鼠死亡率大幅下降,至第8周仅为6.58%。由此推测,在高糖高脂饲料喂养基础上间隔1周两次腹腔注射链脲佐菌素30~35mg/kg是比较理想的造模方法,与Zhang M等[18]间隔1周、连续2周注射链脲佐菌素30mg/kg的报道一致。
曾有文献报道[21],高糖高脂饲料喂养4周、注射链脲佐菌素30mg/kg的成模率最高(80%~85%)且死亡率低,而60mg/kg剂量死亡率最高(可达75%)。但本实验30mg/kg剂量的成模率很低,须在二次注射35mg/kg剂量后才将成模率提升至92.11%、死亡率降至6.58%。由此推测,同样小剂量腹腔注射链脲佐菌素,一次性腹腔注射可能其稳定性并不高,而分次注射可以弥补该缺陷。因此,高糖高脂饲料喂养4周、间隔1周两次腹腔注射链脲佐菌素30~35mg/kg可能是建立大鼠2型糖尿病模型较为合适的方法,其成模率较高、大鼠死亡率低,还可规避大剂量注射引起胰岛β细胞广泛破坏(大鼠未死亡的情况下)而向1型糖尿病模型转化的风险[12],有利于今后2型糖尿病发病机制与治疗干预研究工作的开展。

