不同浓度根系分泌物调控植物土壤微生物群落结构研究
刘志中,陈汉章,杨 娇
(1. 闽西职业技术学院,福建 龙岩 364021; 2. 福建农林大学 林学院,福建 福州 350002)
植被在生长过程中受到水热等一系列因素的制约,为促进自身生长发育,植被体内器官会采取相应的自我调节以适应外在环境的制约,从而形成环境胁迫反应[1-2],水热条件直接制约植被生长发育及新陈代谢,而土壤质量制约植被对养分的利用,对于植被生长发育尤为重要。无论是无机离子还是小分子有机物,这些根系分泌物均作用于植被的根际生长环境[3-4],其受外界环境因子的影响较大,是自我调节作用机理的表现[5],根系分泌物很大一部分会在微生物新陈代谢过程中被吸收,促进了植被及微生物对根际养分的吸收利用,在利于植被生长的同时促进微生物群落分布,提升有机质降解速率。大量学者通过实证研究对比分析得知,在根系分泌物作用下,植株的生长状况相对较好,随着研究的不断深入,不同学者从不同研究角度进行对比分析,在探究植被与土壤关系的同时,注重分析根系分泌物的作用机理,以及微生物的影响机制,从根系土壤及微生物角度,探究物质及能量交换的作用机理[6-7]。
根系分泌物的作用机理具有复杂性和多样性,对土壤活性及养分状况的影响较为复杂,且起着关键作用,进而制约植株的生长发育[8-9]。植被生长除受水热条件的直接影响外,还受土壤及微生物的制约,土壤活性等状况对植被的养分吸收及根系生长产生直接作用[10],而微生物群落分布直接制约土壤有机质的分解和降解,进而制约土壤肥力和活性,对植株生长发育影响复杂,在形成不同微生物群落分布的同时,导致不同质量的土壤分布。影响微生物丰度和均匀度的因子多样且复杂[11-12],微生物的分布状况对有机质的降解产生直接作用,影响土壤养分的积累,在根系分泌物分泌较为充足的情况下,能为微生物新陈代谢提供更多能量,大幅提升有机质的降解速率,微生物群落分布发生改变,土壤质量得以改善。植被群落分布受一系列因素的制约,如外部水热等气候环境,以及根系发达程度、土壤养分状况及微生物分布等,环境因子的交互作用导致其影响因素的复杂性[13-14]。在有机质降解过程中,微生物是主要的分解者,而酶在这一过程中也发挥着无可替代的作用,有利于养分的转化,为植被生长提供更为丰富的养分条件。植被生长发育离不开氮、磷、钾等营养元素,这些营养元素来自于施肥和有机质的降解转化。近年来,大量学者对此开展了一系列研究,但主要从农业及土壤方面开展研究,立足于园林植被的研究较少[14]。基于此,在研究土壤及微生物影响机理的基础上,探究根系分泌物的作用机理,对比微生物分布群落差异,从多个角度探究园林植被生长的影响因子,以利于开展针对性开发及保护。
1 材料与方法
1.1 实验材料
以夹竹桃为研究对象,开展实地连续观测对比。在实地采样过程中采集植被根系,对其进行多次清洗,待清洗干净后置入Hoagland营养液,增氧泵通气处理3 d;通气处理后进行消毒,置于1%浓度的NaClO消毒溶液中,处理15 min,然后使用无菌水进行冲洗,置于1 000 mL烧杯中,无菌水完全浸没,置于温室中培养,分别在6、12、24 h进行指标测定,尤其是液体体积等,最后过滤;减压,10倍浓缩处理,密封后置于实验室待后续指标测定。
1.2 土壤理化性状测定
采用原位土取样法进行土样采集,此方法能有效降低实验误差。采集土样先通过孔径1 mm筛子处理,然后取出80 g进行根系分泌物浓缩液成分测定;土样中各融入10 mL根系分泌物浓缩液,分别置于螺口瓶中用于指标测定。设置高、中、低浓度及对照处理,低浓度处理为10 mL去离子水中加入5 mL根系分泌物;中浓度处理为10 mL根系分泌物与5 mL去离子水混合;高浓度处理为根系分泌物浓缩液15 mL;对照组(CK)为去离子水15 mL,不添加根系分泌物。3次重复实验。
1.3 土壤有机碳、微生物量碳及基础呼吸测定
有机碳SOC含量采用外加热法进行测定,温度180 ℃维持5 min的沸腾状态,在重铬酸钾溶液的参与下,其易形成氧化,采用滴定法核算含量[15]。
采用熏蒸提取法测量微生物量碳(MBC)含量,在干燥器中放入新鲜土样,将NaOH溶液、乙醇氯仿分别置于不同烧杯中,同时放入干燥器中进行真空加热,直至氯仿沸腾3 min,待24 h后进行指标测定[15]。
结合《土壤农化分析》开展土样研究,对微生物群落分布特点进行对比分析[16]。借助Duncan多重比较分析法研究α和β多样性等分布特点[11]。
2 结果与分析
2.1 根系分泌物对土壤理化性状的影响
不同处理土壤理化性状测定见图1。
从图1可以看出,根系分泌物回接后因培养时间和浓度不同,土壤pH、有机碳、全氮含量差异显著,尤其是连续培养3周后的变化更为明显,而全磷含量无明显变化,且未通过0.05显著检验。不同浓度处理,有机碳、全氮含量均存在一定差异,但均高于对照组,且浓度越高的情况下,其含量越高;土壤pH则低于对照组。
2.2 根系分泌物对土壤酶活性的影响
不同处理土壤酶活性测定结果见图2。
从图2可以看出,根系分泌物回接后因培养时间不同,土壤蔗糖酶、磷酸酶、脲酶和过氧化氢酶活性间差异显著,尤其是连续培养3周后的变化更为明显。在根系分泌物浓度越高的情况下,4种酶活性越强,高浓度处理与其他浓度处理相比差异显著,通过了0.05显著检验。
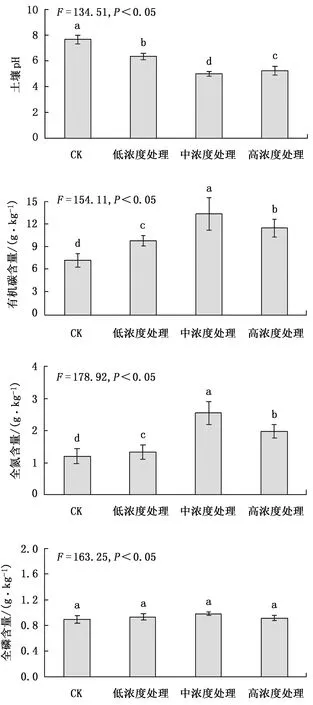
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3 根系分泌物对土壤微生物量碳、氮、磷含量的影响
不同处理土壤微生物量碳、氮、磷含量测定结果见图3。
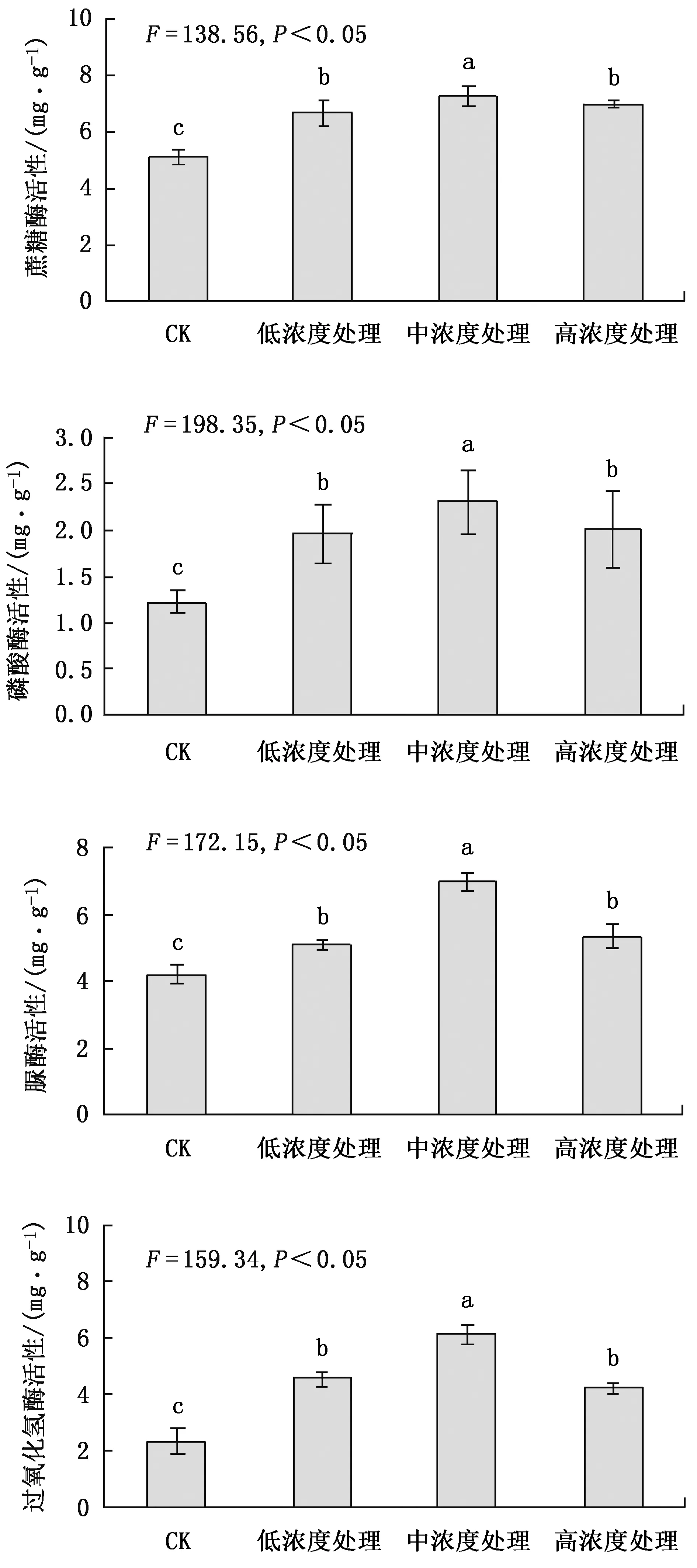
图2 根系分泌物对土壤酶活性的影响Fig.2 Effects of root exudates on soil enzyme activity
从图3可以看出,根系分泌物回接后因培养时间不同,微生物量碳、氮、磷含量间差异显著,尤其是连续培养3周后的变化更为明显。在根系分泌物浓度越高的情况下,微生物量碳、氮、磷含量越高,高浓度处理与其他浓度处理相比差异显著,通过了0.05显著检验。而中浓度处理与低浓度处理相比差异不显著。
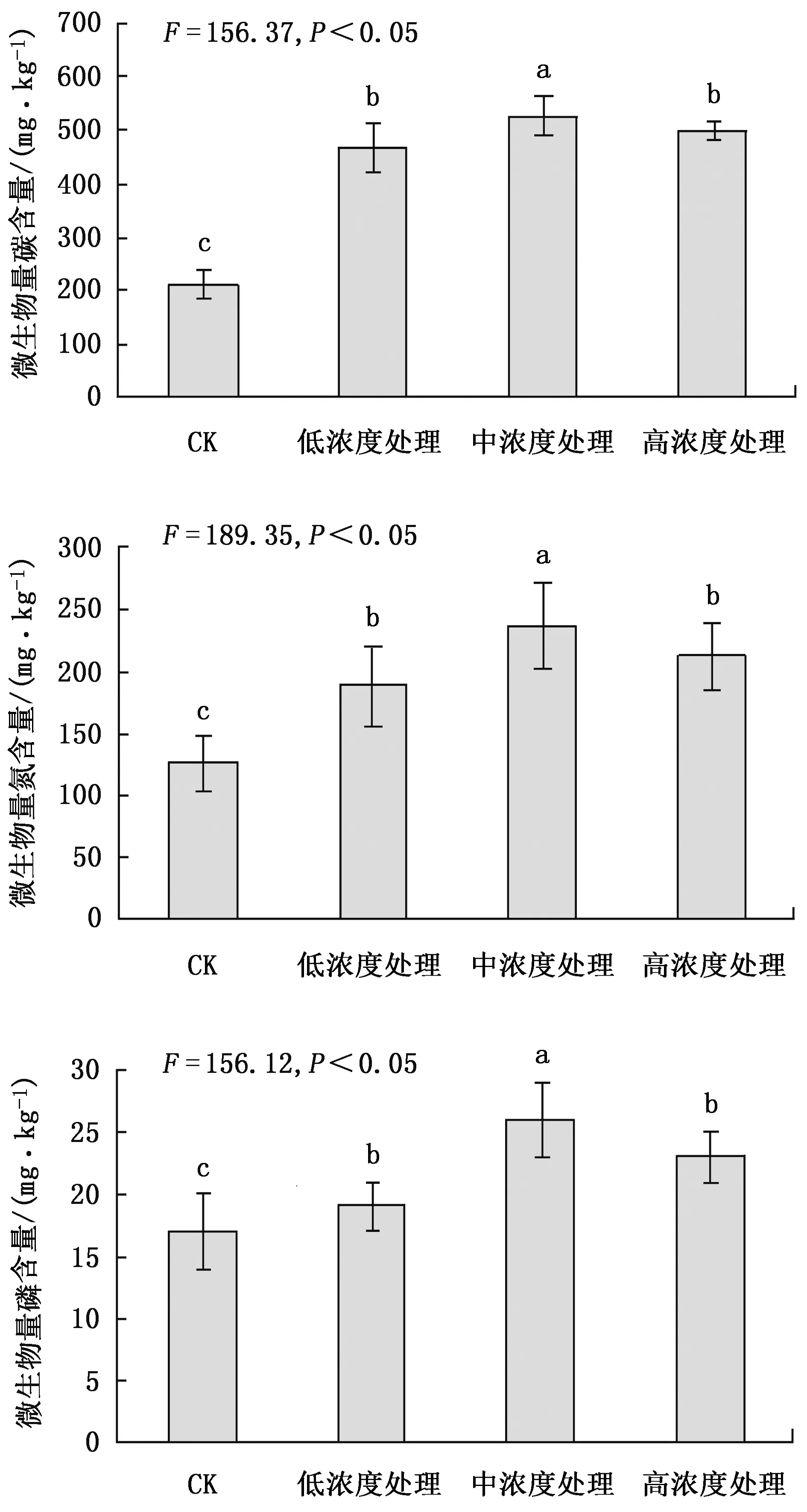
图3 根系分泌物对土壤微生物量碳、氮、磷含量的影响Fig.3 Effects of root exudates on soil microbial biomass carbon, nitrogen and phosphorus contents
2.4 根系分泌物对土壤微生物数量的影响
不同处理土壤微生物数量测定结果见图4。
从图4可以看出,根系分泌物回接后因培养时间不同,细菌、真菌、放线菌数量和微生物总数分布间差异显著,尤其是连续培养3周后的变化更为明显。在根系分泌物浓度越高的情况下,细菌、真菌、放线菌数量及微生物总数越多,高浓度处理与其他浓度处理相比差异显著,通过了0.05显著检验。而中浓度处理和低浓度处理相比差异不显著。
2.5 根系分泌物对土壤微生物呼吸的影响
不同处理土壤微生物呼吸情况见图5。
从图5可以看出,根系分泌物回接后因培养时间不同,土壤CO2释放量间差异显著,尤其是连续培养3周后的变化更为明显。不同浓度处理间差异达显著水平,通过了0.05显著检验。

图4 根系分泌物对土壤微生物数量的影响Fig.4 Effects of root exudates on the number of soil microorganisms
2.6 根系分泌物对土壤微生物群落多样性的影响
不同处理土壤微生物群落多样性情况见图6。
从图6可以看出,不同根系分泌物浓度对微生物群落分布影响较大,微生物丰度指数(H)、均匀度指数(E)间虽有所差异,但均高于对照组,且不同浓度处理间差异达显著水平,通过了0.05显著检验。在根系分泌物浓度越高的情况下,物种丰度指数、均匀度指数、优势度指数(Ds)、碳源利用丰度指数(S)越高;而中浓度处理与低浓度处理相比差异并不显著。
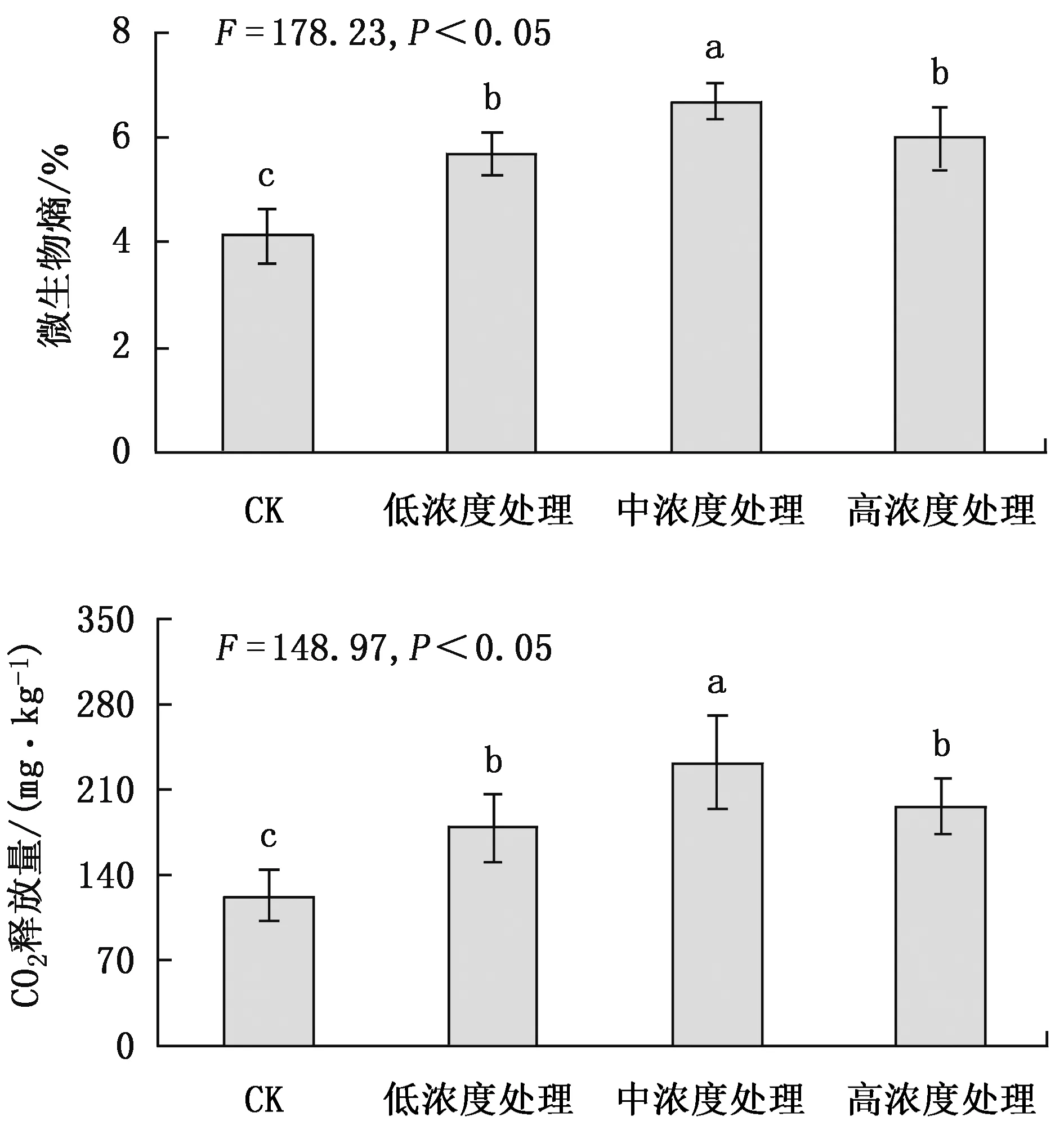
图5 根系分泌物对土壤微生物呼吸的影响Fig.5 Effects of root exudates on soil microbial respiration
2.7 土壤微生物群落代谢功能主成分分析
不同处理土壤微生物群落代谢功能主成分分析结果见图7。
从图7可以看出,主成分分析可以提取两个主成分因子,其变量的方差解释度分别达到49%、37%;在PC2轴的正值端、负值端分别分布着CK处理和中浓度、高浓度处理;而低浓度处理均有分布。PC1轴未能对不同浓度处理进行有效分离。综合来看,中浓度处理土壤微生物群落分布状况与对照组较为接近。
3 结论
通过对比分析得知,不同浓度的根系分泌物对土壤pH的影响存在较大差异,但均低于对照组CK,且通过了0.05水平显著性检验;有机碳、全氮含量均超过对照组,通过了0.05水平显著性检验,且根系分泌物浓度越高,有机碳、全氮含量越高,含量最高的为高浓度处理;土壤全磷含量并未受到根系分泌物浓度的显著影响。

图6 根系分泌物对土壤微生物群落多样性的影响Fig.6 Effects of root exudates on soil microbial community diversity
不同根系分泌物浓度对细菌、真菌、放线菌数量的影响存在较大差异,但均高于对照组CK,通过了0.05水平显著性检验,不同菌群的数量差异达到显著,且根系分泌物浓度越高,细菌、真菌、放线菌数量和微生物总数越多,数量最高的是高浓度处理。微生物量碳、氮和磷受不同根系分泌物浓度的影响,其含量也存在显著差异,通过了0.05水平显著性检验,均超过对照组,且根系分泌物浓度越高,其含量越高,其中最高的是高浓度处理。丰富度指数、Mcintosh指数受不同根系分泌物浓度的影响,也存在较为显著差异,通过了0.05水平显著性检验,且均超过了对照组;浓度越高的情况下,其含量越高,其中最高的是高浓度处理。优势度受不同根系分泌物浓度的影响,其指数也存在一定差异,但并不显著,未通过0.05水平显著性检验[17-19]。通过冗余分析得知,根系分泌物中浓度处理土壤微生物分布及新陈代谢等方面与对照组较为接近,与高浓度处理相比存在显著差异[20]。综合来看,微生物与土壤具有突出的相辅相成关系,共同制约植被生长发育。
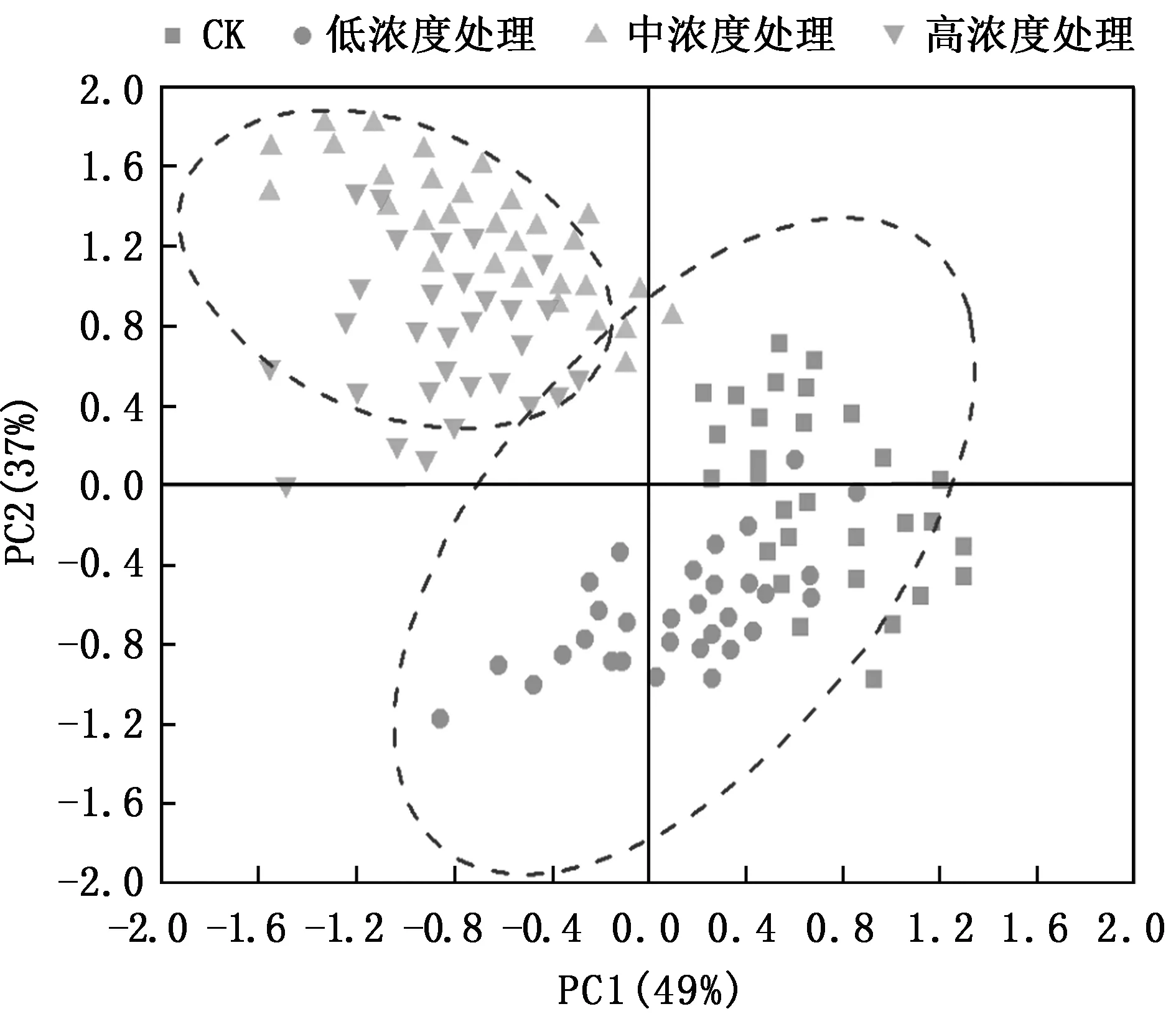
图7 土壤微生物群落代谢功能主成分分析Fig.7 Principal component analysis of metabolic function of soil microbial community

