酵母菌对锡石、方解石和石英的浮选特性影响研究①
苏秀娟,杜婉薇,莫 伟,杨梅金,封金鹏,魏宗武
(广西大学 资源环境与材料学院,广西 南宁 530004)
锡是一种重要的金属材料,具有许多优异性质,在众多领域有着广泛应用。在锡石选矿中,锡石固有的脆性不仅在研磨过程中,而且在其他各种过程中都会产生大量细粉[1]。目前生产实践中多采用浮选工艺回收细粒锡石,几十年来,国内外学者围绕锡石浮选开展了大量研究,并取得了一定研究成果[2-3]。生物浮选法是一种利用微生物作为表面改性剂、通过矿石与微生物的相互作用选择性分离脉石和矿石的一种较新的浮选方法[4]。在生物浮选技术中,天然细菌代替有毒化学物质作为浮选药剂具有极大的吸引力和应用前景。目前,已经应用到铁矿、磷矿等生物浮选的微生物有多粘类芽孢杆菌、草分支杆菌、红球菌、氧化亚铁硫杆菌、酵母菌等[5-7]。然而,关于生物浮选锡石的报道并不多。与其他微生物相比,酵母菌廉价易得,并且对重金属、低pH值等外界条件都具有较强的耐受能力,现已较多地应用于废水生物修复、重金属积聚等[8-9]。酵母菌具有细胞壁和细胞膜构成的双层网状结构,其丰富的氨基、羟基、羧基和磷酸基团等与很多锡石浮选捕收剂相似[10]。基于此,本文系统研究了酵母菌捕收剂对锡石、方解石和石英纯矿物的浮选特性,并通过动电位、傅里叶红外光谱和扫描电镜探讨了酵母菌与矿物相互作用机制。
1 矿样性质及试验方法
1.1 矿样性质
纯矿物样品化学成分分析结果见表1。其中锡石单矿物纯度高于96%,方解石单矿物纯度高于97%,石英单矿物纯度高于98%,均符合纯矿物浮选试验要求。

表1 纯矿物化学组分分析结果(质量分数)/%
1.2 微生物培养
试验所用酵母菌来自于实验室。酵母菌在含酵母膏1%(1 g/100 mL)、蛋白胨2%(2 g/100 mL)、葡萄糖2%(2 g/100 mL)的液体培养基中,于型号为QE-1的空气浴恒温振荡器中培养,培养条件为无菌、28℃、150 r/min。
1.3 试验方法
1.3.1 纯矿物浮选试验
纯矿物浮选试验使用-38μm粒级锡石以及-74μm粒级方解石和石英,浮选方法如下:称取一定量纯矿物样品(锡石、方解石或石英),与离心好的一定量酵母菌混合于试剂管中摇晃一定时间;将混合后的样品倒入浮选槽中,加超纯水,按图1所示流程进行浮选试验。精矿和尾矿经洗涤、过滤、干燥后称重,计算浮选质量回收率。

图1 浮选试验流程
1.3.2 二元体系矿物浮选试验
二元体系矿物浮选试验是将锡石与脉石矿物(方解石或石英)按质量比1∶1混合,再按图1所示流程进行浮选,计算浮选金属回收率。
1.3.3 分析测试方法
使用手持式XRF光谱仪测量矿物锡元素品位。使用多角度粒度及高灵敏Zeta电位分析仪测量矿物样品和微生物样品Zeta电位。使用傅里叶红外光谱仪对矿物和微生物进行红外光谱分析。采用X射线衍射分析仪完成矿石的矿物组成及定性分析。使用场发射扫描电子显微镜表征样品形貌。
2 结果与讨论
2.1 纯矿物浮选试验
2.1.1 培养时间对浮选回收率的影响
在矿浆pH=8、酵母菌浓度1.25 g/L、2#油用量104 mg/L、作用时间15 min条件下,研究了酵母菌培养时间对纯矿物浮选回收率的影响,结果见图2。酵母菌培养时间对锡石、方解石和石英的浮选回收率影响较小。酵母菌对锡石的回收率在培养时间24 h时最高,为77.49%,随着培养时间增长,回收率有所降低,但幅度较小;酵母菌对方解石的回收率在培养时间120 h时最高,为61.36%;酵母菌对石英的回收率在培养时间48 h时最高,为22.96%。

图2 酵母菌培养时间对浮选回收率的影响
2.1.2 矿浆pH值对浮选回收率的影响
酵母菌培养时间24 h、浓度1.25 g/L、2#油用量104 mg/L、作用时间15 min条件下,研究了酵母菌在不同矿浆pH值下对纯矿物浮选回收率的影响,结果见图3。pH=6时,锡石回收率最高,为78.83%,在6<pH<10范围内,锡石回收率有所下降。方解石在pH=7时回收率最高,为63.67%。pH值对石英浮选回收率影响较小。由此可以预测,在pH值6和8时,都能较好地分离锡石与脉石矿物。

图3 矿浆pH值对浮选回收率的影响
2.1.3 作用时间对浮选回收率的影响
酵母菌培养时间24 h、浓度1.25 g/L、2#油用量104 mg/L、矿浆pH=8条件下,研究了酵母菌作用时间对纯矿物浮选回收率的影响,结果见图4。酵母菌与矿物的作用时间对浮选回收率的影响没有明显规律,其中反应时间15 min时,锡石回收率最高,为78.22%,随着反应时间延长到30 min,酵母菌作用下的3种矿物回收率均有下降趋势。
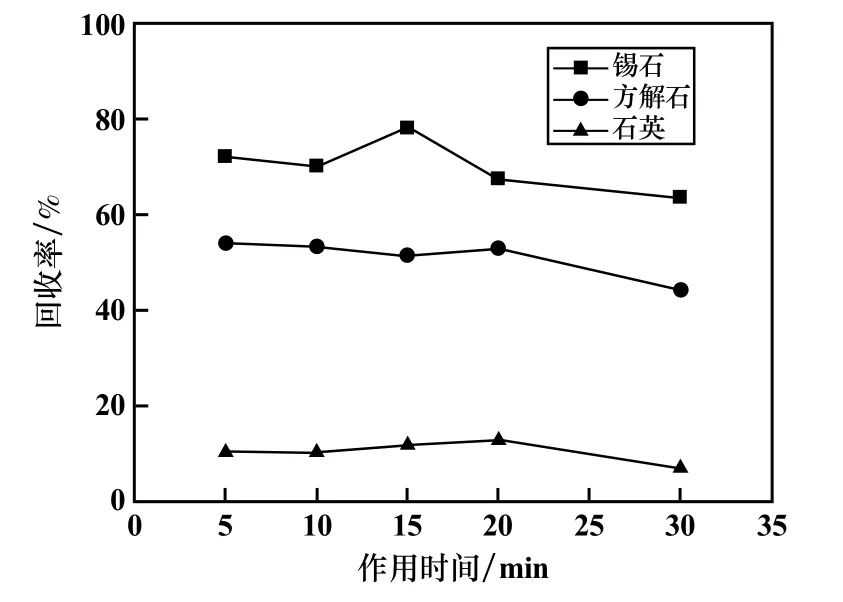
图4 作用时间对浮选回收率的影响
2.1.4 酵母菌浓度对浮选回收率的影响
酵母菌培养时间24 h、2#油用量104 mg/L、溶液初始pH=8、作用时间15 min条件下,研究了酵母菌浓度对纯矿物浮选回收率的影响,结果见图5。酵母菌浓度小于1.25 g/L时,酵母菌对3种纯矿物的浮选都具有促进作用;酵母菌浓度1.25 g/L时,锡石、方解石和石英回收率分别为75.51%、63.09%和18.34%;酵母菌浓度大于1.25 g/L时,酵母菌对3种矿物都产生了抑制作用,随着酵母菌浓度增加,抑制效果更明显,酵母菌浓度5 g/L时,3种矿物回收率均为0。适量酵母菌可以促进矿物浮选,但过量酵母菌会抑制矿物浮选。

图5 酵母菌浓度对浮选回收率的影响
2.1.5 锡石粒度对浮选回收率的影响
酵母菌培养时间24 h、浓度1.25 g/L、2#油用量104 mg/L、溶液初始pH=8、作用时间15 min条件下,研究了酵母菌对不同粒度锡石浮选回收率的影响,结果见表2。结果表明,酵母菌对更细粒(-5μm粒级)锡石具有更好的浮选效果。

表2 酵母菌对不同粒度锡石浮选回收率的影响
2.2 二元体系矿物浮选试验
酵母菌培养时间24 h、2#油用量104 mg/L、溶液初始pH=6、作用时间15 min、浮选时间3 min条件下,研究了酵母菌对二元体系矿物浮选锡金属回收率的影响,结果见图6。二元体系下,随着酵母菌浓度增加,锡金属回收率下降,与纯矿物浮选试验结果一致。酵母菌浓度0.125 g/L时,锡石/方解石二元体系和锡石/石英二元体系锡金属回收率分别为85.66%和90.71%,较好地实现了锡石与方解石/石英的分离。
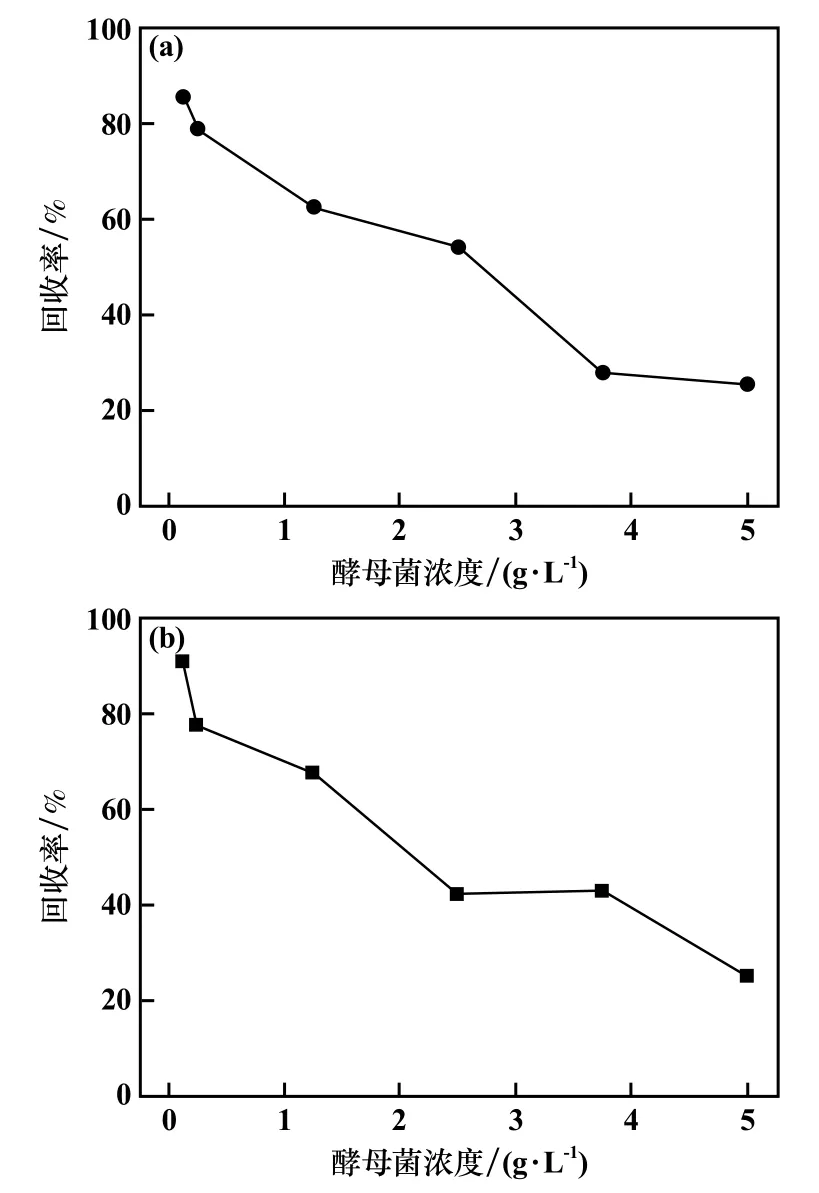
图6 酵母菌浓度对锡金属浮选回收率的影响
2.3 酵母菌与矿物吸附机理研究
2.3.1 扫描电镜分析
图7为酵母菌与矿物作用后的扫描电镜图。可以看到大量的细颗粒锡石吸附在酵母菌上,较大颗粒锡石并没有吸附。只有部分酵母菌吸附在方解石和石英表面,酵母菌表面光滑,没有矿物黏附。

图7 酵母菌与矿物作用后的扫描电镜照片
2.3.2 Zeta电位分析
研究了不同pH值条件下矿物与酵母菌作用前后的Zeta电位变化情况,结果如图8所示。pH=2~10范围内,酵母菌表面均带负电。矿物与酵母菌作用前,锡石等电点约为2.5,石英等电点约为2.3,锡石和石英Zeta电位随pH值增大而降低;方解石在pH=6~10范围内均带负电。矿物与酵母菌作用后,锡石和石英等电点均向左发生了较小偏移,电位曲线向酵母菌偏移,说明静电力对锡石、石英与酵母菌吸附具有积极作用。方解石与酵母菌作用后Zeta电位曲线向上偏移,说明静电力不是方解石与酵母菌吸附的主要作用力。

图8 矿物与酵母菌作用前后Zeta电位变化曲线
2.3.3 红外光谱分析
矿物与酵母菌作用前后的红外光谱如图9所示。由图9可知,锡石的显著特征吸附带出现在640 cm-1附近[11]。方解石3个主要特征峰分别为1 426 cm-1、878 cm-1、710 cm-1,这些特征吸收峰均与矿物内部的CO3

图9 矿物与酵母菌作用前后的红外光谱图
2-相关;方解石的红外振动模式均与前人研究精确匹配[12]。石英的779 cm-1吸收峰为石英特征峰,690 cm-1吸收峰属于Si—O—Si对称伸缩振动吸收峰,460 cm-1吸收峰为Si—O弯曲振动的吸收峰,1 083 cm-1吸收峰属于Si—O伸缩振动造成的吸收峰。酵母菌红外光谱分析的灵敏区集中在1 800~900 cm-1之间,2 927 cm-1附近的谱峰来自细胞结构中核酸、蛋白质、脂类的—CH2—对称或反对称及—CH3反对称收缩振动;1 653 cm-1为酞胺结构—CO—NH中CO伸缩振动峰;1 536 cm-1附近为N—H变形振动峰和C—N伸缩振动峰;1 400 cm-1为C—O—H面内变形振动;1 240 cm-1及1 078 cm-1谱峰分属核酸分子内磷酸二酯基团RO3PO伸缩振动峰的PO伸缩,或HPO42-的反对称伸缩。与酵母菌作用后,锡石表面出现新的吸附带,均为酵母菌的吸附带,方解石和石英表面并未出现明显的酵母菌吸附带。红外光谱分析结果与扫描电镜结果一致。
3 结 论
1)一元体系下,在培养时间24 h、pH=6、酵母菌浓度1.25 g/L、作用时间15 min条件下,锡石回收率为78.83%。适量酵母菌可以促进锡石浮选,但过量酵母菌会抑制锡石浮选。酵母菌对微细粒锡石具有较好的吸附性。
2)二元体系下,以酵母菌为捕收剂浮选分离锡石和石英、方解石具有可行性。在pH=6、酵母菌浓度0.125 g/L时,锡石/方解石二元体系中锡金属回收率为85.66%,锡石/石英二元体系中锡金属回收率为90.71%。
3)Zeta电位测试结果表明,矿物与酵母菌作用后,锡石和石英等电点向左偏移,Zeta电位向酵母菌电位方向移动,电位趋向于变得更负,而方解石Zeta电位向正值方向移动;扫描电镜测试结果表明,酵母菌可以大量吸附-5μm粒级锡石,而对大颗粒锡石的吸附作用不太明显;酵母菌与方解石、石英的吸附作用主要发生在矿物表面。傅里叶红外光谱测试结果表明,锡石与酵母菌作用后,表面出现新的吸附带,均为酵母菌吸附带,推测酵母菌与锡石吸附时可能发生了化学作用。方解石、石英与酵母菌作用后,表面并未出现酵母菌吸附带,酵母菌与方解石、石英没有发生化学作用。

