山楂多酚微胶囊制备及理化性质分析
余金橙,王淑玉,崔 楠,刘素稳,, ,李淑英,徐永平,常学东
(1.河北科技师范学院食品科技学院,河北省燕山农业特色产业技术研究院,河北秦皇岛 066000;2.河北省燕山特色果品加工技术创新中心,河北承德 067000;3.大连赛姆生物工程技术有限公司,辽宁大连 116000)
山楂(Crataegus pinnatifida)属蔷薇科植物,季节性果实,具有良好的经济属性[1]。山楂果实富含多酚类物质,具有多种药用功效,如抗氧化、调解血糖、血脂、抗辐射、抗癌等[2-3]。研究表明,山楂多酚的强抗氧化性是其发挥多种药理学功能的重要原因[4]。然而,多酚由于活泼的酚羟基结构易受到光、热、氧、pH等不良环境条件影响[5],限制了其在食品加工中的商业化应用。提高山楂多酚稳定性成为实现其在食品加工中应用的重要研究方向。目前可通过微胶囊化、分子包埋[6]、化学改性(如糖基化、羟基化和酰基化等)、纳米技术[7]等方式改善稳定性[8]。
微胶囊技术是降低生物活性成分损失,提高稳定性的常用方法及有效手段[9]。微胶囊制备方法多样,常见的有喷雾干燥法、冷冻干燥法、界面聚合和酵母微胶囊法等[10],喷雾干燥法由于具操作简便、效率高和生产易控等优势成为常用的微胶囊化方法被用于商业化连续生产[11]。喷雾干燥茶多酚微胶囊具有较高的热稳定性[12],对比锐孔浴法和喷雾干燥法也得出喷雾干燥苹果渣多酚微胶囊具备更高的稳定性[13]等。因此,本研究的目的是通过喷雾干燥法制备山楂多酚微胶囊,优化山楂多酚微胶囊的制备工艺,对微胶囊进行表征,分析微胶囊化前后抗氧化性和稳定性变化,为提高山楂多酚稳定性以及在食品工业应用提供参考。
1 材料与方法
1.1 材料与仪器
新鲜燕瓤红山楂 采购于河北承德宽城县,收获日期2020年9月20日,八成熟,去除田间热后贮藏于-20 ℃;乳清分离蛋白 食品级,廊坊纳科新材料技术有限公司;β-环糊精(β-CD) 食品级,河南万邦实业有限公司;阿拉伯胶 食品级,天津市风船化学试剂科技有限公司;无水乙醇 分析级,天津欧博凯化有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)
分析级,西亚化学科技有限公司;过氧化氢 分析级,河南正商科技有限公司;水杨酸 分析级,郑州双辰商贸有限公司;Folin-Ciocalteu试剂 分析级,国药集团化学试剂有限公司。
SD-06喷雾干燥仪 嘉盛(香港)科技有限公司;S-3400N型电子扫描电镜 日立高新技术(上海)国际贸易有限公司;LA-920型粒度仪 日本Horiba公司;Great 20型傅里叶红外变换光谱仪 中科瑞捷(天津)科技有限公司;NETZSCH STA 449 F3型热重分析仪 Germany Bruck;US-1500CS型紫外可见分光光度计 上海美谱达仪器有限公司;N-1100型旋转蒸发仪 上海爱朗仪器有限公司;800D电动离心机 郑州长城科工贸有限公司;GNP-9080恒温培养箱 无锡玛瑞特科技有限公司;HHS-2S恒温水浴锅 海宜昌仪器有限公司。
1.2 实验方法
1.2.1 山楂多酚提取物的制备 参照Liu等[14]的研究方法。山楂去核,打浆,加入70%酸化乙醇,30 ℃搅拌提取,抽滤后真空蒸发,AB-8大孔树脂吸附后,蒸馏水洗去多余杂质后用酸化乙醇洗脱,收集洗脱液,冷冻干燥成粉末,-18 ℃避光贮藏备用。
1.2.2 山楂多酚微胶囊的制备 参照Sharayei等[15]的方法,稍作修改。分别配制8%β-环糊精、8%乳清分离蛋白、1%的阿拉伯胶和4%的山楂多酚溶液,三种壁材溶液按照1:1:1的比例混合,与多酚溶液按照不同芯壁比(v/v)(1:2、1:3、1:4、1:5、1:6、1:7),用磁力搅拌器在不同时间下进行搅拌乳化处理(5、10、15、20、25、30 min)。设置不同的进风温度(160、165、170、175、180、185 ℃),固定两个变量(分别固定芯壁比为1:3、进风温度为170 ℃、乳化时间为10 min),改变一个变量进行喷雾干燥得到的粉末即为山楂多酚微胶囊。
1.2.3 包埋率和载药量的测定 多酚测定参考林倩等的研究方法[16],稍作修改。称取5 mg没食子酸于50 mL烧杯中,蒸馏水溶解定容,配成0.1 mg/mL标准液,取0.25、0.5、0.75、1.0、1.25、1.5 mL没食子酸标液加入容量瓶,再加入福林酚试剂、Na2CO3溶液定容,用蒸馏水代替样液作为空白对照,反应1 h。760 nm波长处测吸光度,以没食子酸浓度(x)为横坐标,吸光度(y)为纵坐标,绘制标准曲线。标准曲线方程为y=0.1223x+0.0083(R2=0.9993)。
微胶囊溶于水,不溶于乙醇。称取0.05 g山楂多酚微胶囊两份,一份用于表面游离多酚的测定,一份用于微胶囊总多酚的测定,分别加入相同体积(5 mL)的无水乙醇和蒸馏水,加入无水乙醇的样品在1790×g下离心10 min,取上清液0.1 mL按上述多酚测定方法进行测定,即为表面游离多酚,溶解于水中样品即为微胶囊总多酚含量。微胶囊总多酚与表面游离多酚之差即为微胶囊内多酚含量,在760 nm波长处测定吸光度值并计算包埋率和载药量。包埋率和载药量计算公式如下[17]:

式中:W1为微胶囊表面游离多酚含量,μg/mL;W为微胶囊总多酚含量,μg/mL;M0为微胶囊内多酚质量,g;M:微胶囊总质量,g。
1.2.4 响应面优化试验 根据单因素实验结果设计响应面因素水平,进行参数优化实验。以包埋率和载药量为评价指标确定最优制备参数,因素水平设计见表1。
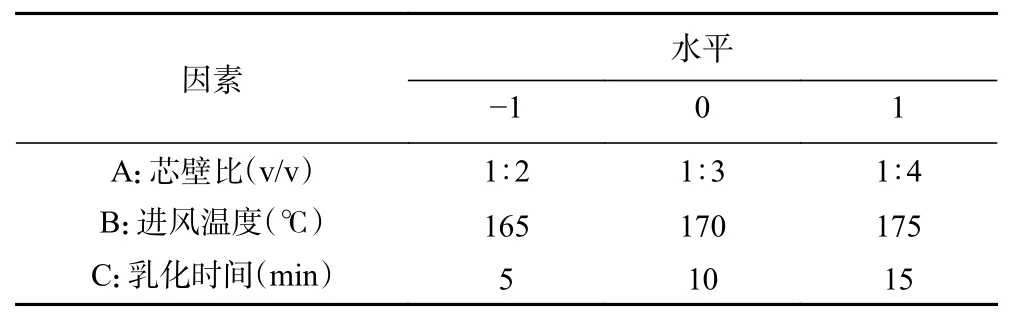
表1 响应面试验的因素与水平设计Table 1 Factors and horizontal design of response surface test
1.2.5 粒径的测定 取适量的微胶囊于烧杯中,以无水乙醇为分散剂,吸取5.0 mL、0.1 g/mL的微胶囊溶液于激光粒度仪测量槽中,样品折射率为1.5,转速为2500 r/min,激光粒度分析仪测定微胶囊平均粒径大小[18]。
1.2.6 微胶囊微观表面形态观察 取0.5 mg山楂多酚微胶囊用导电胶固定在样品台上,15 mA喷金处理5 min,置于扫描电子显微镜样品室中,在15 kV扫描电镜观察微胶囊表观形态[19]。
1.2.7 抗氧化实验
1.2.7.1 清除DPPH自由基 参考Ngombe等[20]方法,稍作修改。配制0.1 mmol/L DPPH溶液,1 mg/L山楂多酚溶液、山楂多酚微胶囊溶液和VC溶液。一定量的样品溶液加入3 mL DPPH溶液,517 nm处测吸光度As;无水乙醇加入DPPH溶液做对照,测吸光度Ac;无水乙醇加入样品溶液做空白,测吸光度Ab,反应15 min,以同样方法测VC作为阳性对照。根据以下公式计算清除率:
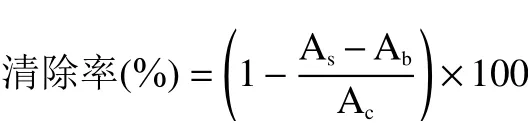
1.2.7.2 清除羟基自由基 参考Shen等[21]方法,稍作修改。在比色管中依次加入一定量1 mg/mL样品溶液、10 mmol/L的FeSO4溶液1 mL、8.8 mmol/L的H2O2溶液1 mL、10 mmol/L水杨酸溶液1 mL,37 ℃反应30 min,以蒸馏水作参比,在510 nm波长处测吸光度Ai,同时做不加显色剂的样品空白测吸光度Aj,以蒸馏水代替不同浓度的样品溶液测吸光度Ao。每个浓度梯度做3个平行样,取平均值;以同样方法测VC作为对照。
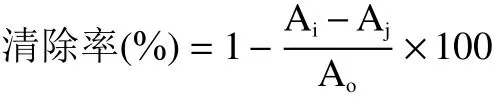
1.2.7.3 清除超氧阴离子自由基 参考Liu等[22]的方法,稍作修改。取4.5 mL pH=8.2 Tris-HCl缓冲液,分别加入一定量的样品溶液(50 mg/mL),25 ℃保温20 min,加入邻苯三酚(50 mmol/L稀释10倍)0.2 mL,320 nm测吸光度Ai;同时用蒸馏水代替样液作空白对照,5 min后测吸光度A0;以同样的方法测定VC作为对照。
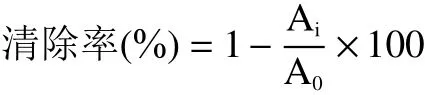
1.2.8 微胶囊稳定性的测定 参照Li等[6]的方法,稍作修改。
1.2.9 光稳定性 各取0.50 g山楂多酚和山楂多酚微胶囊于锥形瓶中,第一组在自然光下静置保存,第二组于完全避光的环境静置,测定760 nm吸光度,24 h测一次,共测10 d。光稳定性以多酚保留率表示,保留率计算方式如下:

1.2.10 热稳定性 各取0.50 g山楂多酚和山楂多酚微胶囊于锥形瓶中,放在不同温度(25、40、60、80 ℃)下水浴60 min,测定760 nm吸光度。热稳定性以多酚保留率表示,保留率计算方式见1.2.9。
1.2.11 贮藏稳定性 各取0.50 g山楂多酚和山楂多酚微胶囊,分别采用真空包装和无包装条件下贮藏28 d,分别取0、7、14、21和28 d分析二者的保留率。保留率计算方式见1.2.9。
1.2.12 体外模拟胃肠道消化 各取0.50 g山楂多酚和山楂多酚微胶囊于锥形瓶中,加入100 mL人工胃液(在1000 mL 模拟胃液中,胃蛋白酶3.2 g,NaCl 2.0 g,HCl调pH至1.2);在37 ℃ 180 r/min恒温水浴振荡器中释放2 h,分别在0.5、1和2 h取样品1mL,在8000 r/min转速下离心10 min,取上清液检测溶液中多酚含量[23],每次取后并补充等体积的胃液。调节样品pH至6.8终止胃液消化,加入肠液(在1000 mL模拟肠液中,胰蛋白酶10.0 g,磷酸二氢钾6.8 g,NaOH调pH至6.8)100 mL进行6 h的消化实验,分别在1、2、3、4、5和6 h进行上述离心操作,取上清液检测溶液中多酚释放情况[24],每次取后并补充等体积的肠液。释放率计算公式如下:
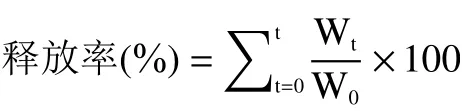
其中:Wt为每个时间点测得的山楂多酚累计释放量,μg/mL;t为体外释放时间,h;W0为初始山楂多酚含量,μg/mL。
1.3 数据处理
每组实验设置三组平行,取平均值,结果用“平均值±标准偏差”表示。用SPSS22.0进行Duncan’s多重差异分析试验数据的显著性,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 单因素实验结果
山楂多酚微胶囊化单因素结果如图1所示。在1:2~1:7范围内,评估芯壁比对山楂多酚微胶囊包埋率和载药量的影响,包埋率随壁材溶液添加量增加逐渐增大,载药量呈下降趋势。当芯壁比为1:3时,微胶囊包埋率为85.28%,载药量为16.24%(图1A)。芯壁比较小时,成膜速度较快,不容易破裂,包埋率上升。若芯壁比越大,载药量就越小,生产成本增加[25]。
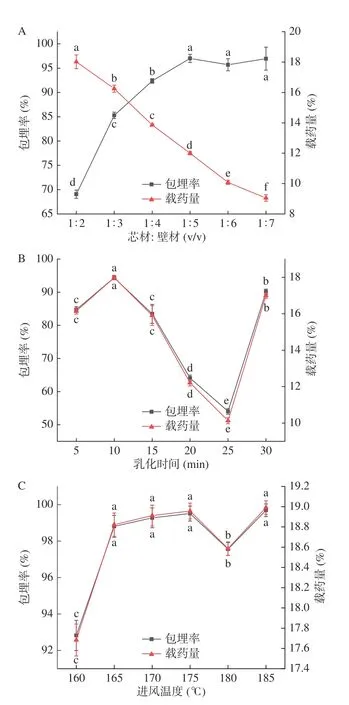
图1 单因素实验结果Fig.1 Results of single factor experiments
乳化时间10 min时,微胶囊包埋率为94.38%,载药量为17.98%。5~10 min内包埋率和载药量呈上升趋势,延长乳化时间,包埋率降低(图1B)。可能是因为乳化时间越长,可能会导致芯材黏壁现象,也可能是乳化时间过长导致芯材流出,从而使包埋率降低[26];乳化时间分别为5 min和15 min时,包埋率和载药量无显著性差异(P>0.05)。
进风温度在160~185 ℃之间,微胶囊包埋率在90%以上,载药量在17%以上。进风温度为165 ℃时,微胶囊包埋率和载药量分别为98.81%和18.82%,进风温度在165~175 ℃之间,包埋率变化不显著(P>0.05)(图1C)。进风温度在180 ℃时,可能原因为温度过高,水分过度蒸发导致微胶囊破裂或者微胶囊表面快速皱缩,影响包埋率和载药量[27]。但温度过低会产生雾珠,出现黏壁现象,影响微胶囊的包埋率和载药量。综上所述,分别选择芯壁比为1:3、乳化时间为10 min、进风温度为165 ℃进行三因素三水平的参数优化实验。
2.2 响应面优化试验结果
2.2.1 包埋率、载药量回归方程的建立及显著性分析 响应面试验结果见表2。使用响应面软件以包埋率、载药量作为响应值,得到如下公式:
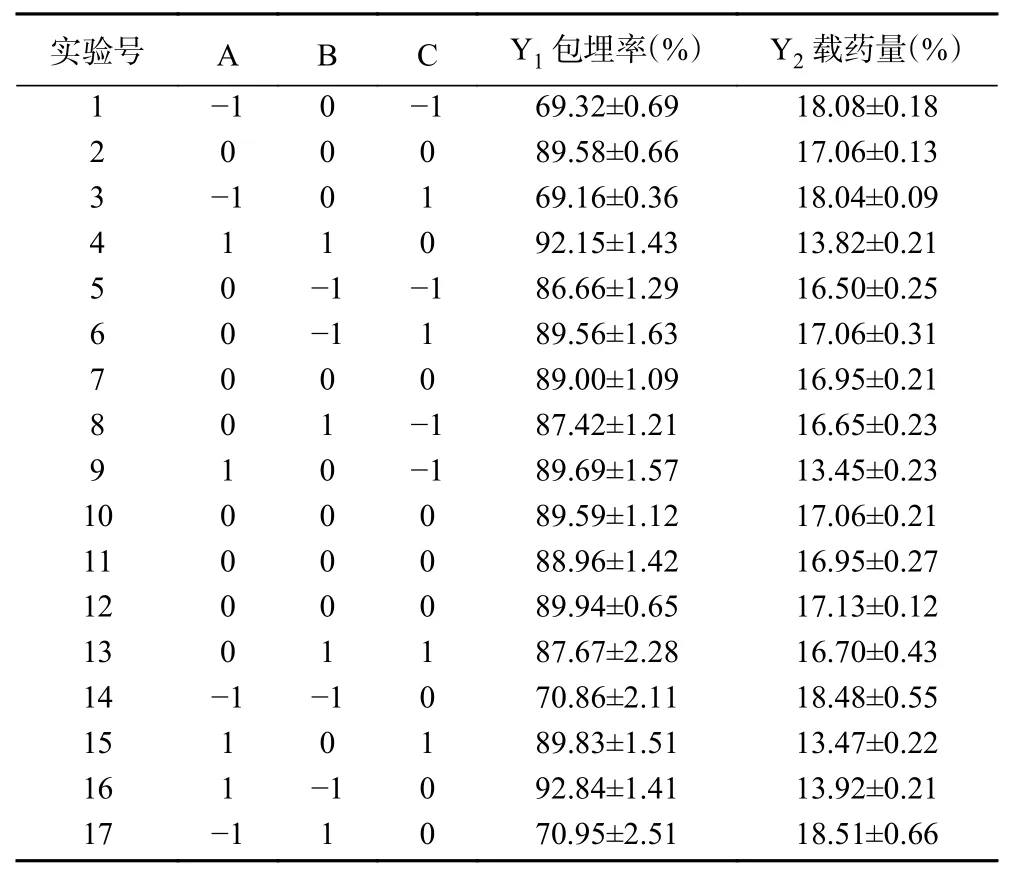
表2 响应面试验结果Table 2 Results of response surface analysis

响应面回归方程方差分析见表3。
表3 响应面回归方程方差分析Table 3 Variance analysis of the response surface regression equation
方差分析可知,试验模型P<0.0001,说明模型显著;模型包埋率的确定系数R2=0.9978,R²Adj=0.9950;载药量的确定系数R2=0.9983,R²Adj=0.9962,说明该模型能够解释99.00%以上响应值的变化,失拟项>0.05,表明模型具有显著性。可以用来预测山楂多酚微胶囊的包埋率和载药量。由表3可知芯壁比的一次项、二次项和乳化时间的二次项对包埋率和载药量影响极显著(P<0.01),其余均不显著。各项单因素对包埋率和载药量的影响顺序均为:芯壁比>乳化时间>进风温度。根据表3交互项显著性检验分析可知,AB、AC、BC的交互项,P>0.05。曲面越陡表示两因素的交互作用显著,图2中交互作用曲面图不陡,结合图2和表3可知各因素交互作用对包埋率和载药量不显著,各因素交互作用响应面图如图2所示。
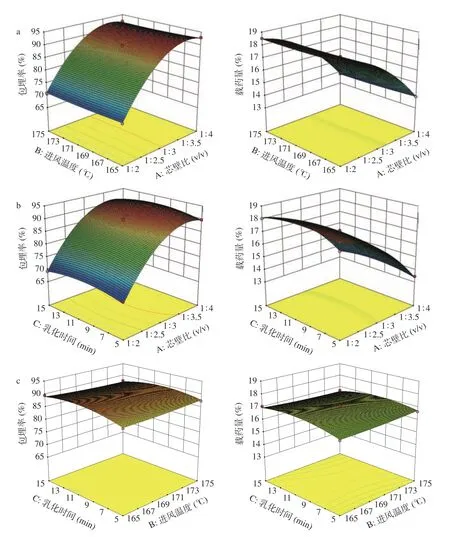
图2 各因素交互作用对包埋率、载药量响应面图Fig.2 Response surface map of interaction of various factors on entrapment rate and drug loading
2.2.2 验证实验 利用响应面软件中的Box-Behnken设计,对包埋率和载药量进行优化分析。通过回归方程分析,得到山楂多酚微胶囊的最佳工艺参数:芯壁比为1:2.948,进风温度为165℃,乳化时间为11.381 min。考虑实际操作问题,以芯壁比1:3,进风温度165 ℃,乳化时间11.4 min,进行验证,得出微胶囊实际包埋率为94.45%±1.03%,预测值为89.50%;微胶囊的实际载药量为17.99%±0.20%,预测值为17.27%。实测值和预测值相差不大,表明模型可靠性好。
2.3 微胶囊粒径测定
微胶囊的粒径范围为5~200 μm[28],微胶囊粒径分布与包埋效果有关,在微胶囊的粒径分布范围内,若粒径过大,表明包埋效果不好,芯材的保留率会变低[29];粒径越小,表明微胶囊芯材释放效果越佳,越利于人体肠道吸收利用。由图3可知,在最优条件下制备的山楂多酚微胶囊粒径分布在1.5~20 μm之间,平均粒径为6.77 μm,50%微胶囊粒径为6.44 μm,10%粒径为3.79 μm,90%粒径为10.09 μm,粒径呈正态分布,说明最优条件下微胶囊的粒径大小分布均匀。
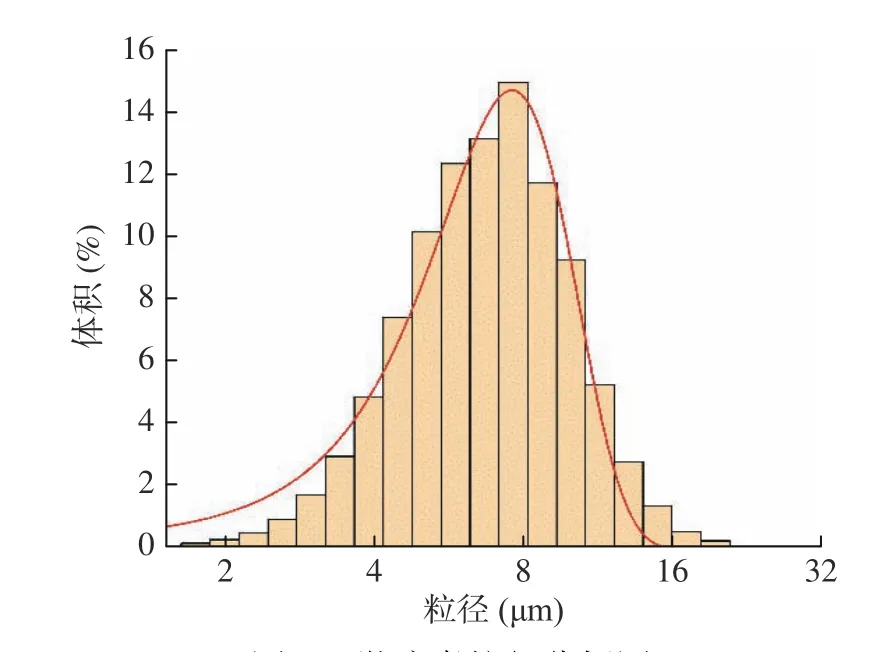
图3 微胶囊粒径分析图Fig.3 Microcapsule particle size analysis
2.4 微胶囊微观形貌观察
扫描电镜可以更好地观察微胶囊的表面微观结构。由图4可知,β-环糊精、阿拉伯胶、乳清分离蛋白与山楂多酚a,b,c,d呈块状,β-环糊精表面粗糙;阿拉伯胶、乳清分离蛋白与山楂多酚表面光滑,可能与材料本身的性质有关。在最优工艺条件下,喷雾干燥法制得的山楂多酚微胶囊(图4e、图4f)颗粒完整,近似球形,分散性好,无粘结情况。部分微胶囊表面出现褶皱或凹陷,可能是在喷雾干燥过程中,高温导致的水分挥发不均匀导致[30]。微胶囊的表面出现褶皱但无破裂的情况,仍保持一定的形状,说明该壁材具有强支撑性,对芯材具有很好的保护作用。乔绚[31]利用喷雾干燥法制备茶粉微胶囊,结果也表明微胶囊近似球形,表面有褶皱但无破裂现象,和本实验结果一致。

图4 微胶囊扫描电镜图Fig.4 Sem image of microcapsules
2.5 抗氧化性实验
2.5.1 微胶囊抗氧化能力分析 随着浓度的升高,多酚和微胶囊清除率也升高。在同等浓度条件下,微胶囊清除DPPH自由基的能力优于山楂多酚(图5A),从图中可以看出微胶囊化后对DPPH自由基的清除能力提高了0.50%~65.34%。山楂多酚清除DPPH自由基IC50为12.669 μg/mL,微胶囊IC50为0.939 μg/mL。结合图5A可以看出,微胶囊清除DPPH自由基的能力优于山楂多酚,原因可能与微胶囊粒径有关,粒径越小,越有利于微胶囊中抗氧化物质的释放[32]。以VC作为对照可看出其清除DPPH自由基的能力变化不显著;Silva等[33]采用喷雾干燥法制备巴西树葡萄花色苷微胶囊,检测DPPH抗氧化活性,结果表明微胶囊化后花色苷具有更强的抗氧化能力,所得结果与本文相似。
随着多酚和微胶囊浓度增加,清除羟基自由基的能力增强,山楂多酚清除羟基自由基的能力变化显著,而微胶囊清除能力变化曲线较平缓。在同等浓度条件下,微胶囊清除羟基自由基的能力优于山楂多酚。从图5B中可以看出微胶囊化后对羟基自由基的清除能力提高了4.03%~49.32%,山楂多酚清除羟基自由基IC50为1.131 mg/mL,山楂多酚微胶囊IC50为0.129 mg/mL。以VC作为对照可看出其清除羟基自由基的能力变化不显著。郑虎哲等[34]研究了苹果多酚微胶囊的羟基自由基清除率,发现微胶囊化后抗氧化性更高,和本实验的结果一致,原因可能为微胶囊有更高的水溶解性,在水中能够释放出大量山楂多酚导致抗氧化能力增强[35]。
随着浓度的增加,山楂多酚和微胶囊的清除率都呈现明显的上升趋势,在同等浓度下,微胶囊清除超氧阴离子自由基的能力优于山楂多酚(图5C),从图5C中可以看出微胶囊化后对超氧阴离子的清除能力提高了2.09%~7.45%。在浓度大于0.63 mg/mL时,VC对超氧阴离子的清除率低于山楂多酚和微胶囊。山楂多酚清除超氧阴离子自由基IC50为0.581 mg/mL,微胶囊的IC50为0.546 mg/mL,原因可能为壁材中的乳清分离蛋白具有一定的抗氧化作用[36],加之微胶囊水溶性较好,因此表现出优于山楂多酚的超氧阴离子自由基清除率。以VC作为对照可看出其清除超氧阴离子自由基的能力变化显著。郑虎哲等[34]的苹果多酚微胶囊也表现出更出色的超氧阴离子自由基清除率。
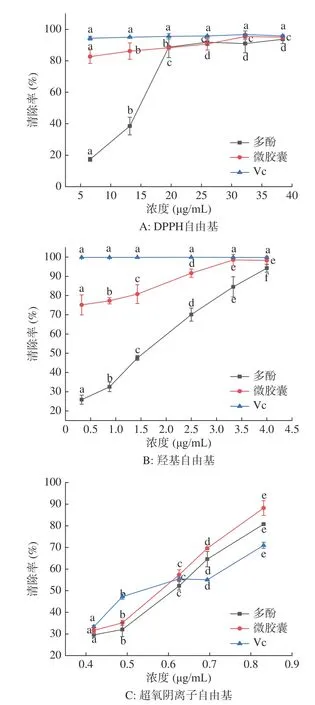
图5 微胶囊对各类自由基清除率的影响Fig.5 Effects of microcapsules on scavenging rate of various free radicals
2.6 微胶囊稳定性测定
避光条件和光照条件下的山楂多酚微胶囊的保留率均高于山楂多酚(图6A),光照条件下贮藏至第10 d,山楂多酚的保留率为64.99%,而山楂多酚微胶囊的保留率为86.74%;与光照山楂多酚微胶囊对比,避光条件下的微胶囊中多酚保留率较高;与光照山楂多酚相比,山楂多酚微胶囊具有更高的保留率,原因为壁材在一定程度上阻碍了光对芯材的分解作用[37]。Aizpurua-Olaizola等[38]分析了葡萄多酚的光稳定性,得出在避光条件下,多酚微胶囊的稳定性更强,和本实验结果类似。因此,避光条件更利于山楂多酚微胶囊的贮存,微胶囊化处理也有利于提高山楂多酚的稳定性。
在不同温度条件下,山楂多酚微胶囊的保留率均高于山楂多酚(图6B),随着温度的上升,二者的保留率均下降,在80 ℃时,多酚保留率仅为70.77%,而山楂多酚微胶囊的保留率为88.77%,与未微胶囊化的山楂多酚相比,微胶囊化后其保留率提高了18.00%。与未微胶囊化山楂多酚相比,微胶囊化技术能够提高山楂多酚的热稳定性,原因可能为山楂多酚微胶囊拥有稳定的结构以及微胶囊化技术提高了山楂多酚微胶囊的失重温度导致[12]。Wang等[39]对比了微胶囊化前后茶多酚的热稳定性,所得结果和本实验类似的结果。因此,微胶囊化处理也有利于提高山楂多酚的热稳定性。
采用真空包装和无包装的形式对山楂多酚和山楂多酚微胶囊进行贮藏稳定性的评价,山楂多酚微胶囊的稳定性都优于山楂多酚,真空包装的贮藏效果优于无包装(图6C),在贮藏28 d后,真空包装的山楂多酚和山楂多酚微胶囊的保留率分别为90.02%和97.17%,无包装的山楂多酚和山楂微胶囊的保留率分别为73.48%和91.15%,与无包装的山楂多酚和山楂多酚微胶囊相比,真空包装后二者的保留率分别提高了16.54%和6.02%,原因为在胶囊化过程中芯材得到壁材很好的保护,且真空包装阻碍了山楂多酚和山楂多酚微胶囊与外界环境的接触,阻止其氧化变质[40]。以上结果表明微胶囊化能提高山楂多酚的贮藏稳定性。廖霞等[24]研究了槲皮素微胶囊的稳定性,在贮藏35 d后,微胶囊依然能保持较高的稳定性,所得结果和本文一致。
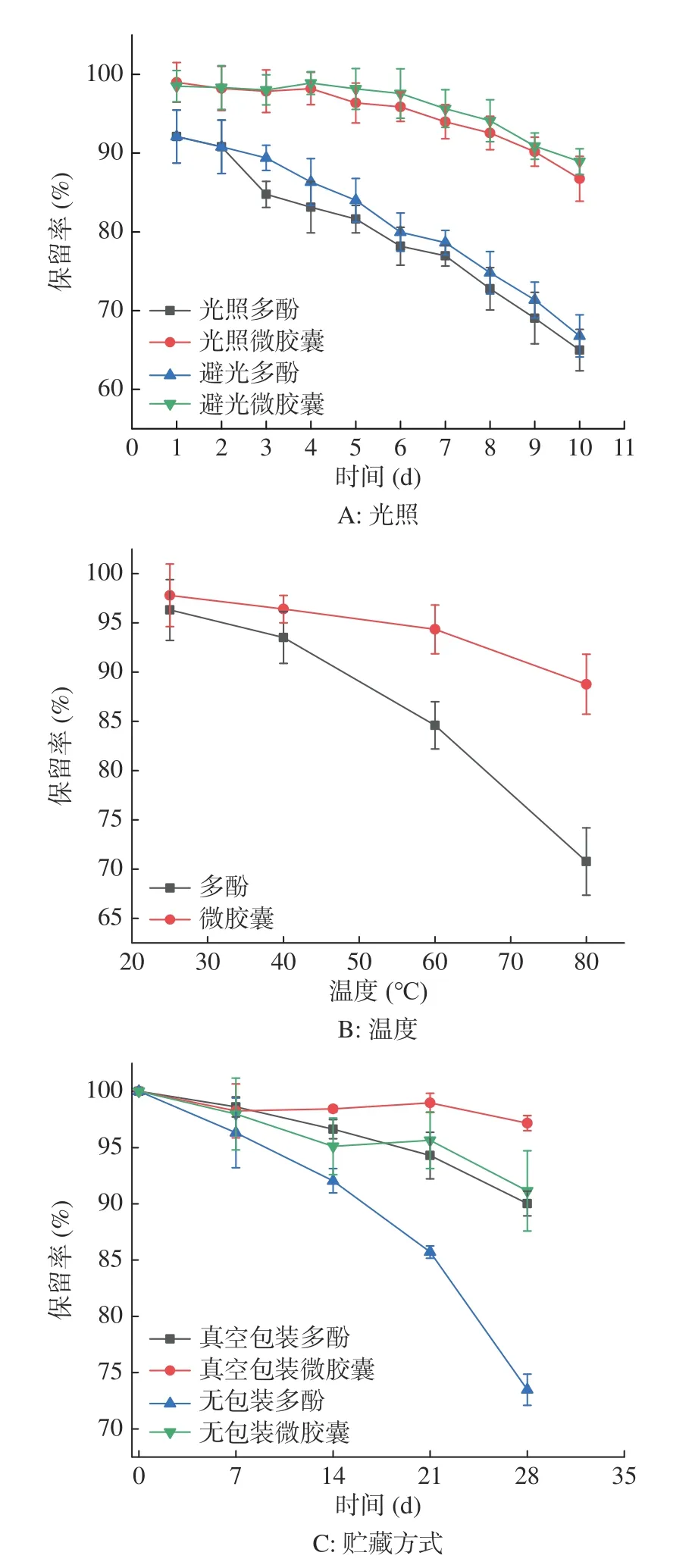
图6 不同条件对微胶囊稳定性的影响Fig.6 Effects of different conditions on the stability of microcapsules
2.7 体外模拟消化对微胶囊释放率的影响
由图7可知,在模拟胃液阶段,山楂多酚和山楂多酚微胶囊的释放率均较低,原因可能为山楂多酚在胃液中能以较稳定的2-苯基苯并阳离子形式存在,山楂多酚微胶囊由于有壁材的保护作用阻止了胃液对二者的分解[41];在肠液消化阶段,多酚和微胶囊的释放速率明显不同,多酚的释放率急剧上升,在释放4 h后释放率达到91.96%,之后达到稳定值;而多酚微胶囊的释放速率较缓慢,持续释放6 h后,总计释放率为72.53%,原因可能为当肠液中的pH较高,山楂多酚分子结构转化为醌式结构,导致稳定性下降,而山楂多酚由于有壁材的保护作用,可以实现缓慢释放的效果[41],说明微胶囊在肠液中较稳定。廖霞等[24]研究也表明相较于槲皮素,槲皮素微胶囊能实现缓慢释放,更利于吸收。陈忠宝[42]的研究也表明蓝靛果多酚微胶囊在肠液中具有缓慢释放的效果。
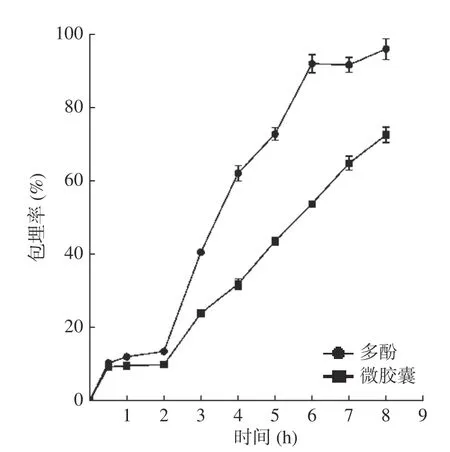
图7 微胶囊在模拟胃肠液中的释放率Fig.7 Release rate of microcapsules in simulated gastroenteric fluid
3 结论
采用喷雾干燥法制备了山楂多酚微胶囊,以包埋率和载药量为评价指标,进行了响应面优化实验,得到最佳工艺参数芯壁比为1:3(v/v),进风温度为165 ℃,乳化时间为11.4 min,得到微胶囊包埋率为94.45%±1.033%,载药量为17.99%±0.197%;优化后微胶囊的平均粒径为6.77 μm,微胶囊微观结构近似球形。微胶囊化后多酚的稳定性和抗氧化性得到显著改善,表明微胶囊化可以改善山楂多酚的稳定性,可为山楂多酚的精深加工提供参考依据。
目前微胶囊化技术广泛用于各种食品配料的递送。相较于生物医药领域,农副业食品对微胶囊颗粒的研究和开发仍然很低。为了使微胶囊化技术更好运用于食物链,使食品从生产到消费都能受益,未来仍有多项工作要做,如在确保经济和规模的同时,还要进一步研究在实际食品生产、贮藏、运输、销售等过程中都能保证活性成分的活性等。

