植物乳杆菌对米酵菌酸的吸附特性研究
刘 鹏,张 雯,欧 杰,3,4, ,李柏林
(1.上海海洋大学食品学院,上海 201306;2.上海市质量监督检验技术研究院/国家食品质量监督检验中心(上海),上海 200233;3.上海水产品加工及贮藏工程技术研究中心,上海 201306;4.农业部水产品贮藏保鲜质量安全风险评估实验室,上海 201306)
米酵菌酸(Bongkrekic acid)是椰毒假单胞菌产生的一种外毒素,广泛存在于发酵椰浆、变质薯粉、变质玉米面与变质木耳等食品中[1]。米酵菌酸不仅具有高毒性(小鼠LD50值约为3.16 mg·kg-1),而且耐热性极强,普通烹饪方式无法杀灭米酵菌酸[2]。食用被米酵菌酸污染的食物容易引起恶心呕吐、腹痛腹胀等症状,甚至会造成肝脑肾等器官的严重损害,并且目前对米酵菌酸尚无特效解毒药[3-4]。近年来,米酵菌酸导致的食物中毒事件在国内时有发生,严重影响着食品安全。因此,消除米酵菌酸在食品中的污染是保证食品安全的重要手段。目前对于米酵菌酸的脱除方式仅限于物理和化学层面,主要包括紫外照射、微波辐射和强氧化剂降解等[5-6]。然而,这些方法虽然具有一定的脱除效果,但其成本高,易残留,且往往会降低食品营养价值[7]。生物吸附是近年来一种绿色高效的新型脱毒策略,通过微生物细胞壁中的肽聚糖与毒素结合从而达到脱毒效果,这种方法稳定性好、效率高且不会影响食品品质。其中,乳酸菌在益生、抗肿瘤与抗突变等方面具有一定优势,常被用作生物吸附剂来消除毒素污染。
植物乳杆菌(Lactobacillus plantarum)是目前研究最广泛的乳酸菌之一,其来源广泛、安全无毒且益生作用明显,常用于食品发酵[8]。研究表明,植物乳杆菌具有快速结合污染物、增强人体膳食排泄、抑制肠道致病菌、缓解炎症与氧化应激等多种特殊功能[9],并且已有研究发现对黄曲霉毒素、伏马毒素、呕吐毒素和玉米赤霉烯酮等具有体外脱毒功效[10-12]。然而,利用生物吸附法对米酵菌酸进行脱毒的研究还未曾报道,此外在不同环境中对米酵菌酸的脱毒条件与吸附特性尚未明确,因此本文选用植物乳杆菌对米酵菌酸进行脱毒效果探究。
目前,吸附特性研究主要利用动力学与热力学方程拟合的方式进行分析,而动力学和热力学拟合常用于材料对污染物吸附和生物体对有害金属吸附等方面,在乳酸菌菌株吸附毒素方面的应用鲜有报道。因此,本研究从理化因素及模拟胃肠道环境下对吸附的影响进行设计,并结合动力学和热力学拟合分析,系统地探究植物乳杆菌对米酵菌酸的吸附效果,旨在为制定有效的毒素脱除策略提供理论方法和依据,以期更好地保证食品安全与公众健康。
1 材料与方法
1.1 材料与仪器
植物乳杆菌(Lactobacillus plantarumX1) 现保藏于本实验室;MRS液体培养基、MRS琼脂培养基 广东环凯生物科技有限公司;米酵菌酸标准品(CAS:11076-19-0,纯度≥99%) 北京曼哈格生物科技有限公司;胰蛋白酶(≥250 U·mg-1)、胃蛋白酶(≥250 U·mg-1)、磷酸二氢钾(分析纯)、甲醇(色谱纯) 上海麦克林生化科技有限公司。
电子天平 上海禾汽玻璃仪器有限公司;PB-260平板式酸度计 海佑科仪器仪表有限公司;ZHJH-C1112C 超净工作台 上海智城分析仪器制造有限公司;LRH-150F生化培养箱 上海一恒科学仪器有限公司;Agilent Technologies 1260 Infinity Ⅱ高效液相色谱 美国安捷伦公司。
1.2 实验方法
1.2.1 菌体制备 取菌株(保藏于-80 ℃冰箱)于MRS平板上划线,37 ℃活化48 h后挑取单菌落至MRS肉汤,37 ℃培养18 h后离心(5000 r·min-1,4 ℃,10 min)弃上清液,用无菌水冲洗两次后再次离心,收集菌体置于35 ℃烘箱烘干待用。
1.2.2 米酵菌酸的HPLC检测 检测方法参考GB 5009.189-2016《食品安全国家标准 食品中米酵菌酸的测定》[13],为保证良好峰形,选择对流动相配比进行更改[14]。检测条件:色谱柱:Agilent 5 TC-C18(5 μm×4.6 mm×250 mm);流动相(A:甲醇,B:水用冰乙酸调pH=2.5,A:B=80:20);流速:1 mL·min-1;进样量:20 μL;柱温:30 ℃;检测波长:267 nm。在0.3~40 mg·L-1浓度范围内,测出各浓度梯度下BA标准品的峰面积并绘制标准曲线,方程为y=22.665x+0.1409,R2=0.9994,浓度与峰面积保持着良好的线性关系。
1.2.3 菌体对米酵菌酸吸附率测定 用无菌PBS将烘干菌体配制成1 g·L-1的菌悬液,取1 mL浓度为20 mg·L-1的米酵菌酸工作液加至4 mL菌悬液中,混匀于37 ℃培养1 h后离心(5000 r·min-1,4 ℃,10 min)收集上清。将上清液过0.45 μm有机滤膜后进液相检测。设同浓度米酵菌酸工作液为对照。菌体对米酵菌酸吸附率与单位吸附量按以下公式计算:

式中,Q为米酵菌酸吸附率,%;C0为初始米酵菌酸浓度,mg·L-1;Ce为平衡时悬液中的米酵菌酸浓度,mg·L-1;Y为米酵菌酸吸附量,mg·g-1;V为米酵菌酸工作液体积,L;m为菌体质量,g。
1.2.4 时间、温度和pH对菌体吸附米酵菌酸的影响
时间:取1 g·L-1的菌悬液4 mL,加入1 mL浓度为20 mg·L-1的米酵菌酸工作液,混匀后37 ℃静置培养。时间分别设置为10、20、30、60、120和180 min,培养完成后离心(5000 r·min-1,4 ℃,10 min)取上清液,过膜检测,以未加入菌体的同浓度米酵菌酸作为对照。
温度:取1 g·L-1的菌悬液4 mL,加入1 mL浓度为20 mg·L-1的米酵菌酸工作液,混匀后静置培养1 h。培养箱温度分别设置为20、25、30、37和42 ℃,培养完成后离心(5000 r·min-1,4 ℃,10 min)取上清液,过膜检测,以未加入菌体的同浓度米酵菌酸作为对照。
pH:取1 g·L-1的菌悬液4 mL,分别调pH为1、3、5、7和9,加入1 mL浓度为20 mg·L-1的米酵菌酸工作液,混匀后37 ℃静置培养1 h,培养完成后离心(5000 r·min-1,4 ℃,10 min)取上清液,过膜检测,以未加入菌体的同浓度米酵菌酸作为对照。
1.2.5 菌体浓度与米酵菌酸浓度对菌体吸附米酵菌酸的影响 菌体浓度:用无菌PBS将称重不同的烘干菌体配制为1、2、3、4、5和6 g·L-1的菌悬液,各浓度分别取4 mL,加入1 mL浓度为20 mg·L-1的米酵菌酸工作液,混匀后37 ℃静置培养1 h,培养完成后离心(5000 r·min-1,4 ℃,10 min)取上清液,过膜检测,以未加入菌体的同浓度米酵菌酸作对照。
米酵菌酸浓度:分别配制浓度为10、20、50、70、100和150 mg·L-1的米酵菌酸工作液,取1 g·L-1的菌悬液4 mL,分别加入1 mL各个浓度的米酵菌酸工作液,混匀后37 ℃静置培养1 h,培养完成后离心(5000 r·min-1,4 ℃,10 min)取上清液,过膜检测,以未加入菌体的同浓度米酵菌酸作对照。
1.2.6 模拟胃肠道环境下对吸附的影响 人工胃液的配制:用无菌去离子水分别稀释适量浓盐酸于三个烧杯中,调节pH分别为2、3、4,之后各加入1%的胃蛋白酶。充分溶解后,过膜后待用[15]。取3支菌悬液离心(5000 r·min-1,4 ℃,10 min)收集菌体,向菌体中分别加入pH为2、3、4的人工胃液,再加入1 mL 米酵菌酸后静置于37 ℃培养箱中分别培养30、60、120 min,离心(5000 r·min-1,4 ℃,10 min)取上清,过膜待测,以不加胃液的毒素-菌体混合液作为对照。
人工肠液的配制:用电子天平准确称取磷酸二氢钾6.8 g于烧杯中,加入50 mL无菌水使其溶解,用浓度为0.1 mol·L-1的NaOH溶液调节pH为6.8,加水稀释并定容到100 mL,之后向其加入1 g胰蛋白酶,充分溶解后过滤,4 ℃冷藏待用[13]。取3支菌悬液离心(5000 r·min-1,4 ℃,10 min)收集菌体,向菌体中分别加入4 mL的人工肠液,加入1 mL 米酵菌酸后在37 ℃水浴中分别培养30、60、120 min,离心(5000 r·min-1,4 ℃,10 min)取上清,过膜待测,以无肠液的毒素-菌体混合液作为对照。
1.2.7 等温吸附拟合 采用常见吸附热力学方程对试验数据进行拟合,方程如下:
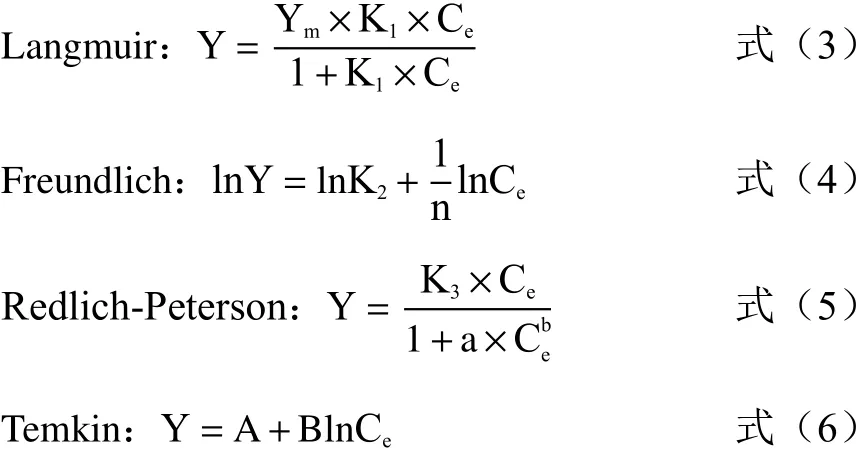
另外,在Langmuir方程上增加一个分离因子R1来表示吸附过程的难易程度:

式中,Y为米酵菌酸单位吸附量,mg·g-1;Ym为最大吸附量,mg·g-1;K1为Langmuir方程参数;Ce为平衡时悬液中的米酵菌酸浓度,mg·L-1;n、K2为Freundlich方程参数;K3、a、b为Redlich-Peterson方程参数,其中0<b<1;A、B为Temkin方程参数。
1.2.8 热力学特性 为了更好地解释菌株对米酵菌酸的吸附特性,将由三个热力学参数来评价,分别为吉布斯自由能(ΔG)、吸附焓(ΔH)与吸附熵(ΔS),方程如下:

式中,ΔH为焓变,J·mol-1;ΔS为熵变,J·mol-1·K-1;Kc为吸附平衡常数;R为理想气体常数,R=8.314472(J·mol)·K-1;T为温度,℃(37 ℃=300.15 K)。对于平衡常数Kc的使用,很多报道中将Langmuir方程常数K1与Freundlich方程常数K2作为平衡常数。
1.2.9 动力学拟合 采用Lagergren准一级、准二级动力学方程与Elovich方程对数据进行拟合分析吸附特性,方程如下:
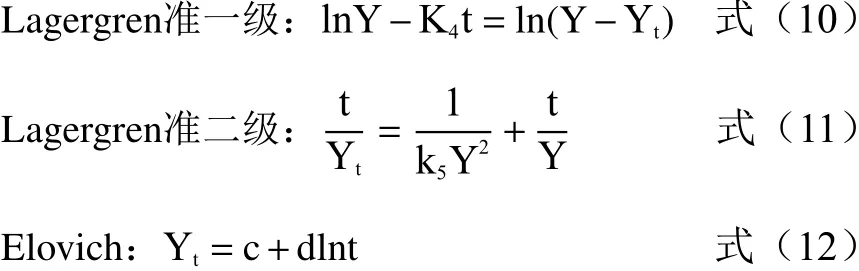
式中,Y同上;Yt是t时刻的吸附量,mg·L-1;K4、K5为准一级与准二级方程常数;c、d为Elovich方程参数。
1.2.10 数据统计分析 本实验采用IBM SPSS Statistics 26软件对数据进行统计分析,做方差及显著性分析,所有实验均重复三次且设置相应对照,用Origin Pro 9.8软件进行绘图。
2 结果与分析
2.1 影响菌体吸附米酵菌酸的因素
2.1.1 时间对菌体吸附米酵菌酸的影响 不同时间内菌株单位吸附量与米酵菌酸的吸附率如图1a所示。由图可知,单位吸附量与吸附率的趋势相近,前期快速上升,中后期达到平衡。单位吸附量在1 h达到平衡,平衡时为10.02 mg·g-1,因此后续实验选择1 h作为培养时间。米酵菌酸吸附率在30 min时最高达到52.3%,1 h之后也达到平衡,平衡时为48.9%。吸附率的小幅度降低可能是由于部分菌株与米酵菌酸结合不牢固,发生了部分解吸,但整体吸附是一个快速高效的过程。随着吸附的进行,与菌株结合的米酵菌酸分子会与游离米酵菌酸分子产生排斥,吸附量便不再增加。这与最近Muaz等[16]报道乳酸菌快速吸附黄曲霉毒素M1的结论一致,其同样指出吸附主要在前期发生。

图1 不同理化因素对吸附米酵菌酸的影响Fig.1 Effects of different physical and chemical factors on adsorption of bongkrekic acid
2.1.2 温度对菌体吸附米酵菌酸的影响 温度对生物吸附过程的影响分为两类:一类是温度影响吸附效果,吸附过程依赖能量;另一类是温度不影响吸附效果,吸附过程不依赖能量,是否依赖能量具体取决于微生物本身的特性[17]。图1b中显示随着温度的上升,菌株单位吸附量与对米酵菌酸的吸附率均在增长,且吸附率在37 ℃达到峰值为52.70%,因此在本研究中37 ℃可认为是吸附的最适温度。另外,乳杆菌吸附米酵菌酸存在着能量变化,能量可能来自于米酵菌酸分子的热运动。温度升高加剧了分子热运动,故米酵菌酸与吸附位点结合率增高;另外有研究[18]报道过热时细胞壁蛋白在菌株外形成蛋白膜对菌株加以保护,而植物乳杆菌X1的最佳生长温度为37 ℃,当超过37 ℃后,植物乳杆菌X1与毒素结合则会减少。同时在Cherkani-hassani等[19]的研究中也提到,鼠李糖乳杆菌L. rhamnosusLb50在最佳生长温度25 ℃时对黄曲霉毒素B1吸附率最高,而在低温15 ℃及37 ℃以上时吸附率反而降低。
2.1.3 pH对菌体吸附米酵菌酸的影响 pH在吸附过程中起着重要作用,因为其与米酵菌酸分子的电离程度和植物乳杆菌表面细胞壁结构有关[20]。由图1c可知,菌株的单位吸附量与米酵菌酸吸附率的整体趋势均为先上升后下降。当pH为3时,菌株吸附效率达到最高,为47.6%,而后随pH升高,吸附率逐渐减低且变化较大,说明酸性环境下比碱性环境更有利于吸附的进行。一方面,这可能是由于在酸性环境下,细胞壁多糖结构中糖苷键断裂,导致游离单糖增多,削弱了细胞壁的致密性[21]。另外,推测细胞壁表面蛋白质以及肽链发生断裂,从而增加了毒素与菌体细胞间的相互作用,所以酸性环境下吸附率较高[22]。另一方面,这可能与米酵菌酸的三羧酸结构有关,酸性条件抑制三羧酸结构水解,导致其不能充分与乳杆菌结合[23]。这与Hatab等[24]的结果相似,他们在研究乳酸菌菌株M74和EF031吸附展青霉素的实验中指出,当pH为3时吸附率最高,而pH高于7时吸附率却很低。
2.2 菌体浓度与米酵菌酸浓度对菌体吸附米酵菌酸的影响
据图2a所示,菌体浓度对吸附效果产生了显著影响。在毒素浓度和温度一定时,菌体浓度从1 g·L-1提高到5 g·L-1时,米酵菌酸吸附率显著上升(P<0.05),而后缓慢增长,在6 g·L-1时吸附率最大,为54.12%。菌株单位吸附量却呈现显著下降的趋势(P<0.05),当菌体浓度从1 g·L-1提高到6 g·L-1时,单位吸附量从9.25 mg·g-1降到3.06 mg·g-1,这是由于毒素浓度一定时,单位菌体浓度越大即吸附位点越多,单位吸附量越低;而吸附位点总量增多,故而毒素被吸附的越多,总吸附率就越高。

图2 菌体浓度与米酵菌酸浓度对吸附的影响Fig.2 Effects of bacterial concentration and bongkrekic acid concentration on adsorption
由图2b可以看出,毒素浓度对吸附的影响较大。当米酵菌酸浓度从10 mg·L-1增加到150 mg·L-1时,菌株的单位吸附量随着米酵菌酸浓度的升高而显著增加(P<0.05),单位吸附量从4.87 mg·g-1增加到37.41 mg·g-1。但吸附率却随着米酵菌酸浓度升高而显著降低(P<0.05),菌体对米酵菌酸的吸附率从48.53%降低到了22.35%。因此在米酵菌酸浓度为10 mg·L-1时,菌株吸附效果最佳,这是由于菌体密度与吸附位点不变时,低浓度的米酵菌酸可大量被菌体吸附,而米酵菌酸的分子总量增加,在体系中游离分子增多,菌体吸附达到峰值与饱和状态,导致米酵菌酸的吸附率下降。
2.3 模拟胃肠道环境下的吸附效果
植物乳杆菌可以定植在人体的胃肠道中,能否发挥其益生性取决于胃肠液中酶的活性以及酸度。由图3所示,时间30 min时菌体在pH为3的胃液中对米酵菌酸的吸附率显著高于肠液组与正常组(P<0.05),其吸附率为34.52%;时间60 min时pH为3的胃液组与正常组无显著性差异(P>0.05),两组吸附率分别为47.72%和49.7%,但均显著高于肠液组吸附率39.65%(P<0.05);时间120与60 min时相似,pH为3的胃液组与正常组无显著性差异(P>0.05),两组吸附率分别为45.4%和47.1%,也均显著高于肠液组吸附率36.38%(P<0.05)。整体来看,胃液组略低于正常组吸附效果,推测其中的胃蛋白酶和酸性环境可能是引起吸附率降低的原因。但对比pH为2时的胃液组和正常组吸附率可知,低pH时依旧有吸附效果, 因此引起吸附率下降的主要原因是胃蛋白酶的存在。胃蛋白酶起作用于细胞壁上的蛋白质物质,破坏细胞壁原有的网格结构,导致吸附能力下降[25]。而肠液组吸附效果远远低于胃液组与正常组,原因是胰蛋白酶对于细胞壁上的磷脂以及蛋白都有显著影响,同样也会破化蛋白质结构与影响表达,作用与胃蛋白酶类似。

图3 模拟胃肠道环境下对吸附米酵菌酸的影响Fig.3 Effects of simulated gastrointestinal environment on adsorption of bongkrekic acid
2.4 吸附等温曲线的绘制
用四种方程对等温吸附数据拟合曲线见图4,相关参数见表1。由表1可知,四种方程对菌株吸附米酵菌酸的拟合度都较高,其中Langmuir方程决定系数R2达到0.987,明显高于其他三种方程。该模型指出固相吸附剂会均匀地分布结合位点且每个分子只结合一个位点,最终形成一层单分子吸附层[26]。因此本实验中菌株对米酵菌酸的吸附主要符合单分子层

表1 等温方程模型拟合参数Table 1 Parameters of isothermal equation model fitting
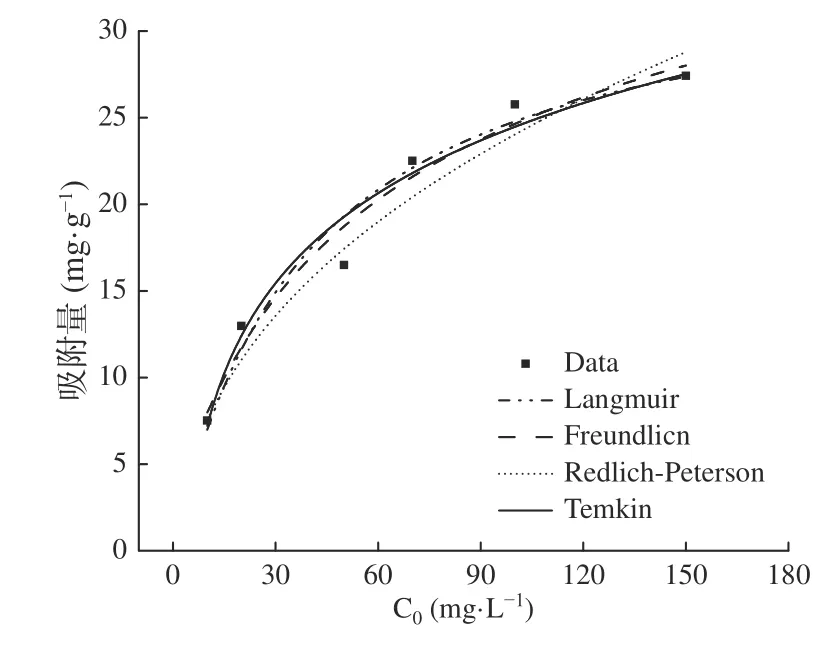
图4 不同等温曲线的拟合Fig.4 Fitting of different isothermal curves
吸附,并且预测出最大单位吸附量Ym为34.59 mg·g-1。在原有方程基础上增加的无量纲常数的大小决定了吸附的难易程度[27]。当R1为0时,吸附仅为正向进行而不可逆;当R1在0~1之间时,吸附较容易进行;当R1为1时,平衡浓度与吸附量之间为线性关系;当R1大于1时,吸附很难进行。由图5可知,R1始终是小于1的,说明吸附菌体吸附米酵菌酸较易进行。另外,米酵菌酸浓度越大R1越小,说明米酵菌酸浓度升高会促进吸附的进行。

图5 分离因子随米酵菌酸浓度变化Fig.5 Variation of separation factor with bongkrekic acid concentration
2.5 附热力学拟合分析
热力学特性研究可以解释吸附中关于内能的变化,根据式(8)与式(9)计算出ΔG以及ΔH与ΔS,数值见表2。根据表3可知,ΔG在5个温度下均为负值,说明吸附有自发性,ΔG随温度的变化表明吸附过程存在物理吸附[28]。ΔH为正值代表该吸附反应为吸热性质,数值在0~40 kJ·mol-1之间说明吸附后米酵菌酸分子运动受限且不易发生解吸[29]。综合热力学分析表明植物乳杆菌对米酵菌酸的吸附效果很好,其作为吸附剂有很大潜力。
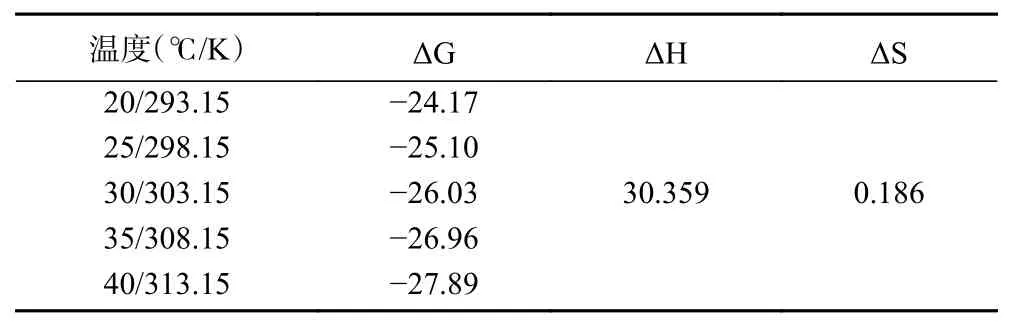
表2 热力学参数Table 2 Parameter of thermodynamic
2.6 动力学拟合分析
用动力学方程对不同时间的吸附量进行拟合结果见图6,方程参数见表3。根据表3可知准二级方程拟合决定系数R2为0.985,远大于另外两个方程,并且预测出最大吸附量Ym为11.425 mg·g-1,三次实验实际结果平均值为10.22 mg·g-1,实际值与预测值相差不大,因此准二级动力学方程拟合度最高。该方程的模型假定条件为吸附位点与吸附能力成正比,即植物乳杆菌的吸附能力与自身吸附位点数量成正比[30],这表明影响吸附位点的因素便是主导吸附效果强弱的关键因素。此外,米酵菌酸与植物乳杆菌自身位点结合本质是吸附质与吸附剂之间产生了电子交换,存在电子交换即证明吸附过程中存在化学吸附[31]。

表3 吸附动力学方程模型拟合参数Table 3 Parameters of adsorption kinetic equation model fitting

图6 不同动力学方程的拟合Fig.6 Fitting of different kinetic equations
3 结论
本研究以植物乳杆菌X1作为吸附剂对米酵菌酸进行吸附,通过实验发现菌株在时间1 h达到吸附平衡,在pH为3、菌体密度为6 g·L-1、温度为37 ℃及米酵菌酸浓度为10 mg·L-1时吸附效果最佳。在模拟胃肠液环境中,由于胃蛋白酶与胰蛋白酶的存在导致吸附效果减弱。绘制等温线结果表明该吸附最符合Langmuir方程,决定系数R2达到0.987,符合单分子层吸附特点。利用动力学方程拟合分析可知准二级动力学模型拟合度最高,决定系数R2达到0.985。综合热力学与动力学分析可得,吸附过程为自发、放热的过程,同时存在物理吸附与化学吸附,温度越高越利于吸附,且吸附后不易解吸。因此植物乳杆菌X1作为米酵菌酸吸附剂有应用潜力,未来可探究吸附机制及建立动物模型,进行体内乳酸菌脱毒研究,并以乳酸菌为基础研发制剂,以期减少米酵菌酸对人体和动物的伤害。

