绿豆对尾孢菌叶斑病的生理生化响应及病害早期检测
李灵慧,吴然然,陈景斌,崔晓艳,袁星星,朱月林,陈 新*
(1江苏省农业科学院经济作物研究所,南京 210014;2南京农业大学园艺学院,南京 210095)
绿豆[Vigna radiate(L.)Wilczek]属于豆科(Leguminosae)蝶形花亚科(Papilionaceae)豇豆属(Vigna),是亚洲乃至全球农业系统中重要的杂粮作物[1-2]。近年来,随着农业供给侧结构性改革的推进,绿豆种植面积逐渐增加,但其单产水平一直较低[3],其中病害是导致绿豆减产的主要因素之一[4]。叶斑病是绿豆生产中最常见和危害最为严重的叶部真菌病害[5],由尾孢菌的多个种引起[6],其中变灰尾孢菌(Cercospora canescensEll.et Martin)是最主要的病原菌[7-8],发病时可导致绿豆减产50%以上。
病原菌侵染植物后,植物体内往往发生一系列的生理变化[9-10]。通过研究病害发生后植物生理指标的变化,有利于全面了解植物抵御病害的作用机理[11]。叶绿素是最主要的植物光合色素,与植物的生长发育及病害胁迫等密切相关[12-13],SPAD值与叶绿素含量成正相关。丙二醛(MDA)可以与细胞内多种物质反应,引起细胞中核酸、蛋白质、膜脂分子的破坏,是膜脂过氧化程度的重要指标[14]。抗氧化防御酶被认为是胁迫下植物重要的防御体系,可以清除活性氧,保证植株正常生长[15];超氧化物歧化酶(SOD)的作用是清除和减少体内的破坏性氧自由基[16],过氧化物酶(POD)可以反映出植株的生长及代谢状况[17]。叶绿素荧光成像系统由于具有测定快速、无损的特点,在植物的生物胁迫研究中存在巨大潜力,叶绿素荧光参数可以灵敏探测植物光合生理状况[18],而叶绿素荧光参数图像则可以直观显示病害感染情况[19]。
目前,绿豆叶斑病的生理指标研究相对较少。本研究以绿豆叶斑病的抗病品种‘V4718’和感病品种‘V1197’为试验材料,分析叶片接种变灰尾孢菌后其抗氧化防御酶活性、丙二醛含量、叶绿素含量、叶绿素荧光参数的响应差异,同时针对感染早期绿豆叶片和健康绿豆叶片的叶绿素荧光参数通过算法模型进行分类判别,以期为探索绿豆叶斑病的生理机制和病害检测提供理论依据。
1 材料与方法
1.1 供试材料与菌株
供试材料为绿豆叶斑病抗病品种‘V4718’(来源:印度)和感病品种‘V1197’(来源:巴基斯坦),由江苏省农业科学院经济作物研究所提供。
供试菌株为变灰尾孢菌,由江苏省农业科学院经济作物研究所分离保存。
1.2 叶斑病接种方法及取样
试验于2020年8—12月在江苏省农业科学院经济作物研究所实验室温室内进行,绿豆于小型圆形塑料花盆中种植,完全随机排布。待绿豆植株第一组复叶展开后,选择长势一致的健康植株的叶片进行菌丝块刺伤接种,具体操作为在绿豆叶片的中央且偏离叶脉的位置用无菌牙签造成微伤口,于V8培养基上28℃培养7 d左右的变灰尾孢菌边缘部分取菌丝块,将菌丝一面贴于伤口处,同时以不接种变灰尾孢菌的绿豆为对照。将接种及对照绿豆植株放入保湿棚25 °C保湿36 h,之后在25 °C、相对湿度60%左右条件下正常生长,分别在接种后1 d、2 d、4 d、6 d取样,调查相关指标。
1.3 测定项目及方法
使用SPAD-502 plus型叶绿素仪测定绿豆叶片叶绿素相对含量(SPAD值);使用硫代巴比妥酸比色法测定绿豆叶片的丙二醛含量,具体参照赵世杰等[20]方法;绿豆叶片的超氧化物歧化酶(SOD)和过氧化物酶(POD)测定选择北京索莱宝科技有限公司生产的酶活测定试剂盒(BC0170-50管∕24样、BC0090-50管∕48样);绿豆叶片叶绿素荧光参数的测定选用FluorCam FC800叶绿素荧光成像系统,测定前叶片需暗处理30 min,每个处理3次重复,取平均值。
用MATLAB 2019a软件构建绿豆叶斑病机器学习算法模型,分别采用决策树(decision tree,DT)、K近邻法(k nearest neighbor,KNN)、支持向量机(support vector machine,SVM)3种算法模型,以叶片的全部叶绿素荧光参数经主成分降维后的数据为输入,验证方法选择5-折交叉验证。本试验主要检测在绿豆叶片未形成明显可见病斑时相关数据,即接种后1 d、2 d、3 d的绿豆叶片各150片及正常未接种叶片100片的叶绿素荧光数据。兴趣区域(ROI)选择与数据导出利用FluorCam 7软件完成。
1.4 数据处理
采用Excel 2019及SPSS 22.0软件对试验数据进行处理,显著性分析采用Duncan’s法(P<0.05)。采用Photoshop 2019、Powerpiont 2019和GraphPad Prism 5软件作图,算法模型判别处理采用MATLAB 2019a软件。
2 结果与分析
2.1 叶斑病对绿豆叶片叶绿素和丙二醛含量的影响
由图1可知,两个绿豆品种叶片的叶绿素含量均随着感染时间的增加逐渐下降,‘V1197’与‘V4718’的叶绿素含量在第4天和第6天分别比未接种处理下降19.95%、41.40%和11.90%、17.74%,且在接种后第4天和第6天感病品种的SPAD值显著低于抗病品种,表明感病品种的叶片叶绿素分子损失和破坏较严重。
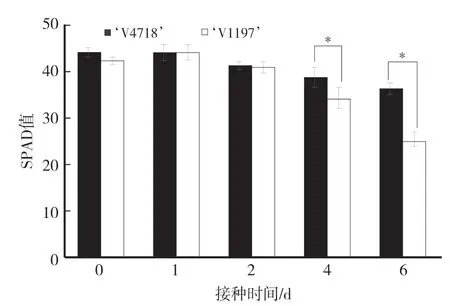
图1 绿豆抗病品种和感病品种叶片的叶绿素含量变化Fig.1 Changes of chlorophyll relative content in leaves of resistant and the susceptible mungbean cultivars
如图2所示,随着接种时间的延长,‘V1197’叶片的MDA含量在接种后第4天和第6天明显升高,分别高出未接种处理164.14%、241.63%;而‘V4718’叶片的MDA含量在接种后第4天和第6天虽然有所增加,但仅分别高出未接种处理30.18%、51.63%,感病品种叶片的MDA含量升高幅度大于抗病品种。在接种后第4天和第6天,感病品种‘V1197’叶片的MDA含量显著高于抗病品种‘V4718’,表明感病品种的叶片细胞结构、细胞膜损伤比抗病品种严重。
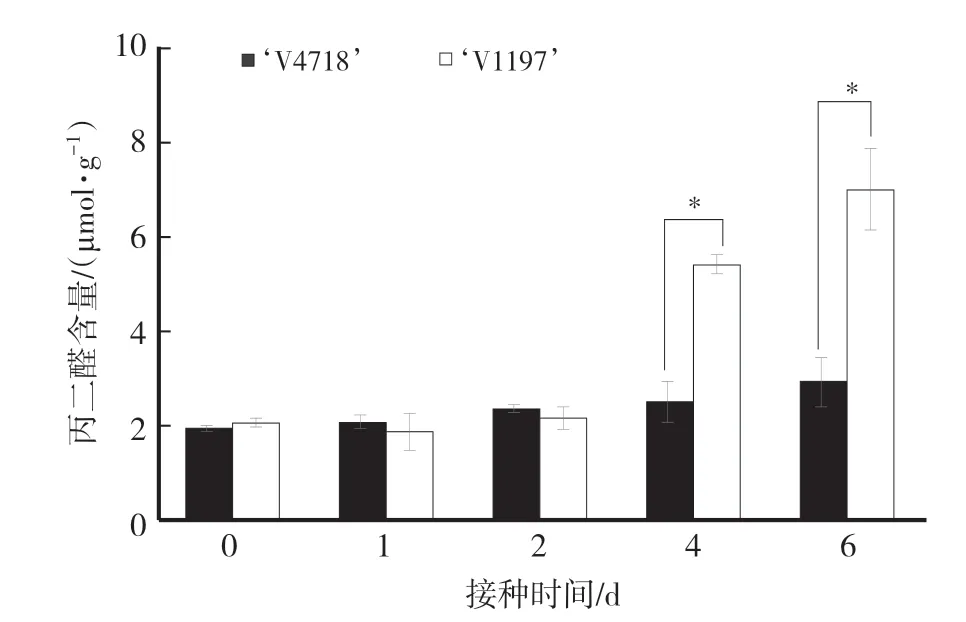
图2 绿豆抗病品种和感病品种叶片的丙二醛含量变化Fig.2 Changes of malondialdehyde content in leaves of resistant and the susceptible mungbean cultivars
2.2 叶斑病对抗氧化酶活性的影响
如图3所示,接种之后,抗、感绿豆品种叶片的POD活性均明显上升,随后出现降低再升高的趋势。抗病品种‘V4718’叶片的POD活性在接种后第1天快速升高,且显著高于感病品种‘V1197’,而感病品种‘V1197’叶片的POD活性在接种后第2天才出现明显增加。POD的及时响应可能在抵抗变灰尾孢菌侵染过程中起关键作用。
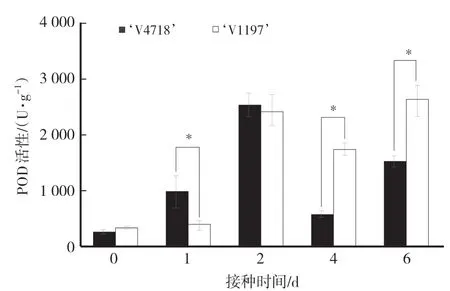
图3 绿豆抗病品种和感病品种叶片的过氧化物酶活性变化Fig.3 Changes of peroxidase dismutase activity in leaves of resistant and the susceptible mungbean cultivars
如图4所示,感病品种‘V1197’叶片的超氧化物歧化酶(SOD)活性在接种后第1天出现明显上升,随后保持稳定,在第6天出现下降,而抗病品种‘V4718’叶片的SOD活性在第1天达到最高值,高出未接种48.30%,随后即出现下降。接种后第2天和第4天‘V1197’叶片的SOD活性显著高于‘V4718’,推测‘V1197’体内可能产生了更多的破坏性的活性氧自由基,并且在持续增加,导致SOD活性一直偏高。
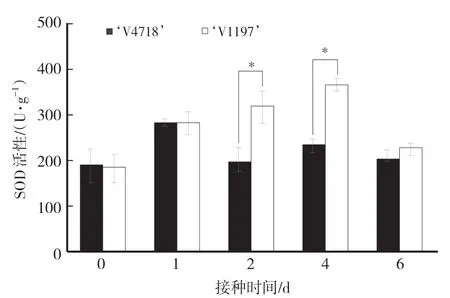
图4 绿豆抗病品种和感病品种叶片的超氧化物歧化酶活性变化Fig.4 Changes of superoxide dismutase activity in leaves of the resistant and the susceptible mungbean cultivars
2.3 叶斑病对叶绿素荧光参数的影响
从图5A和B可见,随着接种时间的增加,两个绿豆品种叶片的PSⅡ潜在光化学活性(potential activity of PSⅡ,Fv∕F0)和PSⅡ最大光化学活性Fv∕Fm变化趋势相似。抗病品种‘V4718’仅在第2天出现明显下降,随后与未接种处理相比无明显差异;而感病品种‘V1197’在接种后第4天和第6天出现明显降低,Fv∕F0与未接种处理相比降低29.82%、46.43%,Fv∕Fm低于未接种处理13.75%、19.17%,且在接种后第4天和第6天抗病品种的Fv∕F0和Fv∕Fm均显著高于感病品种,表明抗病品种的耗散过剩光能与光保护的能力均强于感病品种。从荧光衰减率(fluorescence decline ratio,Rfd)指数来看(图5C),两个品种均随着接种时间的增加有下降趋势,但接种后第2天、第4天、第6天抗病品种叶片的Rfd均显著高于感病品种,表明感病品种的叶片活力下降更严重。从图5D可见,随着接种时间的增加,感病品种‘V1197’的光化学荧光猝灭(estimates the fraction of open photosystemⅡcenters,qL)在第4天出现显著下降,抗病品种‘V4718’叶片的qL在接种后第4天和第6天均显著高于感病品种。
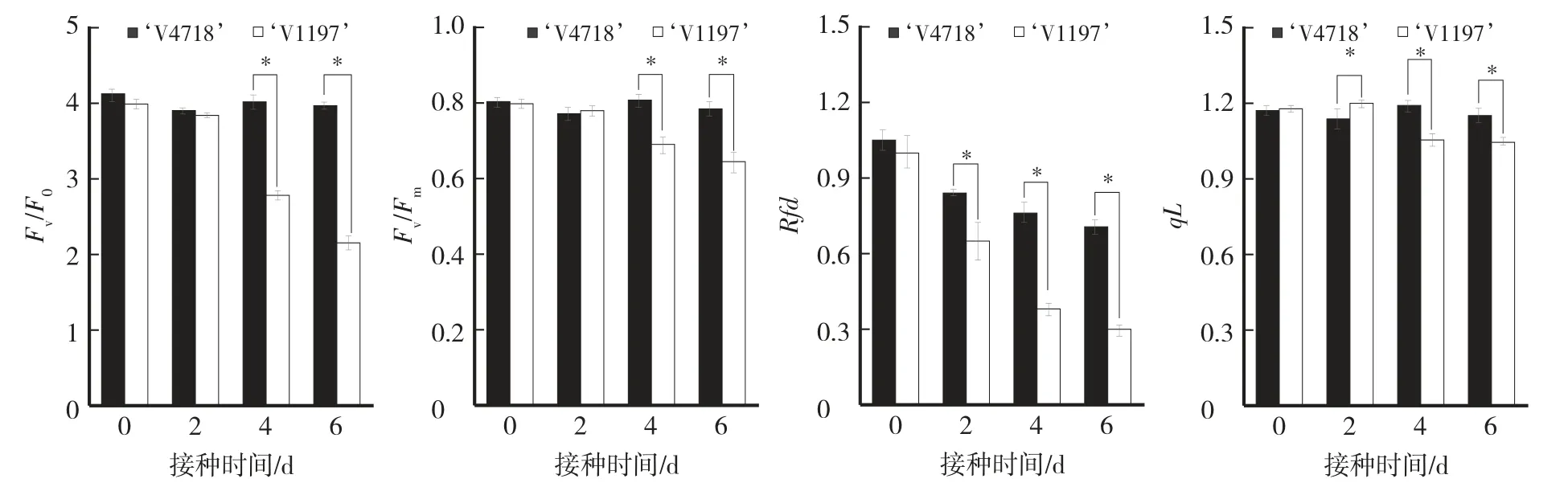
图5 绿豆抗病品种和感病品种叶片叶绿素荧光参数的变化Fig.5 Changes of chlorophyll fluorescence parameters in leaves of resistant and the susceptible mungbean cultivars
2.4 叶绿素荧光成像技术对叶斑病早期检测的分析
如表1所示,在接种后1 d时,3种算法模型预测准确率在78.4%以上;接种后2 d时,3种算法模型的预测准确率在89.6%以上;接种后3 d时,3种算法模型的预测准确率均达到93.6%以上。同时可以看到,AUC值最低为0.86,大部分为0.9以上,表明叶绿素荧光成像技术在绿豆叶斑病早期检测效果良好。
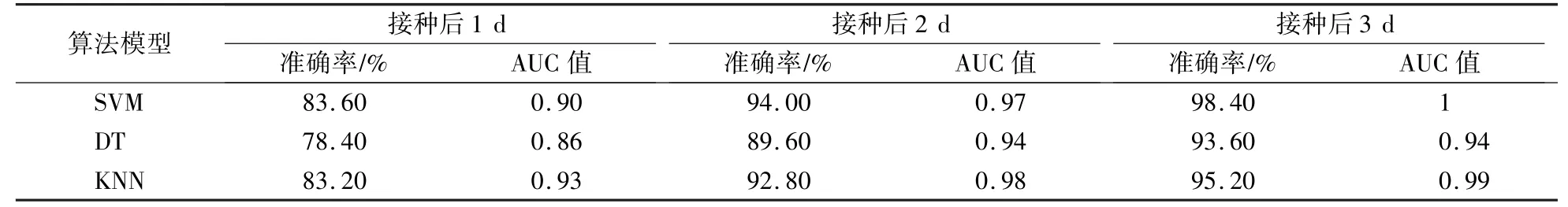
表1 绿豆叶斑病早期检测结果Table 1 Early detection results of mungbean CLS
叶绿素荧光成像技术不仅可以获得参数指标,也可以获得每个参数对应的叶片荧光成像图。相比较单一的数值,图像可以更加直观地显示植物的发病情况。如图6所示,在接种1 d、2 d时,RGB图像未见明显病斑时,荧光成像图即可以检测到荧光差别;而在接种3 d时,荧光成像图不仅可以显示出病斑所在位置,且可以观察到叶片病斑周围的荧光变化,对于病害的发展具有指示作用。

图6 绿豆叶斑病病叶的叶绿素荧光成像图Fig.6 Chlorophyll fluorescence images of leaves of mungbean CLS
3 讨论与结论
变灰尾孢菌为丝孢菌纲(Hyphomycetes)暗色孢科(Dematiaceae)尾孢属(Cercospora)真菌[21],在绿豆上引起的叶斑病属于毁灭性病害[8]。植物遭受生物胁迫时体内会发生一系列的生理生化变化来抵抗病原生物的入侵,通过研究不同抗性品种体内的物质变化,可为探索病害的生理机制和筛选抗性品种提供理论基础。刘丽等[22]通过研究不同品种葡萄接种霜霉菌之后生理指标的变化,发现抗性与防御酶活性成正相关,与叶绿素荧光参数成负相关;仁得元等[23]通过研究炭疽病对不同核桃的生理影响,发现胁迫后不同品种的膜脂过氧化程度和防御酶活性等存在差异,可以作为核桃对炭疽病抗性的参考指标;宋培玲等[24]通过研究不同抗性品种油菜接种黑胫病菌后防御酶活性变化,发现抗性与防御酶活性及响应早晚有关。本研究发现,接种变灰尾孢菌后,绿豆叶斑病抗感品种的丙二醛含量均有所升高,叶绿素含量均有所下降,这与黄志磊等[25]研究结果类似;感病品种与抗病品种相比,丙二醛含量上升早且增长较多,叶绿素含量下降较明显,表明感病品种叶片的膜脂过氧化程度较深,叶绿素分子被破坏,体内正常的生理代谢活动严重受损,这与刘淑娜等[26]研究结果基本一致;防御酶活性变化与张海涛[27]研究略有不同,抗病品种的POD活性响应早于感病品种,酶活性的快速响应在病害侵染早期有重要意义;而对比SOD,抗病品种与感病品种较高的SOD活性相比,呈现曲折变化,但两者均在第6天下降明显;光合作用中的光系统Ⅱ对环境胁迫非常敏感,叶绿素荧光参数可以灵敏反应出光系统Ⅱ的损伤情况,本试验中,与对照相比,接种后感病品种的PSⅡ潜在光化学活性和PSⅡ最大光化学活性出现显著降低,抗病品种与未接种处理之间差异不大;稳态荧光衰减率灵敏度很高,而光化学荧光猝灭灵敏度较低,两个品种随均出现下降趋势,但抗病品种与对照相比的下降幅度明显低于感病品种,这与前人研究结论一致[22,28-29],表明叶斑病对易感品种的光合结构及光合效率影响较大。绿豆叶斑病抗性机理复杂,相关研究报道也较少。目前,虽然筛选出部分抗性资源,但抗性QTL定位研究只有一篇,近期本研究团队成功定位到绿豆叶斑病的抗性基因VrTAF5[30],但抗性机理有待进一步研究。
叶绿素荧光技术是表型研究的新兴技术,可以快速、无损地检测逆境胁迫后植物光合作用的受损情况[31],同时结合机器算法模型对植物逆境胁迫检测有巨大潜力。姚洁妮[32]用多光谱荧光成像技术与叶绿素荧光成像技术检测耐旱能力不同的两种拟南芥在干旱胁迫下的参数水平,结合支持向量机(SVM)和K近邻法(KNN)两种机器算法模型对其进行分类,实现了对拟南芥在干旱胁迫早期的分类和胁迫程度的数据化。隋媛媛等[33]通过获取健康、感病3 d和6 d的黄瓜霜霉病叶片的荧光光谱,结合最小二乘支持向量机(partial least squares support vector machine,PLS-SVM)对黄瓜霜霉病病害的分类进行预测,准确率达到了97.73%。本研究针对‘V1197’接种变灰尾孢菌1 d、2 d、3 d后叶片的叶绿素荧光参数,利用主成分分析(PCA)降维,发现3种机器学习算法模型中,SVM最佳,KNN次之,DT最差,接种3 d后的判别准确率均达到93.6%以上。基于绿豆叶斑病早期的叶绿素荧光成像和参数变化特点,叶绿素荧光成像技术可以作为一种绿豆叶斑病早期检测和诊断的辅助手段,若将该技术结合简单易行、特异性高、可靠性强的环介导等温扩增技术(LAMP)[34]在病害早期检测、精准防控等方面的应用潜力巨大。
综上所述,尾孢菌叶斑病对绿豆叶片的生长发育、光合作用均有不利影响,但尾孢菌叶斑病对抗病品种叶片的膜结构和光合作用损害程度较轻;抗病品种的抗氧化防御酶活性对尾孢菌叶斑病的响应更快。此外,叶绿素荧光成像技术结合机器学习算法可以作为绿豆叶斑病发病早期的辅助检测手段。

