河北邢台及周边地区PRRSV流行情况调查及ORF5基因变异分析
高明艳,葛生虎,文生萍
(1. 青海农牧科技职业学院,青海 西宁 812100 ; 2. 河北铭诸生物科技有限公司,河北 邢台 054000)
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)感染可导致猪群出现猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS),又称猪蓝耳病,该病的主要临床症状包括母猪繁殖障碍(死胎、流产和弱仔等)、不同发育阶段猪群呼吸困难和高热等,给我国养猪业造成了巨大的经济损失[1-2]。PRRSV基因组大小约为15 kb,可编码多个结构蛋白和非结构蛋白,根据其基因组序列差异可将PRRSV分为2个基因型,分别为欧洲型(基因1型)和美洲型(基因2型)[3]。
2013年开始,国内部分地区开始流行类NADC30毒株,该毒株的Nsp2氨基酸序列中存在大片段的氨基酸缺失,且毒力与之前流行的欧洲型或美洲型存在较大差异[4]。当前类NADC30毒株在我国不同省份广泛流行,甚至在部分地区的流行比例呈逐年上升趋势[5]。本试验于2021年3—10月从河北邢台及周边地区采集疑似感染PRRSV病料组织样品进行病原检测,旨在了解该地区PRRSV流行情况及基因型所占比例情况,以期为该地区PRRS的防控提供依据。
1 材料与方法
1.1 主要试剂 病毒RNA提取试剂盒,购自南京诺唯赞生物科技有限公司;PRRSV美经典株/高致病性/类DADC30毒株核酸检测试剂盒[实时荧光定量PCR(qPCR)-TaqMan荧光探针法],购自湖南冠牧生物科技有限公司;cDNA反转录试剂盒、DL2 000 DNA Marker、2×PCR预混液和琼脂粉末等,均购自宝生物工程(大连)有限公司。
1.2 主要仪器 FQA-48荧光定量PCR仪,购自杭州博日科技股份有限公司;PCR扩增仪,购自力康生物医疗科技控股有限公司;超净工作台,购自山东博科再生医学有限公司;琼脂糖凝胶电泳仪等,均购自苏州阿尔法生物试验器材有限公司。
1.3 样品来源 2021年3—10月从河北邢台及周边地区收集疑似感染PRRSV病猪组织样品共217份。其中部分病猪临床症状包括繁殖母猪流产或死胎,仔猪或保育猪高热、呼吸困难等;剩余组织样品来源病猪未表现以上症状。在确定不是非洲猪瘟感染前提下对病猪进行解剖,无菌采集淋巴结、扁桃体、肺脏等组织样品,标记样品来源和日期等信息,低温送至河北铭诸生物科技有限公司,保存于-20 ℃,待检。
1.4 临床病料处理及PRRSV核酸检测 采用灭菌眼科剪和手术刀剪取约0.5 g组织样品,加入少量灭菌PBS溶液后研磨匀浆,反复冻融后高速离心(12 000 r/min,5 min),取200 μL上清用于RNA基因组提取,基因组提取步骤严格按照试剂盒说明书进行。采用PRRSV美洲经典株/高致病性/类DADC30毒株核酸检测试剂盒对样品进行检测,若样品Ct值<35判定为对应毒株核酸阳性,样品对应Ct值>35判定为阴性。
1.5 类NADC30毒株ORF5基因序列扩增与测序 根据参考文献[6]合成扩增PRRSV毒株ORF5基因序列的特异性引物:PRRSV-ORF5-F:5′-GTTTTAGCCTGTCTTTTTGCC-3′,PRRSV-ORF5-R:5′-TA-TATCATCACTGGCGTGTAGG-3′,引物由英潍捷基(上海)贸易有限公司合成。以类NADC30 PRRSV毒株阳性样品核酸为模板,应用逆转录PCR(RT-PCR)法对毒株ORF5基因序列进行扩增,扩增体系(50.0 μL):2×PCR预混液25.0 μL,上、下游引物(10 μmol/L)各1.0 μL,模板3.0 μL,无RNA酶水20.0 μL;反应条件:95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,共35个循环,最终72 ℃ 5 min。反应结束后取5.0 μL扩增产物于1%琼脂糖凝胶进行电泳检测,并在凝胶成像仪中观察结果。将类NADC30 PRRSV毒株阳性产物送至生工生物工程(上海)股份有限公司进行双向测序。
1.6 类NADC30毒株ORF5基因序列分析 从NCBI网站上下载国内外具有代表性的PRRSV毒株ORF5基因序列,应用DNASTAR软件(MegAlign)对获得的ORF5基因核苷酸序列进行同源性分析;使用MEGA 7.0软件中Neighbor-Joining(NJ)法构建系统遗传进化树,其Bootstrap值设置为1 000。
2 结果
2.1 河北邢台及周边地区送检样品PRRSV核酸检测 采用qPCR法对河北邢台及周边地区采集的疑似PRRSV感染组织样品进行检测,结果如表1所示,77个送检猪场中有43个猪场存在PRRSV阳性病料,场阳性率为55.84%;217份组织样品中有105份样品检测为PRRSV核酸阳性,平均检出率为48.39%。进一步分析发现,PRRSV广泛流行于不同送检地区,各地区PRRSV场阳性率和样品阳性率分别介于40.91%~76.47%和29.85%~75.00%,其中石家庄市流行情况相对最严重。
2.2 河北邢台及周边地区不同基因型PRRSV毒株流行特点 进一步分析PRRSV阳性毒株基因型发现,河北邢台及周边地区同时存在3种不同基因型的PRRSV流行,但其检出率存在较大差异。结果如表2所示,类NADC30毒株检出率最高,为29.49%(64/217),高致病性PRRSV毒株和经典型PRRSV毒株检出率分别为15.21%(33/217)和4.61%(10/217),3种毒株阳性样品占PRRSV阳性样品的比例分别为60.95%、31.43%和9.52%。此外,2份样品存在“类NADC30毒株+高致病性毒株”混合感染,但未发现其他毒株混合感染现象。
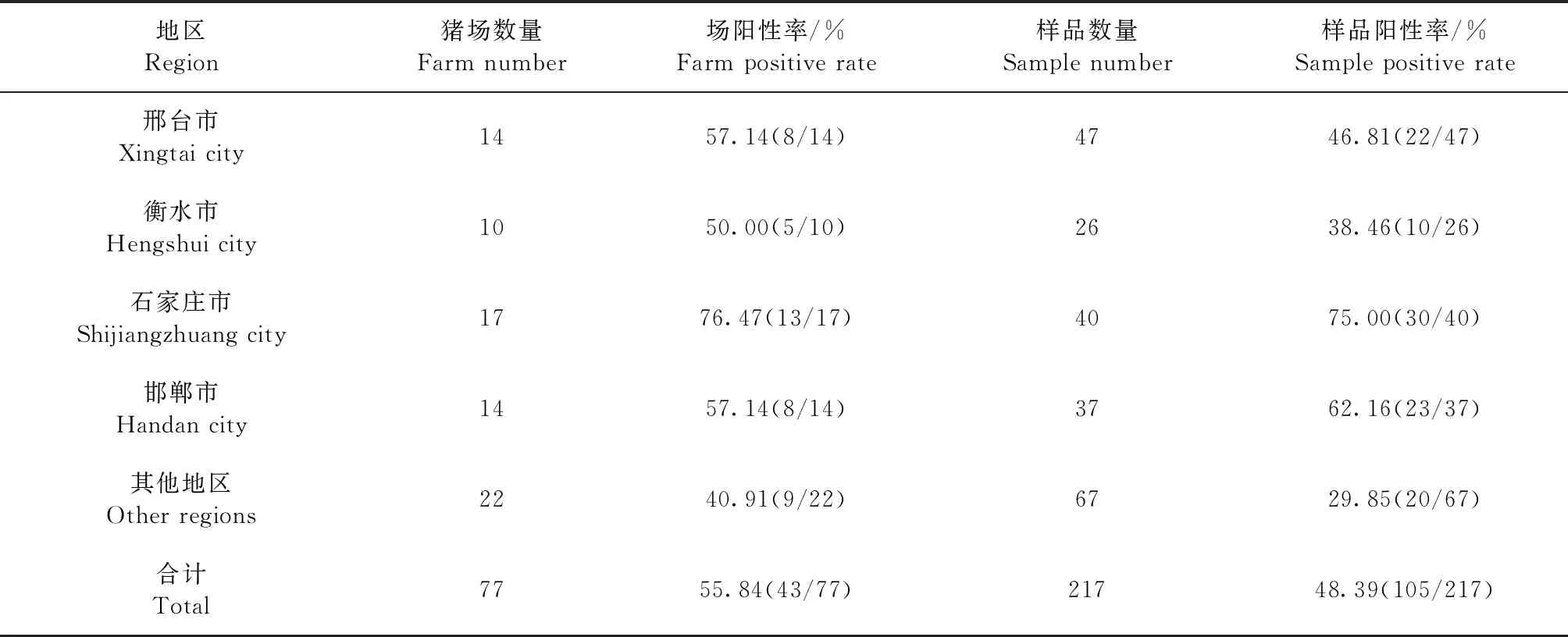
表1 邢台及周边地区送检样品PRRSV核酸检测Table 1 PRRSV nucleic acid detection of samples from Xingtai and its surrounding areas

表2 邢台及周边地区不同基因型PRRSV毒株流行情况Table 2 Prevalence of PRRSV strains with different genotypes in Xingtai and its surrounding areas
2.3 类NADC30毒株ORF5基因序列扩增与测序 凝胶电泳结果显示,8个PRRSV毒株ORF5基因序列均成功扩增,其RT-PCR产物大小约600 bp,与预期大小基本相符,且无非特异性条带(图1)。测序结果显示,8个毒株ORF5基因序列大小均为606 bp,可编码202个氨基酸。根据样品采集时间和地点将8个毒株分别命名为HBXT1-2021、HBXT2-2021、HBHS1-2021、HBHS2-2021、HBSJZ1-2021、HBSJZ2-2021、HBHD1-2021和HBHD2-2021。

图1 PRRSV毒株ORF 5基因序列RT-PCR扩增Fig.1 RT-PCR amplification of PRRSV ORF 5 geneM:DL2 000 DNA Marker; N:阴性对照; P:阳性对照; 1~8:8份样品M:DL2 000 DNA Marker; N:Negative control; P:Positive control; 1-8:8 samples
2.4 类NADC30毒株ORF5基因序列分析 核苷酸序列分析结果显示,8个PRRSV毒株ORF5基因核苷酸序列同源性为98.5%~99.8%;与类NADC30 PRRSV代表性毒株(如NADC30、HeN1和HeN2014)OFRF5基因序列同源性最高,为93.9%~99.5%,与疫苗株VR2332ORF5基因序列同源性为85.1%~85.4%;与高致病性PRRSV代表性毒株(如JXA1和HuN4)ORF5基因序列同源性为83.9%~84.4%;与谱系3.5代表性毒株(如QYYZ和FJFS)ORF5基因序列同源性则为82.8%~83.1%(图2)。
当前全球流行的PRRSV毒株可分为2个基因型,分别为欧洲型(PRRSV-1)和美洲型(PRRSV-2),而美洲型毒株可分为多个亚型[7-8]。应用MEGA 7.0软件构建遗传进化树显示,本试验获得的8个毒株与GenBank收录的类NADC30代表性毒株聚为同一分支,且与我国流行的河南株(HeN1)相距最近(图3)。结果表明,本试验获得的毒株均属于类NADC30毒株,且其与国内流行毒株(HeN1)亲缘关系最近。

图2 PRRSV毒株ORF 5基因核苷酸序列同源性分析Fig.2 Homology analysis of PRRSV ORF 5 nucleotide sequences▲:本试验获得PRRSV毒株;下图同 ▲:PRRSV strains obtained in this study. The same as the following figures
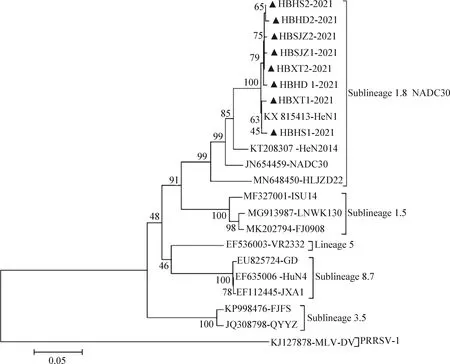
图3 PRRSV毒株ORF 5基因序列遗传进化树Fig.3 Phylogenetic tree construction based on the PRRSV ORF 5 sequences
3 讨论
当前,PRRS已成为危害我国养猪业健康发展的重要疫病。PRRSV属于RNA病毒,而RNA病毒基因组在复制过程中易出现碱基突变、缺失和缺失,这导致当前我国PRRSV流行毒株基因型复杂,对其进行有效防控十分困难[8]。2006年,我国江西省部分地区猪场暴发高致病性PRRSV感染引发的PRRS,猪群感染该病后出现高热和高病死率,该病的广泛流行给我国部分猪场造成毁灭性打击[9]。其后,2013年我国部分地区开始流行类NADC30毒株[10]。3种不同基因型PRRSV毒株(经典型毒株、高致病性毒株、类NADC30毒株)对宿主的致病性存在差异,使得我国PRRS防控相对困难,这也提示监测PRRSV流行情况及不同基因型所占比例情况十分必要。
综上,本试验通过对河北邢台及周边地区PRRSV流行情况进行调查和分析,发现样品中PRRSV检出率较高(48.39%,105/217),说明该病原仍然广泛流行于河北部分地区猪场。可能是由于目前PRRS已退出国家强制性免疫猪病名单,使得部分猪场疏于对该病的防控[11]。进一步分析发现,被调查地区同时存在3种基因型PRRSV毒株的流行,但不同基因型毒株所占比例差异较大,其中类NADC30毒株、HP-PRRSV毒株和经典型PRRSV毒株所占比例分别为60.95%、31.43%和9.52%。说明类NADC30毒株和HP-PRRSV毒株在被调查地区已属于优势基因型,这与周群等[5]调查结果基本一致,提示当前国内部分地区PRRSV流行毒株基因型较为复杂,这也说明对PRRSV流行株进行基因型鉴定十分重要。
在PRRSV基因组中,ORF5基因是变异最频繁的开放阅读框之一,大量研究表明可以依据ORF5基因对PRRSV遗传变异情况进行初步探究[12-14]。为初步分析河北及周边地区流行类NADC30毒株遗传变异情况,本试验对8个类NADC30毒株ORF5基因序列进行扩增、测序和分析,发现8个类NADC30毒株ORF5基因与经典PRRSV弱毒疫苗毒株VR2332和高致病性PRRSV弱毒疫苗毒株(JXA1和HuN4)同源性相对较低,这提示此类疫苗对类NADC30毒株的防控能力可能有限[13]。

