芫根调节免疫功能的小肠转录组学研究
代泽咏 骆芷寒 王禹蒙 刘延友 肖静 汪宇辉 郭慧玲 江舟
(四川大学华西基础医学与法医学院·国家卫生健康委员会时间生物学重点实验室,四川 成都 610041)
芫根,又名芜青、蔓菁,藏语名为妞玛,维语名为恰玛古,十字花科芸薹属芸薹种芜菁亚种二年生草本植物[1],是川藏高原地区颇具特色的蔬菜资源,也是当地重要的经济作物[2]。芫根富含生物碱、多糖、维生素、矿物质、脂肪酸、黄酮类、粗蛋白、槲皮素、甾体等多种营养成分和生物活性物质,有食、药、饲三大应用价值[3]。芫根的药理学研究显示,芫根提取物在降血糖[4],抗缺氧[5],抗肿瘤[6],改善肠道菌群和调节免疫[7-8],抗疲劳[9]等多重功效,提示芫根的药用价值不可估量。目前关于芫根药理功效的研究还停留在其原料提取、动物实验及验证等方面,有关芫根改善机体免疫功能的分子生物学机制研究还是空白。小肠是机体最主要的食物消化和物质吸收器官,同时也是最大的免疫器官和免疫前哨站[10]。本课题组拟在前期的研究基础上,应用转录组测序技术检测芫根对小鼠小肠组织全基因表达谱的影响,一方面对系统阐明芫根的免疫调节功能及分子生物学机制有重要的意义,为合理表征芫根的性效及拓宽其临床治疗提供基础依据,从而给发掘利用这种川藏特色经济作物资源提供科学指导;另一方面,相关机制可以作为指导免疫调节药物研发的筛选标准之一,给相关药物靶点的筛选和新药的研究开发等工作提供可靠的数据支持。
1 材料与方法
1.1 实验材料与动物分组 雄性SPF级BALB/c小鼠18只购买自四川成都达硕动物有限公司,周龄8周左右,体重18~20g。将小鼠饲养在光暗节律12L:12D的光暗循环箱,室温(25±2)℃,保持动物室安静,小鼠自由饮水和进食,适应新环境两周使小鼠状态同步化。然后将小鼠随机分为3组,每组6只,SC1组灌胃芫根提取液,SC2组灌芫根原浆悬液,NC组灌胃生理盐水。芫根提取液和芫根原浆悬液由四川小叶本草生物科技有限公司生产提供。按规格,小鼠(20 g)的单次剂量:人(70 kg)的单次剂量=1∶387.9,经计算后,SC1组小鼠每只每次灌胃 150 μL 芫根提取液,SC2组小鼠每只每次灌胃 150 μL芫根原浆悬液,NC组小鼠每只每次灌胃 150 μL生理盐水,每日灌胃一次,连续7 d。本研究通过动物伦理委员会审核批准。
1.2 方法
1.2.1 小鼠小肠RNA的提取与测序 小鼠灌胃7 d后用劲椎脱臼法处死,每组随机取3只小鼠取小肠样本,使用PBS溶液清洗3遍。按照福际生物RNA提取试剂盒说明书提取总RNA。总RNA经质检合格后,采用 Illumina Hiseq4000 进行测序,测序读长为双端 2*150bp(PE150)。
1.2.2 基因水平差异表达研究及制图 利用上述数据分析程序对基因水平表达差异展开研究,以参考基因组为基准利用Hisat软件将3组测序数据分别两两比对,利用比对后的结果(alignments)参与组装转录本。然后使用edgeR对NC组基因分别与SC1组和SC2组基因的差异表达分析,最后采用R语言图形化以差异倍数log2(foldchange)为横坐标,显著水平-log10(p value)为纵坐标,显著差异的阈值为|log2foldchange|≥1,P<0.05,进行基因表达差异评估,对差异表达的所有基因绘制火山图。
1.2.3 差异表达基因GO功能富集性分析 对差异表达基因的GO功能富集分析可了解功能组基因的富集情况,富集程度高提示两组在此功能方面的差异效应显著,该GO功能基因组比较重要。首先把所有显著性差异表达基因向Gene Ontology数据库的各功能基因组映射,计算每个功能基因组的基因数目,然后应用超几何检验,找出与整个基因组背景相比,在显著性差异表达基因中显著富集的GO条目(P<0.05)。采用edgeR对GO富集分析结果以散点图展示。
1.2.4 差异表达基因KEGG信号通路富集性分析 基于信号通路的分析有助于更进一步了解基因的生物学效应。在生物体内,不同基因需要通过相互协调行使其生物学功能,KEGG是有关信号通路的主要公共数据库,通过差异基因的KEGG富集分析了解哪些信号通路对应的基因富集较多。信号通路基因显著性富集分析以KEGG Pathway为单位,应用超几何检验,找出与整个基因组背景相比,在显著性差异表达基因中显著性富集的信号通路(P<0.05),采用edgeR对KEGG富集分析结果以散点图展示。
1.2.5 免疫通路差异表达基因热图绘制 为了更好地直观反映免疫功能和信号通路相关基因的差异表达和聚类表达模式,我们采用 log10(FPKM+1)进行基因表达展示,同时将差异表达基因 FPKM 通过Z值方式进行基因表达展示(P<0.05)。选取SC1组和SC2组中发生同向表达差异的免疫通路相关基因,横坐标为样本,纵坐标为基因,不同的颜色表示不同的基因表达水平,颜色由蓝色经由白色至红色 表示表达量从低到高。红色表示高表达基因,蓝色表示低表达基因。
2 结果
2.1 小鼠小肠的转录谱表达差异分析 小鼠小肠样品转录组测序共检测到27733条 mRNA的表达,通过绘制火山图能可视化差异表达基因的整体分布情况。 差异基因的整体分布情况见火山图(图1A、B)。与NC组相比,SC1组灌喂芫根提取液小鼠肠道表达上升基因有1236个,SC2组灌喂绞碎芫根原浆悬液小鼠肠道表达上调基因有2233个;相比对照组,SC1和SC2组分别有399和639个基因表达水平下调(图1C)。其中,有1287个基因在SC1组灌喂芫根提取液小鼠和SC2组灌喂绞碎芫根原浆悬液小鼠均同向差异表达(图1D)。
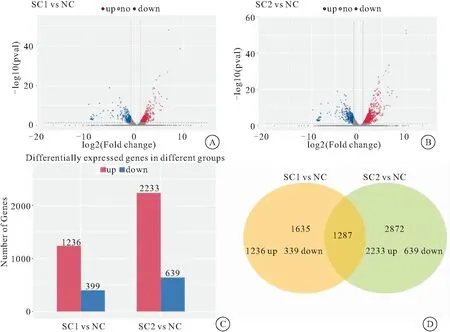
图1 小鼠小肠的转录谱表达差异分析Figure 1 Differential analysis of transcription profile expression in small intestine of mice注:A、B分别为差异表达基因火山图,横坐标代表基因在不同样本中差异表达倍数变化,纵坐标代表基因表达量变化差异的统计学显著性,红色代表上调的显著差异表达基因,蓝色代表下调的显著差异表达基因,灰色的点代表非显著性差异表达基因;C.差异表达分析基因柱状图;D.差异表达分析基因韦恩图
2.2 差异表达基因GO功能富集性分析 GO功能富集分析结果以散点图展示,富集度前20位,采用ggplot2对GO富集分析结果以散点图展示,Rich factor表示位于该GO的差异基因个数/位于该GO的总基因数,Rich factor越大,GO富集程度越高(P<0.05),见图2;其中细胞对干扰素的反应、先天性免疫应答、多细胞机体发育、白细胞介素分泌、转录的正调控是SC1组、SC2组差异表达基因GO功能富集度均位于前20的功能基因组,见表1。

表1 SC组差异表达基因GO功能富集度均位于前20的功能基因组Table 1 The GO enrichment degree of differentially expressed genes in SC group was all in the top 20 functional genomes
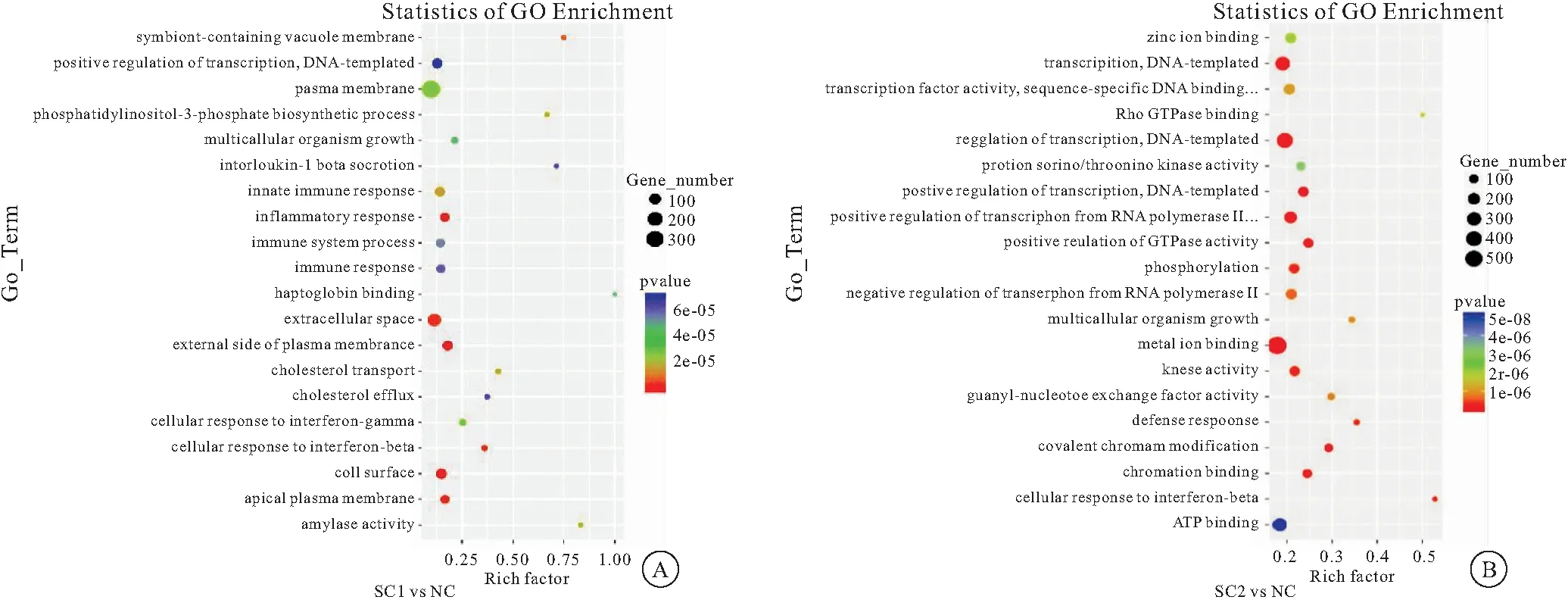
图2 差异表达基因GO功能富集性分析Figure 2 GO functional enrichment analysis of differentially expressed genes
2.3 差异表达基因KEGG信号通路富集性分析 KEGG信号通路富集分析结果以散点图展示,富集度前20位,采用ggplot2对KEGG富集分析结果以散点图展示,Rich Factor表示位于该KEGG的差异基因数/位于该KEGG的总基因数,Rich Factor值越大,KEGG富集程度越大(P<0.05),见图3;其中维生素消化和吸收、T细胞受体信号通路、脂肪消化和吸收是SC1组、SC2组差异表达基因KEGG信号通路富集度均位于前20的信号通路基因组,见表2。

图3 差异表达基因KEGG富集性分析Figure 3 KEGG enrichment analysis of differentially expressed genes

表2 SC组差异表达基因KEGG信号通路富集度均位于前20的信号通路基因组Table 2 KEGG signal pathway enrichment degree of differentially expressed genes in SC group was all in the top 20 signal pathway genomes
2.4 白细胞介素分泌相关基因表达 差异基因聚类分析用于判断基因在不同实验条件下调控模式的聚类模式。根据样品基因表达谱的相近程度,将基因进行聚类分析,直观地展示基因在不同样品(或是不同处理)中的表达情况,由此获取生物学相关信息。根据前面差异表达基因富集度的结果,重点结合免疫相关通路,我们选择了白细胞介素分泌、细胞对干扰素的反应、T细胞受体信号通路的差异表达基因制图进行聚类分析。芫根处理小鼠后,小鼠小肠中Ccl20、Il18、Il1a、Il2rg、Cd274等21个白细胞介素分泌相关基因发生显著性差异表达。其中19个基因表达上调,2个基因表达下调(图4)。表达下降的Ccl20和Il18是主要分布在肠道黏膜层炎性趋化因子的基因,表达上调的大多属于白介素配体和相关受体亚基蛋白基因,如Il1和Il2rg等。Cd274是经典活化型巨噬细胞表面特异表达的抗原分化簇的基因,也呈表达上升趋势。
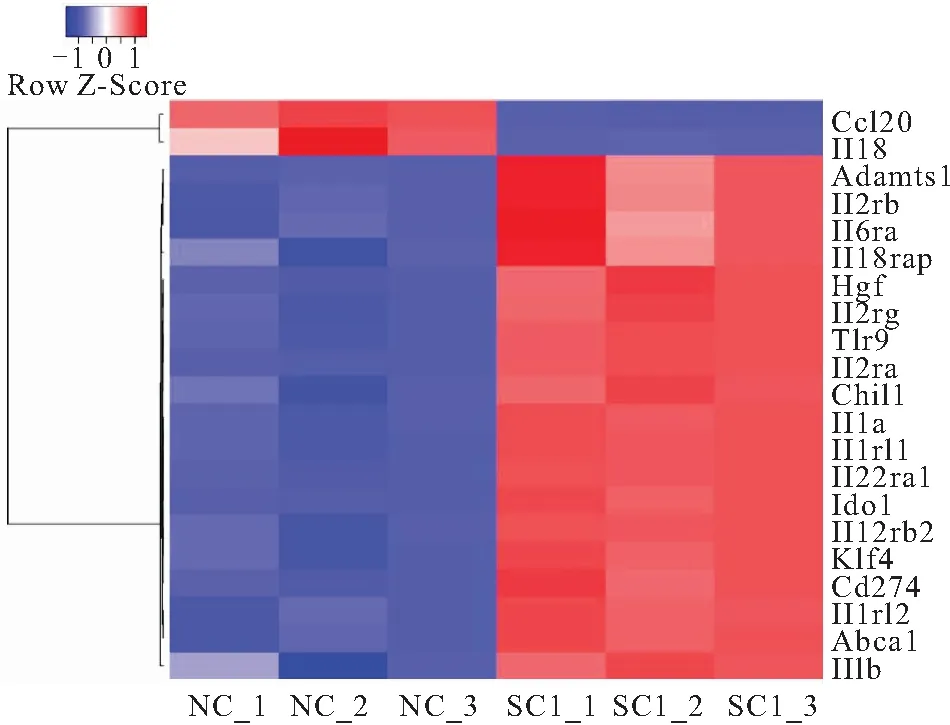
图4 白细胞介素分泌过程相关基因表达变化热图Figure 4 Heat map of interleukin secretion related gene expression changes
2.5 细胞对干扰素的反应相关基因表达 芫根处理小鼠后,小鼠小肠中Ifng、Ifnar1、Ifngr2、Ifit3、Cd274等共30个细胞对干扰素反应相关基因发生显著性差异表达。其中25个基因表达上调,5个基因表达下调(图5)。此系统里有多个基因同属上述白介素系统,干扰素诱导蛋白家族基因里Ifit3和Ifit1表达下调,其余Ifit表达上升。与此相应,各种干扰素基因和受体亚基基因也均上调表达。

图5 细胞对干扰素的反应过程相关基因表达变化热图Figure 5 Heat map of gene expression changes related to the reaction process of cells to interferon
2.6 T细胞受体信号通路相关基因表达 芫根处理小鼠后,小鼠小肠中共21个T细胞受体信号通路相关基因发生显著性差异表达。其中19个基因表达上调,2个基因表达下调(图6)。T细胞受体信号通路的受体亚基蛋白CD4,接头蛋白LAT,T细胞活化相关激酶LCK、ZAP70、FYN、ITK和调节蛋白GRB2、SOS1等的编码基因均表达升高。
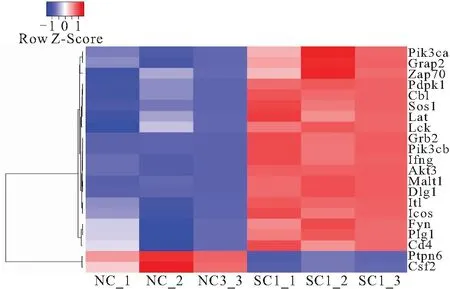
图6 T细胞受体信号通路途径相关基因表达变化热图Figure 6 Heat map of T cell receptor signaling pathway related gene expression changes
3 讨论
本研究利用RNA序列研究了芫根喂养对小鼠肠道基因表达变化的影响。 结果显示,芫根提取液灌胃小鼠导致小肠中1635个基因发生差异表达,其中1236个基因表达上调,399个基因表达下调;芫根原浆灌胃小鼠导致小肠中2872个基因发生差异表达,其中2233个基因表达上调,639个基因表达下调。两个芫根组的上调表达基因数都显著高于下调表达基因数,且有1287个共同向差异表达基因,证明芫根灌胃有效达到了实验效果。
单核-巨噬细胞统称吞噬细胞,是机体内最广泛的免疫细胞,在不同的生理条件下吞噬细胞可极化为经典活化性巨噬细胞(M1型巨噬细胞)和选择替代性巨噬细胞(M2型巨噬细胞),两类巨噬细胞也可相互极化。M2型巨噬细胞抑制免疫反应并促进肿瘤增殖;M1型巨噬细胞是机体的防卫士,全方位介入非特异性免疫和特异性免疫过程,能分泌的各类细胞因子调控免疫反应[11-14]。白细胞介素在巨噬细胞和各类白细胞的信息传递,介导T、B细胞的激活与调节免疫细胞的分裂与转化及炎症反应中起重要作用。本实验中白细胞介素分泌相关基因差异表达热图显示芫根组小鼠的CD274基因表达上调,Ccl20基因表达下调。CD274蛋白是M1型巨噬细胞表面的标记性蛋白,该基因表达上调提示巨噬细胞向M1型转化率提高,增强了巨噬细胞的抗病毒、抗癌及各种免疫反应中的作用[15]。CCL20蛋白是一种炎症趋化因子,主要由受到损伤或感染的肠上皮细胞分泌,当肠道上皮细胞被破坏、受到病原体感染或菌群变化时,肠上皮CCL20的表达迅速升高,打破局部的免疫平衡,该基因的低表达提示肠道处于健康的防护的状态[16-17]。T细胞是机体内功能最复杂的特异性免疫核心淋巴细胞,直接参与细胞免疫和递呈诱导体液免疫,因此T细胞的功能调节在免疫功能调节中发挥着核心影响力[18-19]。本实验中T细胞受体信号通路相关基因差异表达热图显示芫根组小鼠的受体亚基蛋白CD4,接头蛋白LAT,T细胞活化相关激酶LCK、ZAP70、FYN、ITK和调节蛋白GRB2、SOS1等蛋白的编码基因均表达升高,提示T细胞被活化。干扰素是一类具有高度种属特异性的糖蛋白,具有抗病毒、抗癌和调节免疫的作用,细胞对干扰素的反应相关基因差异表达热图显示芫根组小鼠的多种干扰素诱导蛋白和靶干扰素的基因表达量提高,尤其是IFNG和IFNA转导途径相关亚基的基因。IFNA是主要由巨噬细胞产生的具有抗病毒效果的干扰素,IFNG是主要由活化T细胞产生的具有抑制细菌生长的干扰素,这两途径的基因表达上调,提示机体的巨噬细胞和T细胞的功能活化,机体的抗病毒和抗病菌感染能力的提升[20-22]。
肠道是机体最主要的消化吸收器官和最大的免疫器官,正常结构功能与生理反应相适应,消化吸收功能的正常维持需要有强效且稳定的免疫环境作保障,富集性结果提示芫根有调节肠道免疫系统和强化消化吸收的功效。肠道免疫细胞、非免疫细胞和肠道菌群之间有很多的相互作用,三者复杂的联系共同参与了肠道保护、耐受和内环境稳定,这些相关要素以协调的方式协同工作,以预防疾病、维持内环境稳定和保障最大限度地获取营养。一旦动态平衡被打破,就会导致肠道免疫功能失调,引发各种代谢类和消化系统疾病[23-24]。肠道菌群作为身体不可或缺的重要组成部分,其数量可匹敌机体本身的细胞数,种类繁多且生理机能复杂,参与了免疫系统发育、先天性免疫和特异性免疫等过程,对维持体内生理环境平衡,调节肠道营养物质消化吸收,调控机体免疫功能等都有重要研究价值[25-27]。研究发现芫根可促进肠道内一种短链脂肪酸SCFAs的分泌,而这种肠道菌群来源的短链脂肪酸的增加可提高机体免疫力并维护肠道的平衡稳态,对健康具有重要促进作用[8,28-29]。GO富集性分析显示芫根组差异表达基因在白细胞介素分泌、细胞对干扰素的反应、先天免疫反应以及细胞质膜两侧、正向转录调控等过程高度富集且多数表达上调。KEGG富集性分析显示芫根组差异表达基因富集在T细胞受体信号通路、病菌免疫及肿瘤监控途径、各种营养物质的消化与吸收代谢途径等通路中高度富集且多数表达上调。推测可能是芫根促进肠道益生菌增殖,抑制肠道病原菌的增殖,改善肠道了菌群结构从而导致SCFAs分泌增加进而调节了免疫系统。
芫根提取液灌胃小鼠共诱导了小肠1635个基因发生差异表达,而芫根原浆灌胃小鼠共诱导了小肠2872个基因发生差异表达,芫根原浆组差异表达基因量和基因差异表达幅度高于芫根提取液组,提示芫根原浆中可能有芫根提取液中丢失的有效成分或者相关效应分子浓度高于芫根提取液。研究发现食源植物miRNA跨界调控动物基因表达的途径,是中草药和药食两用作物发挥药效的潜在调控机制[30-31]。芫根提取液在制作过程中容易破环原料内部的核酸分子,因此可能是造成本实验两个芫根组差异表达基因量差异的根本原因,本课题组下一步还将以miRNA为切入点进一步深入探索机制。
4 结论
本实验利用生物信息学技术分析小鼠小肠转录组基因,揭示了芫根灌胃小鼠小肠的差异表达基因在白介素分泌、干扰素反应、T细胞受体信号通路、营养物质消化吸收等途径高度富集,提示芫根对肠道免疫系统及肠黏膜功能的调节。其中Cd274的表达上调和Ccl20的表达下调提示诱导M1型巨噬细胞极化和T细胞活化可能是芫根调控免疫和维护肠道正常结构功能的重要途径。本研究结果对进一步验证芫根调节免疫功能的指标,剖析芫根调控免疫系统的分子机制和深入探索其有效成分具有一定的指导意义。

