miR-200c-3p通过靶向Zeb1调控骨关节炎小鼠模型中软骨细胞凋亡和炎症反应
韩楠 乔晓峰 朱晓文 倪健
(佳木斯大学附属第一医院 1.骨一科;2.普外科,黑龙江 佳木斯 154000)
骨关节炎(Osteoarthritis, OA)是最常见的一种关节炎,据估计全球约有2.4亿人受到骨关节炎的影响[1]。老年人通常开始出现骨性关节炎症状,并伴随这种慢性残疾生活,严重影响生活质量。由于医疗保健和社会支出,骨关节炎的财政支出也给患者个人和保险公司带来了沉重负担[2]。因此,全面阐明骨关节炎疾病进程的分子机制对寻找新的治疗方法具有重要意义。各种病理改变可导致骨关节炎症状,如关节软骨和韧带的退化、滑膜炎症、骨赘形成或关节囊肥大。软骨细胞是关节软骨的主要常驻细胞,负责产生和维持软骨基质,其失调是骨关节炎发病机制中最常见的相关因素之一[3]。细胞凋亡增加、细胞增殖能力减弱、软骨细胞数量和活力降低以及软骨细胞炎症通常参与了骨关节炎的进展[4]。因此,充分了解软骨细胞与细胞凋亡和炎症相关的调控机制有助于寻求更有效的骨关节炎治疗策略。microRNAs (miRNAs)是内源性 (21~23个核苷酸)的非编码RNA,能够通过与 mRNA序列的3′UTR区域互补配对控制靶mRNA的翻译从而负向调控靶mRNA的表达[5]。miRNA的异常调控参与了多种疾病的发病机制,包括肿瘤发生、神经系统疾病和骨关节炎[6]。miR-200c-3p已被证明在骨关节炎样本中低表达[7],但其在骨关节炎中的具体功能和调控机制仍有待发掘。本研究旨在评估miR-200c-3p在骨关节炎进展中对软骨细胞凋亡和炎症反应的调节作用及其下游调控机制。
1 材料与方法
1.1 实验试剂与仪器 胶原酶D(罗氏),1%青霉素/链霉素(武汉益普生物科技有限公司),LipofectamineTM3000(美国英杰公司),miR-200c-3p模拟物(上海吉玛制药技术有限公司),脂多糖(上海西格玛奥德里奇贸易有限公司),CO2恒温细胞培养箱(上海朗喜工业科技有限公司),miRNeasy Mini试剂盒(德国QIAGE公司),miScript逆转录试剂盒(德国QIAGE公司),C1磁珠(美国赛默飞世尔生物技术有限公司),pmirGLO双荧光素酶报告载体(上海吉凯基因医学科技股份有限公司),双荧光素酶报告检测系统(北京普洛麦格生物技术有限公司),ELISA试剂盒(美国赛默飞世尔生物技术有限公司),Annexin V-FITC/PI凋亡试剂盒(杭州联科生物技术股份有限公司),流式细胞仪(美国贝克曼库尔特有限公司),酶标仪(美谷分子仪器上海有限公司)。
1.2 实验动物及OA模型的建立 从中国科学院上海实验动物中心获得30只雄性小鼠C57BL/6 (8周,体重20~25 g),在一个特定的实验动物设施的无病原体的微隔离笼子里饲养,温度为22~24℃,可自由获得食物和水。小鼠随机分为对照、Sham、OA组,每组10只。如前所述,通过破坏内侧半月板的稳定性构建小鼠OA模型[8]。实验所涉及的所有程序均经佳木斯大学附属第一医院批准。
1.3 小鼠软骨细胞培养 小鼠原代关节软骨细胞从膝关节组织中分离[9]。用颈椎脱位法对8周大的雄性小鼠实施处死,并小心地从胫骨平台、股骨头和股骨髁中取出关节软骨组织,然后用磷酸盐缓冲盐水冲洗。切断关节软骨,用胶原酶D (3 mg/mL)室温下过夜不旋转。过滤消化液,将细胞悬浮于Dulbecco's Modified Eagle Medium (DMEM)培养基中,加入10%胎牛血清和1%青霉素/链霉素。将细胞放置于培养箱中培养(条件设置为5% CO2, 37℃)。细胞传代2~3周,培养至70~80%合流。
1.4 细胞转染 将软骨细胞用100 ng/mL脂多糖(LPS)处理细胞6 h,诱导炎症反应。将miR-200c-3p模拟物(miR-200c-3p mimics)和阴性对照(NC mimics),以及pcDNA3.1/Zeb1和pcDNA3.1空载(对照组)分别添加到培养基中,使用LipofectamineTM3000转染培养的软骨细胞。48 h后,收获细胞,用于后续实验。
1.5 检测方法
1.5.1 实时定量PCR法检测基因表达 使用RNeasy和miRNeasy Mini试剂盒分离总RNA。用miScript逆转录试剂盒将RNA逆转录成cDNA。使用SYBR Green qPCR检测试剂盒(Applied Biosystems)进行qPCR。将GAPDH和U6分别作为miR-200c-3p和Zeb1的内参基因。采用2-ΔΔCt法计算RNA的相对表达水平。
1.5.2 CCK-8 将细胞株悬液(1×105/孔)置于96孔板中,每孔加入10 μL的CCK-8溶剂。将培养板在培养箱中孵育3 h,采用分光光度计计算450 nm处的吸光度以检测细胞增殖能力。
1.5.3 流式细胞术分析 转染后的细胞经收集用于流式细胞术。根据制造商说明书,Annexin V-FITC/PI凋亡试剂盒双染色后,使用流式细胞仪检测细胞凋亡。所有实验均为3个重复。
1.5.4 酶联免疫吸附试验(ELISA) 培养上清液和滑膜液中的蛋白质水平通过ELISA试剂盒按照制造商的协议进行测定。
1.5.5 RNA pull down实验 用生物素标记miR-200c-3p野生型和突变型探针,并与C-1磁珠在25℃孵育2 h形成探针吸附的磁珠。将细胞裂解液与探针4℃下孵育过夜。洗脱后,将磁珠吸附的RNA混合物洗脱,采用RNeasy Mini试剂盒提取RNA后进行RT-qPCR分析,计算RNA丰度。
1.5.6 双荧光素酶报告基因实验 扩增Zeb1的3′UTR片段,该片段包含预测的miR-200c-3p结合位点,并克隆到双荧光素酶报告载体pmirGLO中。同时构建了Zeb1 3′UTR突变体荧光素酶报告基因。使用LipofectamineTM3000试剂将这三个载体与miR-200c-3p模拟物或阴性对照模拟物共转染到细胞中。转染48 h后收集细胞。使用双荧光素酶报告系统检测荧光素酶活性。

2 结果
2.1 miR-200c-3p在OA小鼠模型中低表达 RT-qPCR结果表明,与对照组和Sham组小鼠相比,OA小鼠关节软骨中miR-200c-3p的表达明显下调(P<0.05),见图1。
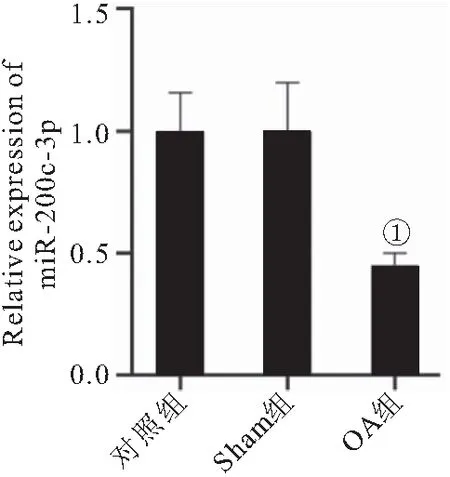
图1 miR-200c-3p在OA小鼠模型中低表达Figure 1 miR-200c-3p in the low expression of OA in mice model 注:与对照组、Sham组比较,①P<0.05
2.2 过表达miR-200c-3p保护小鼠软骨细胞免受脂多糖诱导的损伤 我们在体外构建骨关节炎细胞模型。RT-qPCR检测发现LPS处理后的软骨细胞中miR-200c-3p的表达显著下调(图2A)。为了进一步验证miR-200c-3p对骨关节炎细胞生物学行为的影响,我们在LPS诱导的细胞中转染miR-200c-3p mimics增加miR-200c-3p在LPS处理后的软骨细胞中的表达(图2B)。CCK-8实验结果表明,LPS诱导软骨细胞活性降低,而miR-200c-3p mimics逆转了LPS处理导致的软骨细胞活力的下降(图2C)。此外,LPS处理后,软骨细胞的凋亡显著增多,而过表达miR-200c-3p显著抑制脂多糖诱导的细胞凋亡(图2D)。随后,我们采用ELISA试剂盒检测发现LPS诱导软骨细胞中促炎细胞因子IL-1β、IL-6和TNF-α含量增加,而过表达miR-200c-3p显著降低了LPS处理所导致的促炎细胞因子的产生(图2E)。
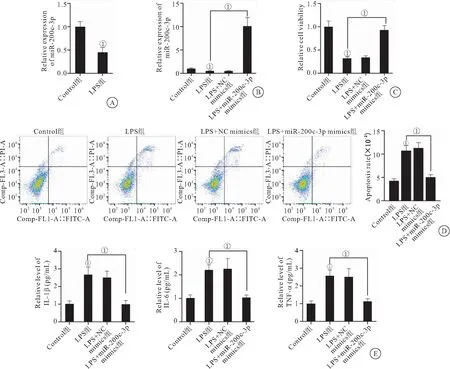
图2 过表达miR-200c-3p保护小鼠软骨细胞免受脂多糖诱导的损伤Figure 2 Overexpression of miR-200c-3p to protect cartilage cells from damage induced by lipopolysaccharide in mice注:A.RT-qPCR检测LPS处理和Control组软骨细胞中miR-200c-3p的水平;B.RT-qPCR检测Control、LPS、LPS+NC mimics和LPS+miR-200c-3p mimics组小鼠关节软骨细胞中miR-200c-3p的水平;C.CCK-8法检测LPS处理后,miR-200c-3p过表达导致的软骨细胞增殖能力的变化;D.流式细胞术检测LPS处理后,miR-200c-3p过表达导致的软骨细胞凋亡的变化;E.ELISA检测小鼠原代软骨细胞上清中IL-1β、IL-6和TNF-α在Control、LPS、LPS+NC mimics和LPS+miR-200c-3p mimics组水平。①P<0.05
2.3 Zeb1是miR-200c-3p的靶基因 为了进一步研究miR-200c-3p下游潜在的分子机制,我们使用包括microT和RNA22在内的在线生物信息学分析工具确定了6个miR-200c-3p的潜在的靶mRNA(图3A)。RT-qPCR分析结果显示,miR-200c-3p过表达后,只有Zeb1的表达水平显著降低(图3B)。此外,我们发现OA小鼠关节软骨中以及LPS处理后的软骨细胞中Zeb1的表达明显上升 (图3C)。为了进一步探究miR-200c-3p和Zeb1之间的关系,我们进行了RNA pull down实验。结果显示,Zeb1在野生型的miR-200c-3p探针下拉的RNA复合物中显著富集,而在突变型的miR-200c-3p探针下拉的复合物中无显著富集(图3D)。另外,我们在Zeb1的3′UTR区域预测了miR-200c-3p的结合位点(图3E)。为了验证这一作用位点,我们将野生型或突变型的Zeb1 3′UTR片段克隆到荧光素酶报告基因载体中,然后将载体与miR-200c-3p mimics或NC mimics共转染到细胞中。过表达miR-200c-3p显著降低了野生型的荧光素酶活性,但对突变型的活性无显著影响,表明miR-200c-3p靶向Zeb1 3′UTR(图3F)。
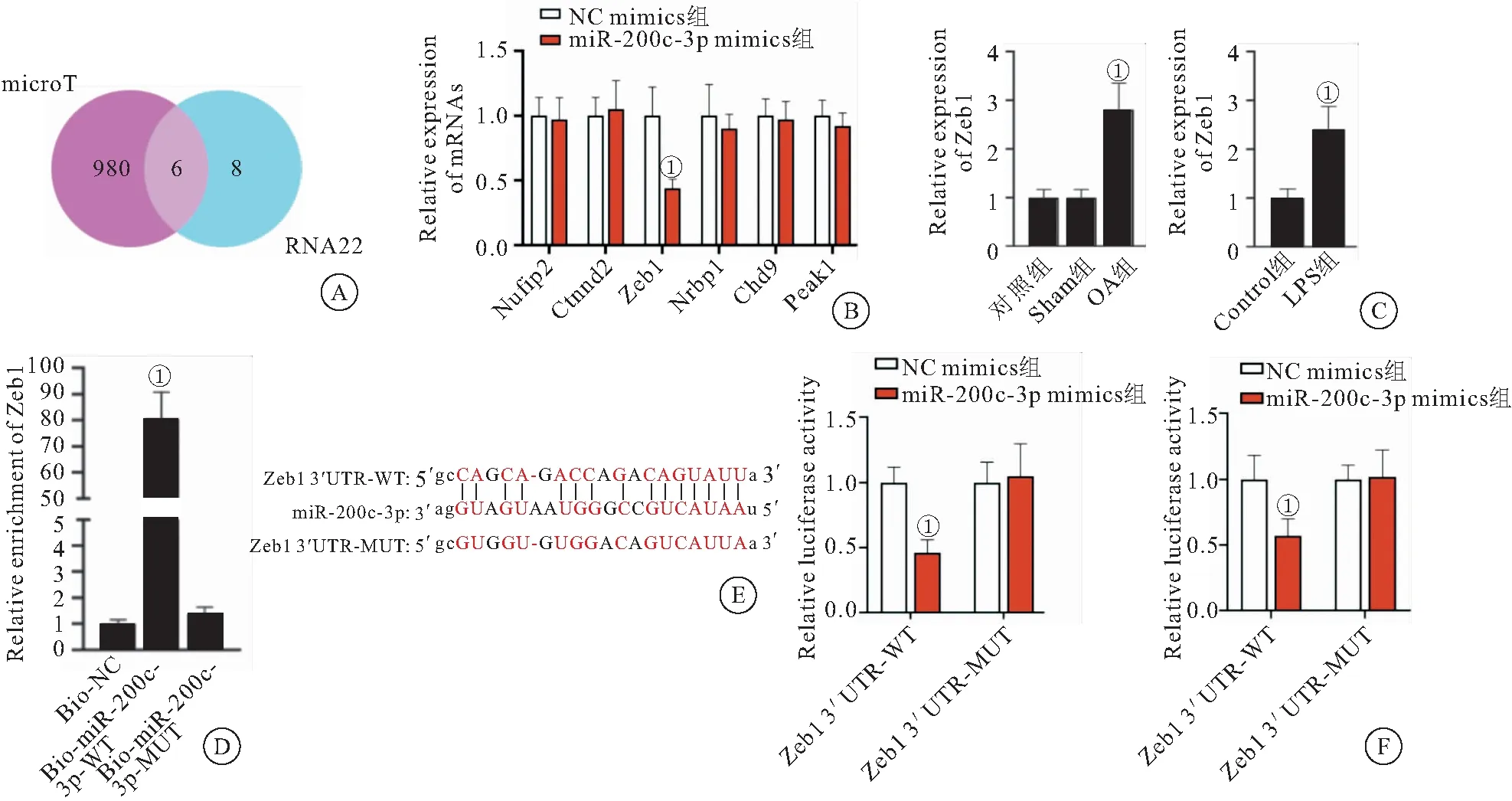
图3 Zeb1是miR-200c-3p的靶基因Figure 3 Zeb1 is miR-200c-3p target genes注:A.microT和RNA22在内的在线工具进行生物信息学预测6个miR-200c-3p的潜在的mRNAs;B.RT-qPCR检测miR-200c-3p过表达对6个mRNAs表达的影响;C.RT-qPCR检测OA小鼠、假手术小鼠和对照小鼠关节软骨组织中Zeb1的水平以及LPS处理和Control组软骨细胞Zeb1的水平;D.RNA pull down实验验证Zeb1和miR-200c-3p结合;E.Zeb13′UTR和miR-200c-3p的结合位点;F.荧光素酶报告基因实验验证Zeb13′UTR和miR-200c-3p的结合。①P<0.05
2.4 miR-200c-3p通过调控Zeb1保护小鼠软骨细胞免受脂多糖诱导的损伤 我们在LPS处理的软骨细胞中过表达Zeb1,RT-qPCR结果表明转染了pcDNA3.1/Zeb1的细胞中Zeb1表达显著高于转染pcDNA3.1空载的细胞(图4A)。随后进行拯救实验验证miR-200c-3p/Zeb1轴对骨关节炎软骨细胞功能的影响。CCK-8实验结果表明,在LPS处理的软骨细胞中,miR-200c-3p过表达导致的细胞活力的减少以及细胞凋亡的增加在共转染pcDNA3.1/Zeb1后回升至初始水平(图4B~D)。此外,Zeb1上调可以逆转miR-200c-3p过表达抑制的IL-1β、IL-6和TNF-α的产生(图4E)。
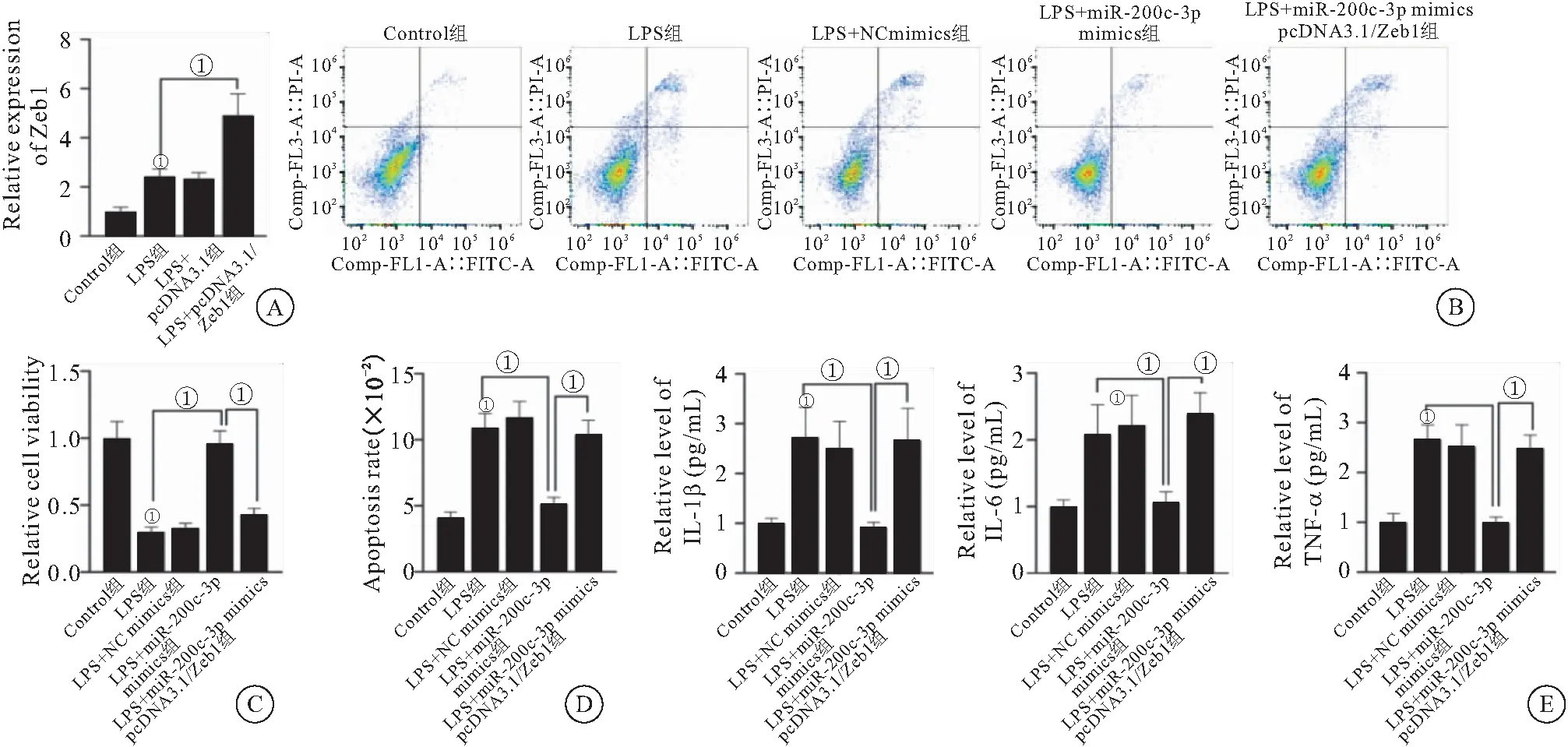
图4 miR-200c-3p通过调控Zeb1保护小鼠软骨细胞免受脂多糖诱导的损伤Figure 4 miR-200c-3p through regulating Zeb1 protect cartilage cells from damage induced by lipopolysaccharide in mice注:A.RT-qPCR检测Control组、LPS、LPS+pcDNA3.1和LPS+pcDNA3.1/Zeb1组小鼠关节软骨组织中Zeb1的水平;B.CCK-8法检测LPS处理后,不同分组的软骨细胞增殖;C.LPS处理后,不同分组的软骨细胞活性;D.流式细胞分析检测LPS处理后,不同分组的软骨细胞凋亡;E.ELISA检测不同分组小鼠原代软骨细胞上清中IL-1β、IL-6和TNF-α的水平。①P<0.05
3 讨论
越来越多的证据表明,miRNAs是人类疾病进展过程的重要参与者[10-15]。在骨关节炎中,miRNA-335-5p被报道能够通过激活骨关节炎中的自噬来缓解软骨细胞炎症[16]。miR-29b-3p通过靶向PGRN促进软骨细胞凋亡,促进骨关节炎的发生发展[17]。microRNA-455-3p通过直接靶向PAK2促进TGF-β信号转导并抑制骨关节炎的发展[18]。据报道,miR-200c-3p的异常表达存在于不同类型的疾病中,并调控炎症、血管生成和肿瘤发生等许多重要的生物学过程[19-23]。有研究报道miR-200c-3p在骨关节炎患者样本中低表达[7]。然而,miR-200c-3p在骨关节炎细胞模型中的作用和潜在机制仍然有待研究。本研究证实了miR-200c-3p在骨关节炎小鼠软骨中表达下调,并且发现其在LPS诱导的骨关节炎细胞模型中也呈现显著下调。我们将miR-200c-3p模拟物转染进骨关节炎细胞模型中,发现过表达miR-200c-3p可以保护软骨细胞免受LPS诱导的细胞凋亡和炎症损伤。
Zeb1是已知的诱导上皮间质转化的转录调控因子,在正常的生理和病理过程中都起着重要的作用[24]。已有报道显示内皮细胞Zeb1促进血管生成依赖的骨形成并逆转骨质疏松症[25]。Zeb1可作为microRNA-708靶基因共同参与调控乙醇诱导的肝脂质积累和炎症反应[26]。然而,Zeb1与miR-200c-3p之间的关系仍有待进一步研究。本研究首先通过生物信息学分析工具筛选发现Zeb1是miR-200c-3p潜在的靶基因。此外,我们确认Zeb1在骨关节炎软骨和LPS诱导的软骨细胞中显著上调。通过RNA pull down实验和荧光素酶报告实验,我们验证了miR-200c-3p能够靶向Zeb1的3′UTR。最后通过功能拯救实验,我们发现Zeb1能够参与miR-200c-3p调控的骨关节炎软骨细胞增殖、凋亡和炎症反应。这揭示了miR-200c-3p能够靶向Zeb1调节炎症信号来保护软骨细胞。
4 结论
本研究表明miR-200c-3p直接靶向Zeb1的3′UTR结合,保护软骨细胞免受脂多糖诱导的炎症损伤,为发掘骨关节炎新的治疗靶点提供了有价值的见解。

