金樱叶的化学成分及抗炎活性研究
何艳妮,焦伟华,林厚文,洪丽莉*
1.西安国际医学中心医院,西安 710100;2.上海交通大学医学院附属仁济医院,上海 200127
金樱叶为蔷薇科蔷薇属植物金樱子(RosalaevigataMichx.)的嫩叶。其性平味辛,主治金疮、痈肿、溃疡、烫火伤等[1]。现代药理学研究表明,金樱叶乙醇提取物能明显促进大鼠深度烫伤创面愈合,且无明显瘢痕,电镜观察发现其能显著促进血管内皮细胞生长,可使肉芽组织内新生毛细血管增生活跃[2]。金樱叶的主要成分为三萜类、酚酸类和黄酮类化合物[1-3]。金樱叶资源丰富,药用悠久,疗效确切可靠,但目前国内外有关金樱叶化学成分和生物活性的报道较少。为了进一步阐明金樱叶的药效物质基础,作者对金樱叶的化学成分做了进一步研究,从乙醇提取物分离鉴定了9个化合物,见图1。其中,化合物2、3、6、9为首次从蔷薇属植物中分离得到,化合物1、5、8具有不同程度的抗炎作用。
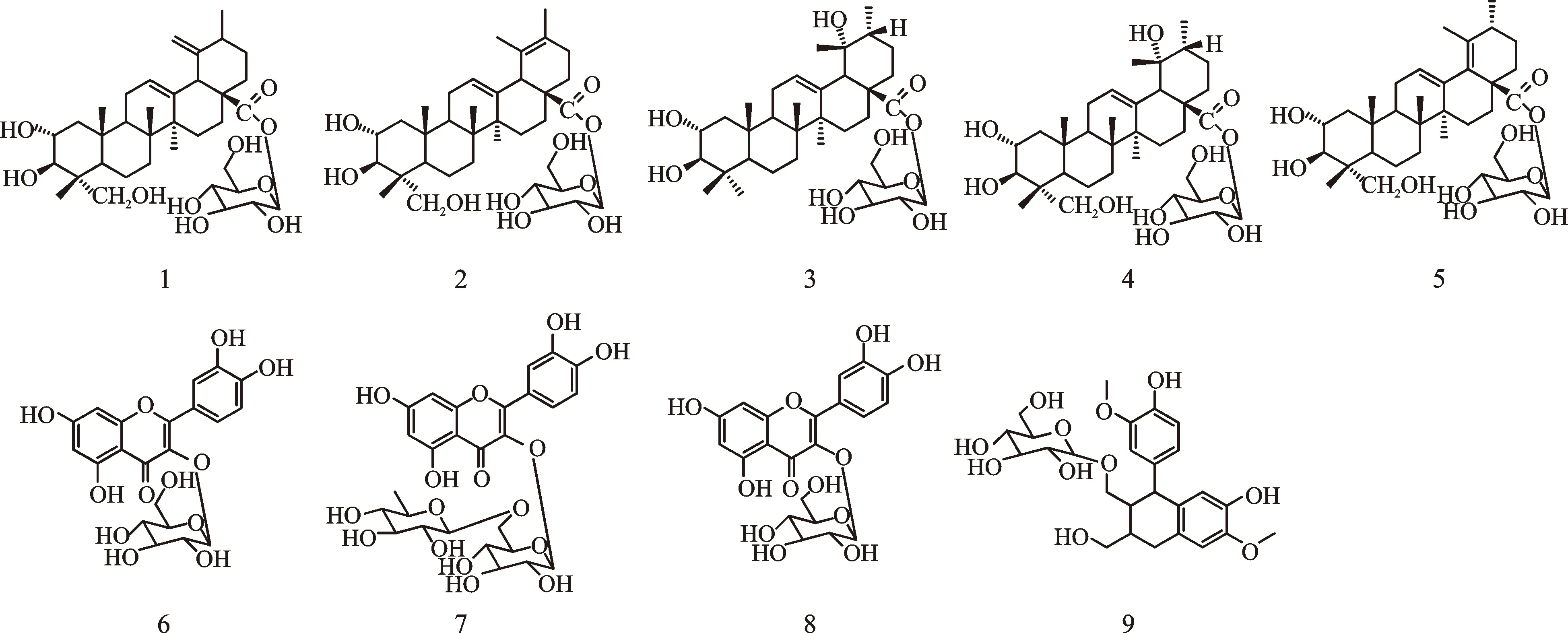
图1 化合物1~9的结构
1 仪器与试药
1.1 仪器
旋转蒸发仪(EYELAN-1000型,Eyela);高效薄层层析板(HPTLC,烟台江友硅胶开发有限公司);色谱柱(YMC-Pack Pro C18RS,250 mm×4.6 mm,5 μm;YMC-Pack ODS-A,250 mm×20 mm,5 μm; Agilent-Eclipse XDB C18,250 mm×9.4 mm,5 μm;Waters);核磁共振仪(Bruker AVANCE-600,Bruker AVANCE-300,Bruker AMX-500);ELISA试剂盒(Biosoerce, Invitrogen)。
1.2 试药
甲醇、乙腈、异丙醇、正己烷均为色谱纯,购自Promptar Limited Company,其他试剂均为分析纯,购自上海化学试剂公司。
金樱叶采摘于安徽省黄山,由第二军医大学药学院李红方老师鉴定为蔷薇科蔷薇属植物金樱子(RosalaevigataMichx.)的嫩叶。
2 提取分离
取金樱子干燥嫩叶7.5 kg,粉碎后用体积分数为75%乙醇[4]回流提取3次,得到取提物5.5 L,取提取物1 L,用水稀释后经大孔树脂色谱柱分离,以乙醇-水(体积分数为0、30%、50%、95%)梯度洗脱,按洗脱梯度分段,得到A(19.4 g)、B(3.2 g)、C(0.3 g)。B部分经ODS柱色谱以甲醇-水进行梯度洗脱(体积分数10%~100%,20 mL·min-1),经HPLC分离得到化合物1(24.3 mg)、2(7.2 mg)、3(24.5 mg)、4(7.5 mg)、5(20.1 mg)。A部分经大孔树脂色谱乙醇-水(体积分数为10%、20%、30%、40%、95%)梯度洗脱、ODS柱色谱甲醇-水(体积分数为33%~100%,20 mL·min-1;体积分数为10%~100%,25 mL·min-1)梯度洗脱[5],经HPLC分离得到化合物6(16.4 mg)、7(8.0 mg)、8(2.1 mg)、9(3.5 mg)。
3 结构鉴定
化合物1白色无定形粉末,HR-ESI-MS 给出准分子离子峰m/z671.377 4 [M+Na]+,结合1H、13C-NMR谱,确定其分子式为C36H56O10。1H-NMR(600 MHz, DMSO-d6)δ: 5.22(1H, t,J=3.5 Hz, H-12), 5.21(1H, d,J=7.8 Hz, H-1′), 4.90(1H, brd,J=1.2 Hz, Ha-29), 4.88(1H, brd,J=1.8 Hz, Hb-29), 1.05(3H, s, CH3-27), 1.04(3H, s, CH3-30), 0.93(3H, s, CH3-25), 0.70(6H, s,CH3-26), 0.53(3H, s, CH3-24)。13C-NMR(150 MHz, DMSO-d6)δ: 175.0(C-28), 153.0(C-19), 136.9(C-13), 127.5(C-12), 110.0(C-29), 94.5(Glc-1′), 77.9(Glc-5′), 76.8(Glc-3′), 75.8(C-3),72.5(Glc-2′), 69.7(Glc-4′), 67.7(C-2), 64.1(C-23), 60.8(Glc-6′), 51.3(C-18), 48.9(C-17), 48.8(C-20), 47.3(C-9), 47.1(C-1), 46.4(C-5), 42.7(C-4), 42.3(C-8), 39.1(C-14), 37.6(C-10), 36.3(C-22), 32.3(C-7), 30.2(C-21), 28.2(C-15), 25.9(C-30), 25.1(C-16), 23.4(C-11), 19.3(C-27), 17.6(C-6), 17.2(C-25), 16.8(C-26), 13.9(C-24)。以上数据与文献数据[3]基本一致,故鉴定化合物1为 isopinfaenoicacid-28-O-β-D-glucopyrann-oside。
化合物2白色无定形粉末,ESI-MS中给出准分子离子峰m/z671.36 [M+Na]+。13C-NMR(150 MHz, DMSO-d6)上可见36 个碳信号,结合1H-NMR、13C-NMR及相对分子质量推出分子式为C36H56O10,不饱和度为9。1H-NMR(600 MHz, DMSO-d6)δ: 5.40(1H, t,J=3.5 Hz, H-12), 5.24(1H, d,J=7.8 Hz, H-1′), 3.49(1H, m, H-2), 1.81(2H, m, H-11), 1.59(3H, s, CH3-30), 1.50(3H, s, CH3-29), 0.94(3H, s, CH3-25), 0.90(3H, s, CH3-27), 0.75(3H, s, CH3-26), 0.53(3H, s, CH3-24)。13C-NMR(150 MHz, DMSO-d6)δ: 175.1(C-28), 137.2(C-12), 128.0(C-19), 126.8(C-13), 123.6(C-20), 94.4(Glc-1′), 78.0(Glc-3′), 77.9(Glc-5′), 75.8(C-3), 72.6(Glc-2′), 69.8(Glc-4′), 67.7(C-2), 64.1(C-23), 60.9(Glc-6′), 49.6(C-18), 48.8(C-5, C-9), 47.5(C-1), 46.4(C-17), 43.1(C-14), 42.6(C-4), 39.0(C-8), 37.5(C-10), 33.1(C-7), 32.1(C-22), 28.0(C-21), 27.6(C-15), 23.3(C-11), 23.0(C-16), 21.9(C-27), 20.4(C-30), 19.3(C-26), 17.6(C-25), 17.5(C-6), 17.0(C-29), 14.0(C-24)。以上数据与文献数据[3]基本一致,故鉴定化合物2为2α,3β,23-三羟基乌苏-12,19-二烯-28-O-β-D-吡喃葡萄糖苷,该化合物为首次从蔷薇属植物中分离得到。
化合物3淡黄色无定形粉末。13C-NMR(125 MHz, DMSO-d6)上可见36 个碳信号,结合1H-NMR、13C-NMR推出分子式为C36H58O10,不饱和度为8。1H-NMR(600 MHz, DMSO-d6)δ: 5.14(1H, d,J=8.0 Hz, H-1′), 3.78(1H, m, H-20), 2.36(1H, m, H-18), 1.77(1H, m, H-1), 1.58(1H, m, H-9), 1.26(3H,s, CH3-27), 1.08(3H, s, CH3-29), 0.91(3H, s, CH3-23), 0.89(3H, s, CH3-25), 0.84(3H, d,J=7.0 Hz, H-30), 0.70(3H, s, CH3-24), 0.66(3H, s, CH3-26)。13C-NMR(150 MHz, DMSO-d6)δ: 175.8(C-28), 138.4(C-13), 127.2(C-12), 94.3(Glc-1′), 82.5(C-3), 77.8(Glc-5′), 76.9(Glc-3′), 72.5(Glc-2′), 71.9(C-19), 69.7(Glc-4′), 67.4(C-2), 60.8(Glc-6′), 55.0(C-5), 53.4(C-18), 47.5(C-17), 47.3(C-1), 46.9(C-9), 41.4(C-20), 41.3(C-14), 40.2(C-8), 39.1(C-4), 37.7(C-10), 36.8(C-22), 32.7(C-7), 29.0(C-23), 28.2(C-15), 26.6(C-29), 26.0(C-21), 25.3(C-16), 24.0(C-27), 23.5(C-11), 18.3(C-6), 17.3(C-24), 16.6(C-25), 16.7(C-26), 16.4(C-30)。以上数据与文献数据[6]基本一致,故鉴定化合物3为 2α,3β,19α-三羟基乌苏-12-烯-28-O-β-D-吡喃葡萄糖苷。
化合物4淡黄色无定形粉末,ESI-MS中给出准分子离子峰m/z689.40 [M+Na]+。13C-NMR(150 MHz, DMSO-d6)上可见36 个碳信号,结合1H-NMR、13C-NMR及相对分子质量推出分子式为C36H58O10,不饱和度为8。1H-NMR(600 MHz, DMSO-d6)δ: 5.17(1H, t,J=3.0 Hz, H-12), 5.14(1H, t,J=8.0 Hz, H-1′), 3.70(1H, m, H-2), 3.41(1H, d,J=2.4Hz, H-3), 1.26(3H, m, CH3-27), 1.08(3H, s, CH3-29), 0.91(3H, s, CH3-23), 0.89(3H, s, CH3-25), 0.84(3H, d,J=7.0 Hz, CH3-30), 0.70(3H, s, CH3-24), 0.66(3H, s, CH3-26)。13C-NMR(150 MHz, DMSO-d6)δ: 175.8(C-28), 138.4(C-13), 127.2(C-12), 94.3(Glc-1′), 77.8(Glc-3′), 76.9(Glc-5′), 76.1(C-3), 72.5(Glc-2′), 71.9(C-19), 69.7(Glc-4′), 69.4(C-23), 64.9(C-2), 60.9(Glc-6′), 53.4(C-18), 47.5(C-17), 46.8(C-9), 43.5(C-5), 42.7(C-4), 41.8(C-1), 41.4(C-8, C-20, C-14), 37.8(C-10), 36.8(C-22), 32.4(C-7), 28.2(C-15), 26.6(C-29), 26.0(C-21), 25.3(C-16), 24.2(C-27), 23.4(C-11), 17.7(C-6), 17.0(C-26), 16.7(C-24, C-25), 16.4(C-30)。经与文献数据[7]比对,鉴定化合物4为苦莓苷F1。
化合物5白色无定形粉末,ESI-MS中给出准分子离子峰m/z671.39 [M+Na]+。13C-NMR(150 MHz, DMSO-d6) 上可见36 个碳信号,结合1H-NMR、13C-NMR及相对分子质量推出分子式为C36H56O10, 不饱和度为9。1H-NMR(600 MHz, DMSO-d6)δ: 5.26(1H, t,J=4.2 Hz, H-12), 5.24(1H, d,J=8.4 Hz, H-1′), 3.49(1H, m, H-2), 3.17(1H, m, H-3), 1.70(1H, s, H-29), 1.03(3H, s, CH3-30), 1.00(3H, s, CH3-26), 0.89(3H, s, CH3-27), 0.77(3H, s, CH3-25), 0.54(3H, s, CH3-24)。13C-NMR(150 MHz, DMSO-d6)δ: 173.6(C-28), 138.1(C-13), 135.3(C-19), 133.0(C-18), 125.6(C-12), 94.3(Glc-1′), 77.8(C-3), 76.9(Glc-3′), 75.8(Glc-5′), 72.7(Glc-2′), 69.8(Glc-4′), 67.7(C-2), 64.2(C-23), 61.0(Glc-6′), 49.0(C-17), 47.7(C-5), 47.5(C-9), 46.5(C-20), 44.4(C-14), 42.7(C-4), 38.8(C-8), 37.4(C-10), 34.5(C-1), 34.0(C-16), 33.9(C-7), 30.1(C-22), 28.1(C-11), 26.2(C-21), 23.1(C-15), 21.9(C-27), 19.3(C-29), 18.7(C-30), 18.0(C-26), 17.8(C-25), 17.5(C-6), 14.1(C-24)。以上数据与文献数据[8]基本一致,故化合物5鉴定为2α,3β,23-三羟基乌苏-12,18-二烯-28-O-β-D-吡喃葡萄糖苷,为首次从蔷薇属植物中分离得到。
化合物6黄色无定形粉末,分子式为C22H22O12。1H-NMR(600 MHz, methanol-d4)δ: 7.70(1H, s, H-2′), 7.56(1H, d,J=8.4 Hz, H-6′), 6.85(1H, d,J=8.4 Hz, H-5′), 6.36(1H, s, H-8), 6.17(1H, s, H-6), 5.22(1H, d,J=7.8 Hz, Glc-1′), 3.36(1H, d,J=9Hz, H-4′), 3.34(3H, s, Glc-OCH3-4′)。13C-NMR (150MHz, DMSO-d6)δ: 179.4(C-4), 166.3(C-7), 162.9(C-5), 159.0(C-2), 158.5(C-9), 149.9(C-4′), 145.9(C-3′), 135.6(C-3), 123.2(C-6′), 123.1(C-1′), 117.6(C-2′), 116.0(C-5′), 105.6(C-10), 104.4(Glc-1′), 100.0(C-6), 94.8(C-8), 78.3(Glc-5′), 78.1(Glc-3′), 75.7(Glc-2′), 71.2(Glc-4′), 62.6(Glc-6′), 49.9(Glc-4′-OCH3)。以上数据与文献[9]基本一致,故鉴定化合物6为5,7,3′,4′-四羟基-4′′-O-甲基-3-O-β-D-葡萄糖黄酮苷,化合物6为该首次从蔷薇属植物中分离得到。
化合物7黄色无定形粉末,分子式为C27H30O16。1H-NMR(600 MHz, methanol-d4)δ: 7.66(1H, d,J=2.4 Hz, H-2′), 7.61(1H, dd,J=2.4, 8.4 Hz, H-6′), 6.86(1H, d,J=8.4 Hz, H-5′), 6.40(1H, d,J=2.4 Hz, H-6), 6.40(1H, d,J=2.4 Hz, H-8), 5.10(1H, d,J=7.8 Hz, Glc-1′), 4.51(1H, d,J=1.6 Hz, Rha-1′), 3.79(1H, dd,J=3.7, 10.8 Hz, Glc-6′), 3.40(1H, dd,J=3.0, 10.5 Hz, Glc-6′), 1.16(3H, d,J=6.0 Hz, Rha-6′)。13C-NMR(150 MHz, DMSO-d6)δ: 179.4(C-4), 166.1(C-7), 163.0(C-5), 159.3(C-9), 158.5(C-2), 149.8(C-4′), 145.8(C-3′), 135.6(C-3), 123.6(C-1′), 123.1(C-6′), 117.7(C-5′), 116.1(C-2′), 105.6(C-10), 100.0(C-6), 104.7(Glc-1′), 102.4(Rha-1′), 94.9(C-8), 78.2(Glc-3′), 77.2(Glc-5′), 75.7(Glc-2′), 73.9(Glc-4′), 72.2(Rha-3′), 72.1(Rha-2′), 71.4(Rha-4′), 69.7(Rha-5′), 68.6(Glc-6′), 17.9(Rha-6′)。以上数据与文献数据[10]基本一致,故鉴定化合物7为芦丁。
化合物8黄色无定形粉末,ESI-MS中给出准分子离子峰m/z487.06 [M+Na]+,分子式为C21H20O12。1H-NMR(600 MHz, methanol-d4)δ:7.70(1H, s,J=1.8 Hz, H-2′), 7.58(1H, dd,J=2.4, 8.4 Hz, H-6′), 6.85(1H, d,J=8.4 Hz, H-5′), 6.38(1H, s, H-8), 6.19(1H, s,J=2.4 Hz, H-6), 5.24(1H, d,J=7.2 Hz,Glc-1′)。13C-NMR(150 MHz, DMSO-d6)δ: 177.5(C-4), 164.5(C-7), 161.1(C-5), 157.0(C-2), 156.6(C-9), 147.9(C-4′), 144.0(C-3′), 133.7(C-3), 121.3(C-6′), 121.2(C-1′), 115.6(C-2′), 114.1(C-5′), 103.7(C-10), 102.4(C-6), 98.1(C-8), 92.9(Glc-1′), 78.3(Glc-5′), 78.1(Glc-3′), 75.7(Glc-2′), 71.2(Glc-4′), 62.6(Glc-6′)。以上数据与文献数据[11]基本一致,故鉴定化合物8为槲皮苷。
化合物9淡黄色无定形粉末,ESI-MS中给出准分子离子峰m/z545.21 [M+Na]+,分子式为C26H34O11。13C-NMR(150 MHz, DMSO-d6)δ: 147.4(C-3), 145.7(C-3′), 144.3(C-4), 144.2(C-4′), 137.1(C-1), 132.9(C-6′), 127.2(C-1′), 121.2(C-6), 116.5(C-5′), 115.7(C-5), 114.1(C-2), 112.0(C-2′), 104.3(Glc-1′), 77.0(Glc-3′), 76.9(Glc-5′), 73.8(Glc-2′), 70.3(Glc-4′), 67.8(C-9), 63.0(C-9′), 61.3(Glc-6′), 55.8(3-OCH3), 55.7(3′-OCH3), 45.7(C-7), 44.3(C-8), 37.7(C-8′), 32.7(C-7′)。以上数据与文献数据[12]基本一致,故鉴定化合物9为异落叶松脂素-9-O-β-D-葡萄糖苷。
4 抗炎活性测试
用LPS法刺激NF-κB-293细胞模型检测化合物1、2、3、4、5、6、8对荧光素酶表达的抑制作用。从液氮罐中快速取出冻存的 P5 代抗炎药物筛选工具细胞株(NF-κB-luc 293 Cell Line)1支,待细胞复苏后,取对数生长期P6代细胞,用胰酶消化制备细胞悬液,苔芬兰染色,血小球计数板计数,完成细胞接种后培养24 h,对细胞进行换液,使用含体积分数10% FBS的DMEM完全培养基;用DMSO溶解化合物,按照1 、10 、100、200 μg·mL-1的质量浓度添加到培养基,37 ℃和5% CO2条件下培养细胞4 h后加入LPS(终质量浓度为1 μg·mL-1),正常条件培养细胞48 h,采用荧光素酶活性检测。实验结果见图2,由图 2 可知化合物5对由LPS引起的NF-κB-293细胞中荧光素酶的表达能够发挥明显抑制作用,且呈剂量依赖关系。
用ELISA法检测化合物1、5、8对LPS刺激的RAW264.7W细胞上清液中炎症因子 IL-1β、TNF-α和IL-10的抑制作用,结果见表1。化合物1在质量浓度分别为30、300 μg·mL-1时分别对炎症因子IL-1β和TNF-α有明显的抑制作用;化合物5对炎症因子IL-1β、TNF-α的抑制作用强于IL-10,但是平均质量浓度却高于对照组,有待更深入的研究;化合物8对3种炎症因子均有强烈的抑制作用,且呈一定的剂量依赖性。

图2 化合物抗炎活性筛选结果
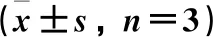
表1 化合物对炎症因子IL-1β、TNF-α 和 IL-10的抑制作用
5 讨论
在民间,金樱叶被广泛用作治疗烧烫伤的草药,但迄今为止,对金樱叶的化学成分研究的报道并不多[13-17]。为了进一步探讨其活性成分,本研究运用色谱分离技术,从金樱叶的体积分数为75%乙醇提取物中共分离鉴定了9个化合物,化合物2、3、6、9为首次从蔷薇属植物中分离得到。对化合物进行体外抗炎及ELISA法活性筛选,结果表明,化合物1、5、8能够不同程度地抑制炎症因子 IL-1β、TNF-α和 IL-10的释放。本研究为进一步阐明金樱叶的有效成分和作用机制奠定了基础。

