胰腺癌T分期的MDCT评估与病理对照研究*
曹营营 郭 凯 任 帅 张雅平 张惠峰 王中秋
南京中医药大学附属医院放射科(江苏 南京 210029)
胰腺癌是一种侵袭性消化系统恶性肿瘤,起病隐匿,早期诊断困难,5年生存率约10%[1]。在中国,胰腺癌的发病率逐年上升,其致死率在全人群癌症相关死亡中排名第七位[2]。目前,手术是胰腺癌最重要的治疗手段,而术前准确分期对胰腺癌患者手术方案的指导及预后评估具有重要意义[3-4]。近期颁布的AJCC第8版胰腺癌TNM分期对第7版进行了修订,尤其对T分期进行了显著更新[5]。新标准采用肿块最大径区分T1~T3期;取消了旧版T4期中“肿瘤不可切除”的描述,而采用肿瘤与腹腔干、肠系膜上动脉及肝总动脉位置的评价,使得T分期的描述更加客观。MDCT是胰腺癌诊断的首选检查方式[6]。然而当肿瘤与正常胰腺实质密度相近时,影像对肿块大小的测量可能存在一定程度的误判,影响接下来手术方案的选择[7]。目前,对胰腺癌肿块大小及T分期的CT评估价值研究尚少[8-9]。因此,本研究基于MDCT图像与手术探查及病理情况,对照AJCC第8版胰腺癌T分期,对肿块长径及血管侵犯情况分别进行探讨。
1 资料与方法
1.1 一般资料回顾性搜集我院从2019年4月至2020年12月期间经病理证实的110例胰腺癌患者资料。
纳入标准:新发未经治疗的、经病理学明确的胰腺癌患者;术前MDCT检查资料全面且在术前3周内行MDCT检查的胰腺癌患者;排除标准如下:入组前接受新辅助治疗者;手术探查发现已有肿瘤远处转移,而未行血管探查的患者。最终收集103例胰腺癌患者资料。
1.2 检查方法所有患者均于术前3周内行CT平扫及动态增强检查。采用Philips Brilliance 64排128层螺旋CT扫描。扫描范围:覆盖胸部至骨盆,以便进行完整分期;扫描参数:管电流 240~300mAs,管电压 120kV,螺距0.8,层厚3.0mm,重建间隔1.25mm。在CT平扫后,以3.0mL/s速率静脉注射对比剂碘海醇。扫描时间设为动脉期20~30s,胰腺期40~50s,门脉期60~80s。
1.3 图像分析与评价标准动态增强扫描的原始图像均进行容积再现(VR)、最大密度投影(MIP)、多平面重组(MPR)以及曲面重组(CPR)等后处理技术。所得图像分别由两名有经验的腹部放射学医师盲法独立阅片,若意见不同经协商后达成一致。术前影像T分期评估参照美国癌症研究联合会(American Joint Committee on Cancer,AJCC)第八版分期[7]:肿瘤局限于胰腺,长径≦2cm为T1期;2<长径≦4cm为T2期;长径>4cm为T3期;当肿瘤侵犯腔干(CA)、肠系膜上动脉(SMA)及肝总动脉(CHA)时,不论肿瘤大小均为T4期。并依据2020年美国国立综合癌症网络(national comprehensive cancer network,NCCN)[2]发布的胰腺癌放射影像学报告模板对肿块进行分析。(1)肿瘤的长径:由阅片者3次测量轴位图最大距离取平均值获得;(2)肿瘤的位置:胰头/钩突部位的肿瘤即位于肠系膜上静脉(SMV)右侧,胰体/尾部肿瘤即位于肠系膜上静脉(SMV)左侧;(3)胆胰管的截断扩张情况[10]:胆总管管径>10mm,主胰管直径最宽处>3mm;(4)胰腺萎缩[11]:胰腺实质的最大宽度<2cm;(5)胰周血管:本研究主要探讨腹腔干(CA)、肠系膜上动脉(SMA)及肝总动脉(CHA),并依据指南中对肿瘤可切除性标准,对肿瘤与血管周径的接触面进行分级;0级,肿瘤与以上三支血管无接触;1级,肿瘤与血管周径接触面≦180°;2级,肿瘤与血管周径接触面>180°。最终将MDCT对T分期及肿块与血管周径接触面程度的评估结果与病理进行对照分析。手术对血管侵犯程度分级标准:0级,肿瘤与血管无接触;1级,肿瘤与血管有接触,但可分离;2级,肿瘤与受侵血管无法分离。
1.4 统计学分析采用SPSS 23.0软件进行统计学分析,计量资料以均值±标准差表示。T分期影像与手术病理结果之间的比较采用kappa检验,k值在0.8~1.0之间时,两组结果一致性为很好;k值在0.61~0.8之间时,两组结果一致性较好;k值在0.41~0.6之间时,两组结果一致性中等;k值在0.21~0.4之间时,一致性一般;k值在0~0.2之间时,两组结果一致性较差。CT与术后标本对肿瘤长径的比较采用Pearson相关性分析和Bland-Altman散点图。胰周血管接触面评估与手术结果的比较采用Spearman相关性分析,P<0.05认为有统计学意义。
2 结果
2.1 临床及病理资料103例胰腺癌患者中,男59例,女44例;平均年龄62岁。位于胰头颈/钩突癌67例(66.0%),胰体/尾癌36例(34.0%);94例行根治性手术(61例行胰十二指肠切除术,29例行胰体尾切除术,4例行全胰切除术)(见图2),包括Ⅰ期患者17例,Ⅱ期37例,Ⅲ期40例。另有9例行姑息性手术,由细针穿刺获取病理结果(见图3)。

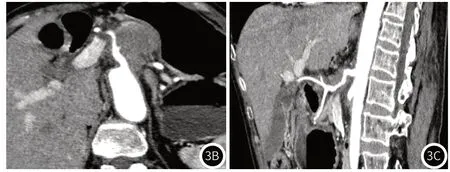
图2 图2A:胰体部低密度肿块,长径约3.2cm,边界不清;图2B:CPR示肿块与腹腔干、肝总动脉间有清晰的脂肪间隙;图2C:肠系膜上动脉未受侵犯。影像评估为T2期,术后病理为中分化导管腺癌(T2N0M0)。图3 图3A:VR示胰体部肿块,长径约3.3cm;图3B:CPR示肿块紧贴腹腔干,接触面小于180度;图3C:CPR示肿块包绕肝总动脉,接触面>180度。影像评估为T4期肿块,手术证实肿瘤与肝总动脉、腹腔干不可分离,患者行姑息性手术。
2.2 影像资料分析103例患者中:67例位于胰头颈/钩突,长径约2.9±1.2cm,36例位于胰体/尾,长径约3.2±1.0cm;70例肿块呈类圆形,33例呈分叶状或不规则;40例伴胰腺萎缩;37例伴胆总管扩张;62例伴胰管扩张。
2.3 CT及术后病理对T分期评估结果94例行根治性手术患者术后切除病理示,T1期16例,T2期35例,T3期32例,T4期11例;CT评估肿瘤T1期18例,T2期31例,T3期33例,T4期12例。94例患者术前CT与术后病理T分期的评估一致性较好(k=0.774,P<0.05),总诊断准确率为86.2% (81/94),见表1。其中CT对T1~4分期诊断准确率分别为83.3%、87.1%、84.8%、91.7%。
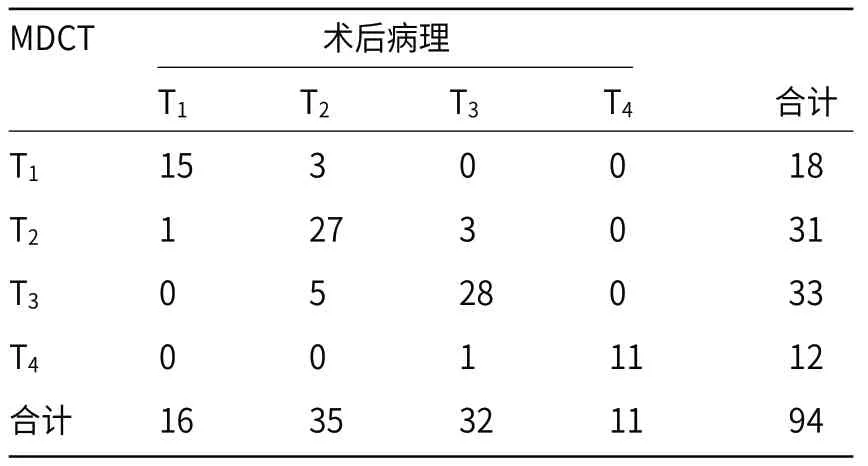
表1 94例胰腺癌患者T分期CT评估与术后病理对照分析
2.4 CT与术后标本对肿瘤长径分析Pearson相关性分析结果示:94例行根治性手术患者中,62例肿块位于胰头颈部/钩突,CT测量肿块长径为(2.9±1.2)cm,较术后病理标本测量具有相关性(r=0.933,P<0.05);32例位于胰体/尾,CT测量肿块长径为(3.2±1.0)cm,较术后病理标本测量具有相关性(r=0.892,P<0.05)。94例肿块CT测量平均长径为(3.1±1.1)cm,整体与手术标本测量值也具有很好的相关性(r=0.882,P<0.05),见表2。Bland-Altman图法结果示:线外点为6.4% (6/94);CT相较于大体标本测量值存在一定程度的低估,偏差为0.24cm (P>0.05),95%一致性区间为(-0.74~1.2),见图1。

表2 94例根治性胰腺癌患者CT与术后标本对肿瘤长径相关性分析

图1 MDCT与术后标本对肿瘤长径测量值的Bland-Altman图。每个点代表单个肿块的长径测量结果。图表中的水平线从高到低依次为95%可信区间(CI)的上限,差值的均数和95%CI的下限。
2.5 CT对肿瘤血管周径接触面评估与手术分级结果对照分析103例患者术中共探查297支血管。其中,94例患者行根治性手术,共探查282支血管;9例行姑息性手术,共探查15支血管。两名阅片者对肿瘤与血管接触面统一意见结果为0级有268支,1级有21支,2级有8支。腹腔干0级86支,1级9支,2级3支;肠系膜上动脉 0级95支,1级3支,2级3支;肝总动脉0级87支,1级9支,2级2支。影像对肿瘤血管周径接触面评价结果与手术探查结果总体呈正相关(r=0.888,P<0.05),对以上三支动脉(CA、SMA、CHA)也分别呈正相关(r=0.861、1.000、0.846,P<0.05),对三支血管的评估准确率为97.3%,其中对肠系膜上动脉的准确率最高,为100.0%,见表3。
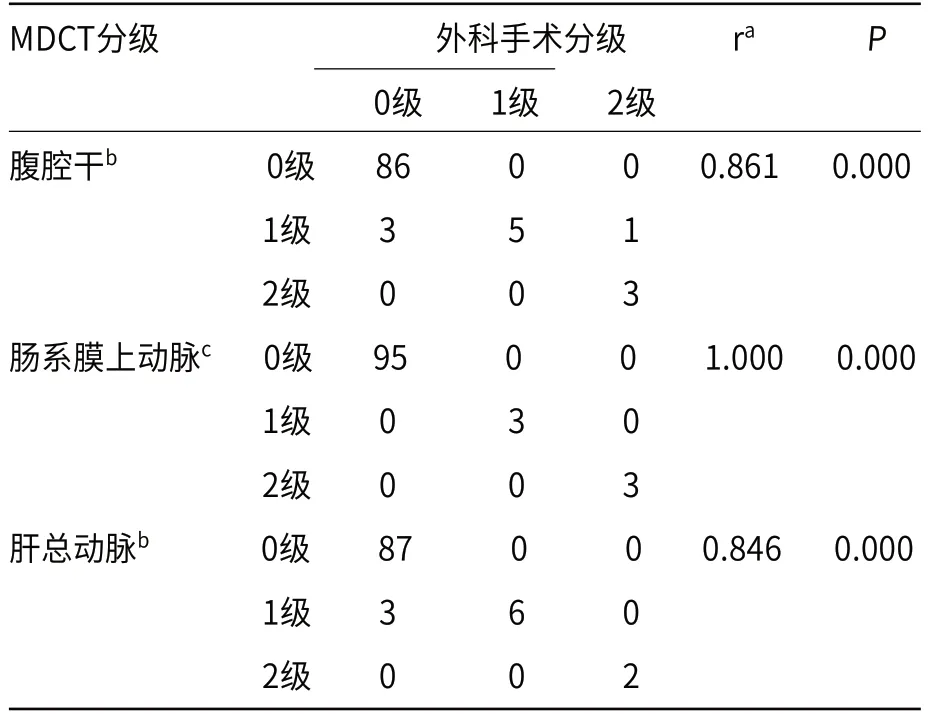
表3 103例胰腺癌肿瘤血管周径接触面分级的CT与外科手术结果相关性分析(支)
3 讨论
目前,MDCT为胰腺癌诊断、术前分期的首选检查方式[12]。最新颁布的AJCC第八版胰腺癌TNM分期对T分期进行了较大的修订[7]。Shi等[4]多中心研究结果表明,不同T分期对应的中位生存期差异具有统计学意义。因此,T分期的准确划分对患者的术前分期及预后评估具有重要意义。
本研究结果示,CT对胰腺癌T分期评估与手术病理评估的一致性较好,T分期诊断准确率为86.2%,其中,T4期诊断准确率最高。在不伴有血管侵犯时,CT对T1、T3分期的评估准确率较T2低(83.3% vs 87.1%,84.8% vs87.1%)。原因可能是长径<2cm的小胰腺癌多不改变胰腺的轮廓,间接征象也不明显,有时甚至表现为等密度肿块,因此在CT图像上难以准确识别肿瘤边界;而T3期的肿块长径>4cm,有研究表明[13-14],较大的肿块周围更易伴发炎症,与周围组织边界模糊,CT图像同样难以明确肿瘤边界。94例行根治性手术患者中,影像测得的肿块长径平均值小于大体病理最大径2.4mm。本研究的CT低估值低于Ari[15]等人的研究结果(4mm),分析其原因可能为测量方法不同,Ari等人使用的是CT图像上任意方位对肿块进行最大径的测量,而本研究使用的是对CT轴位面进行最大径测量。但总体而言,CT对肿块长径的测量与术后标本测量值有很好的相关性(r=0.882,P<0.05)。
2020年NCCN发布的胰腺癌手术标准指南指出[2,16],在无远处转移的情况下,评估肿瘤是否可切除的主要因素为血管侵犯程度。肿瘤与SMA、CA或CHA接触面>180°时,即为局部晚期,属于不可切除范畴。因此,胰周动脉受侵程度的术前判断尤为关键。目前,CT是评价胰腺癌周围血管侵犯程度的首选检查方式[17-19]。本研究结果显示,CT对T4分期与手术病理结果的评估一致性很好。
由于目前影像学对血管侵犯程度的评价标准尚未统一,因此本研究依据NCCN指南中对胰腺癌可切除性标准,进一步将肿瘤血管接触面进行分级评估。结果显示,CT对CA、SMA及CHA的三级评价与手术分级结果具有较好的相关性,诊断符合率为91.7%,其中对SMA的评估准确率最高(100.0%)。本文认为这可能与SMA在CT横断面上相对于胰腺的解剖位置有关:SMA走形于胰体前方,有较多脂肪衬托,血管形态的改变易于在影像上判读;而CHA、CA位于胰头后方,与胰腺外侧的十二指肠降段及下腔静脉关系密切,且缺乏脂肪背景衬托而相对容易误判。本组中6例PDAC血管侵犯程度在CT图像上高估,其原因可能为血管周围存在肿瘤炎性浸润,在CT上误判为肿瘤成分而出现假阳性;此外,还有1例PDAC患者存在术前CT血管侵犯低估,分析原因可能为肿瘤与血管脂肪间隙消失,边界模糊,CT分辨率不足以显示血管周围浸润。
本研究主要不足是样本量较少,且为回顾性研究,因此有待于进一步大样本积累病例,进行大数据前瞻性验证研究;另外,标本取样过程中经过福尔马林处理后,组织会有一定程度的收缩,而收缩程度在目前的研究中尚未达到共识。本研究将后续对入组患者的预后及生存随访,对胰腺癌患者的可切除性及预后进一步研究。
综上所述,与手术探查及术后病理结果相比,MDCT检查对胰腺癌肿瘤大小的测量及周围血管侵犯的术前评估价值较高,可较为准确地评估胰腺癌T分期,为后续临床实践活动提供了有力参考。

