铁死亡在急性肺损伤中的研究进展
周思江,宁宗
细胞程序性死亡(programmed cell death,PCD)指由基因决定的细胞主动的有序的死亡方式,普遍存在于生物体的生长、发育过程中,在维持生物体稳态方面发挥了不可替代的作用。PCD包括凋亡(apoptosis)、自噬(autophagy)、坏死性凋亡(necroptosis)、焦亡(pyroptosis)和铁死亡(ferroptosis)等数种方式[1]。铁死亡有别于一般的PCD,其细胞受铁离子影响,在细胞核完整的情况下,线粒体嵴减少,线粒体膜的双侧膜密度改变,线粒体外膜破裂,导致高尔基体、内质网和溶酶体被过氧化等[2],并最终诱导细胞死亡。急性肺损伤(ALI)是由各种肺内和肺外致病因素引发的肺部损伤的急性发作,可造成弥漫性肺间质及肺泡水肿并导致急性低氧性呼吸功能不全[3]。近年来,更多研究证实铁死亡与ALI的发生密切相关。本文总结了既往有关铁死亡的作用机制及其在ALI发病机制中的研究成果,认为铁死亡可作为ALI的预防、诊断和治疗的靶标,在ALI的治疗中展现出巨大前景。
1 本文文献检索策略
以“Ferroptosis”“Acute Lung Injury”为英文关键词检索PubMed、Medline、Web of Science;以“铁死亡”“急性肺损伤”为中文关键词检索中国知网、维普网、中国生物医学文献服务系统、万方数据知识服务平台。检索时间为建库至2021年8月。文献纳入标准:(1)铁死亡与ALI的临床研究;(2)基础研究及文献研究。文献排除标准:(1)与研究问题无关、重复发表、无法找到全文信息的文献;(2)质量差的文献。根据纳入标准与排除标准,最终纳入相关文献45篇。
2 概述
2.1 铁死亡的发现 DOLMA等[4]于2003年首次发现了在DNA未断裂、不改变细胞核的形态及含半胱氨酸的天冬氨酸蛋白水解酶(Caspase3)未活化的情况下诱导细胞发生非凋亡性细胞死亡的铁死亡激动剂(Erastin)。MOU等[5]于2008年进一步研究发现了激活非凋亡性细胞死亡的两种化合物RSL3和RSL5,并发现了铁螯合剂可以拮抗该非凋亡性细胞死亡的发生。DIXON等[2]2012年的研究表明,部分细胞的死亡原因与铁离子浓度有关,并首次将这种新型非凋亡性细胞死亡方式命名为“铁死亡”。此后,铁死亡的概念逐渐被国内外学者知晓。2018年,细胞死亡命名委员会将铁死亡定义为PCD模式中的一种[6]。
2.2 铁死亡的作用机制 在铁离子的作用下,细胞内发生脂质过氧化物堆积的现象是铁死亡的特点之一,其可能与磷脂氢过氧化物(PLOOHs)有关。PLOOHs是脂质过氧化的主要产物,细胞膜中存在过量的PLOOHs会损害细胞功能。有研究表明,PLOOHs是诱发细胞铁死亡的关键因素,因此PLOOHs的前体多不饱和脂肪酸的合成和活化、代谢产物活性氧及调节细胞代谢的铁离子成为影响铁死亡进程的关键点[7]。铁死亡的作用机制概括见图1。
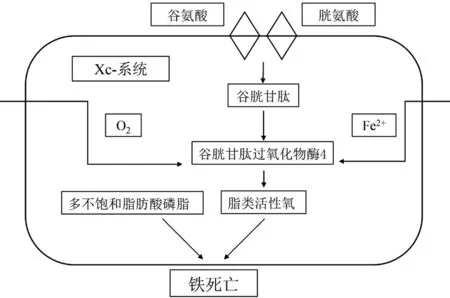
图1 铁死亡的作用机制Figure 1 The mechanism of ferroptosis
2.3 铁死亡的调控机制 近年来,学者们对铁死亡调节机制的研究取得了快速的进展。目前已验证了谷胱甘肽过氧化物酶4(GPX4)、核因子E2相关因子2(Nrf2)、Xc-系统等是铁死亡的重要调节因子。GPX4将细胞内脂质过氧化氢转化为脂质醇,促进过氧化氢(H2O2)的分解,修复脂质细胞的氧化损伤,保护细胞膜不受氧化损伤,其失活将导致细胞内脂质过氧化物的堆积和铁死亡[8]。Nrf2通过调节抗炎性、铁稳态和脂质过氧化在铁死亡中起着非常重要的作用[9]。Xc-系统通过转运细胞内谷氨酸盐与细胞外胱氨酸交换后合成谷胱甘肽(GSH),清除细胞内的自由基,抑制系统Xc-可导致细胞内GSH水平快速下降和铁死亡[10]。学者们研究证实了多种化合物可以诱导和抑制铁死亡,具体见表1[11-36]。以上研究揭示了铁死亡的发生和发展受多种细胞组分和细胞内信号通路的调节,丰富了对铁死亡发生和发展的认识,并且验证了调控铁死亡发生发展的激动剂和拮抗剂,为临床上通过应用药物调控铁死亡治疗疾病提供了思路。

表1 铁死亡的激动剂和拮抗剂及其调节机制Table 1 Agonists and Antagonists of Ferroptosis and their Regulatory Mechanisms
3 铁死亡和ALI的关系
ALI指由于各种肺内和肺外致病因素引起的肺泡上皮细胞及毛细血管内皮细胞损伤,导致弥漫性肺间质及肺泡水肿,造成急性低氧性呼吸功能不全[3]。ALI的死亡率高达40%,是危害人类生命健康的一项重大疾病。随着研究的深入,更多证据表明铁死亡参与了ALI的发病。ALI的发病机制非常复杂,目前被认为与炎症、氧化应激等细胞学机制相关,但尚无有效的靶向治疗措施。近几年,学者们通过动物及细胞模型实验,确认了铁死亡与缺血再灌注、脓毒血症、放射线、淹溺以及油酸等引起的ALI有关。
3.1 肺缺血再灌注损伤与铁死亡 近年研究发现,铁死亡是缺血性损伤的主要驱动因素。铁死亡已被证实参与心肌、肾脏、肝脏、肠道和大脑的缺血再灌注损伤的动物模型或细胞模型。在肠道缺血再灌注诱导的ALI小鼠模型中,实验发现铁死亡依赖于Nrf2信号参与肠道缺血再灌注诱导的ALI的发生。进一步研究表明,p53凋亡刺激蛋白抑制剂(iASPP)可以通过Nrf2/缺氧诱导因子1(HIF-1α)/防止形成ROS的铁转运器(antitransferrin,TF)信号通路减轻肠道缺血再灌注诱导的ALI和铁死亡[37]。另一项研究通过建立动物模型和细胞模型试验,观察铁含量、丙二醛 (MDA)和GSH水平、线粒体形态和铁死亡相关蛋白表达的变化情况,评估铁死亡在不同再灌注持续时间中的参与程度[38]。该研究证实了通过抑制铁死亡和酰基辅酶A合成酶长链家族成员4(ACSL4)可以减少脂质过氧化和增加GSH和 GPX4 水平来减轻缺血再灌注诱导的肺损伤中的铁死亡损伤。
作为一种新发现的细胞死亡方式,铁死亡被证明在ALI的发病机制中起到了越发重要的作用。肺缺血再灌注损伤是一种复杂的疾病过程,近年来学者们即使对肺缺血再灌注损伤进行了大量的研究,但对其认识仍处于早期阶段,因此深入探讨铁死亡在肺缺血再灌注损伤的作用机制十分必要。铁死亡抑制剂目前仅用于实验,动物实验已证实其具有一定的肺保护作用,但铁死亡抑制剂尚未应用于临床,具体调控机制还需进一步研究。因此未来研究的重点应是更好地了解肺缺血再灌注损伤的机制,以确定更精准的治疗靶点,并将有效的治疗方法应用推广于临床。
3.2 脓毒血症相关肺损伤与铁死亡 脓毒血症是由病原体感染诱发的全身炎症反应综合征,其可造成机体的多脏器机能障碍,临床上最常见为呼吸系统障碍,易发展为ALI。在通过盲肠结扎术诱导脓毒血症引起的ALI小鼠模型中,铁死亡标志物GPX4的表达降低,而MDA和铁离子水平升高[39]。利用脂多糖建立的脓毒血症ALI模型发现,铁死亡可能通过 Nrf2/ARE 信号通路参与诱发ALI[40];另有实验证明Kelch 样环氧丙氯烷 关联蛋白-1(Keap1)- Nrf2/血红素氧合酶1(HO-1)通路在脓毒血症ALI的发病机制中起保护作用,西洋参酚可通过激活Nrf2促进HO-1表达来改善脓毒症ALI[9]。脓毒血症相关的ALI中,肺组织表现出脂质体过氧化反应,并且MDA活性增加,铁含量增加,并且抗氧化物成分中的GPX4和GSH活性降低。以上实验均提示铁死亡参与了脓毒血症相关肺损伤的形成,但具体的机制还有待更进一步的研究。
3.3 放射性肺损伤与铁死亡 放射线治疗是恶性肿瘤综合治疗的重要手段之一,放射线损伤通常由恶性肿瘤放射治疗、骨髓移植预处理及辐射事故导致,放射线引起的ALI是肺癌、食管癌等胸部肿瘤放射线治疗后常见的并发症。目前已确认铁死亡在放射线引起的ALI中发挥了重要作用。在射线诱导ALI的小鼠模型中发现细胞内GPX4表达水平下降,活性氧(ROS)的含量增加,给予铁死亡抑制剂Lip-1处理后GPX4的表达水平明显增加,ROS表达明显下调[41]。另有研究发现,铁死亡抑制剂Fer-1可通过抑制脂质过氧化和增强GPX4的表达来抑制射线引起ALI和铁死亡,而铁死亡诱导剂Erastin则通过增加脂质过氧化和抑制GPX4的表达,促进成纤维细胞向肌成纤维细胞的分化[42]。此外,多种细胞因子的级联效应也在射线引起的ALI的铁死亡中发挥了重要作用。研究表明,转录生长因子β1(TGF-β1)在射线引起的ALI起到了促进作用,并和活性氧相互激发形成类似协同作用的循环,造成损伤加重,而Nrf2可以通过降低TGF-β1的表达和抑制铁离子的吸收减轻射线引起的ALI和铁死亡的发展[43]。在放射性肺损伤的铁死亡中,关键分子GPX4表达下调,放射线辐射诱导的ROS可能是放射性肺损伤中铁死亡的原始触发因素。研究已表明铁死亡在放射性肺损伤中起着至关重要的作用,铁死亡抑制剂可能是治疗放射性ALI的一种有效方法,为未来减轻ROS损伤、预防及治疗放射性肺损伤开辟了新途径。
3.4 淹溺致ALI与铁死亡 溺水是意外伤害和死亡的主要原因之一,据统计,全世界每年有超过36万人死于溺水。而ALI是溺水常见的并发症之一。在溺水引起的ALI小鼠动物模型中,使用Nrf2特异性激动剂和抑制剂及铁死亡抑制剂进行干预的研究结果表明,Nrf2激活剂增加了细胞的活性,降低了细胞内活性氧和脂质活性氧的水平,并且阻止了GSH耗竭和脂质过氧化物积累,增加了铁蛋白和GPX4的表达。研究结果证实了Nrf2通过维持细胞内氧化还原平衡抑制铁死亡[44]。目前Nrf2已被公认是抗氧化反应的关键调节因子。该研究首次在体内和体外的实验中证明Nrf2可以抑制铁死亡以减轻淹溺导致的ALI。研究结果阐明了淹溺致肺损伤的新机制,并确认Nrf2是治疗ALI的潜在治疗靶点,为ALI的治疗提供新的思路。
3.5 油酸致ALI与铁死亡 铁死亡具有明显的形态特征,不同于其他的细胞死亡类型。现有研究已明确铁死亡的形态特征是线粒体缩小,线粒体膜破裂,线粒体脊减少,线粒体大小减小。在油酸致小鼠ALI的模型中,通过观察发现肺组织中脂质过氧化、铁超载、GSH耗竭和MDA积累等变化,肺组织中GPX4和铁蛋白的蛋白表达水平下调,并发现肺细胞线粒体萎缩,线粒体膜破裂[45]。油酸致ALI小鼠模型中铁死亡的发生提示铁死亡在ALI的发病机制中起着潜在的作用。以上研究尝试探究由油酸诱导的ALI模型中铁死亡的作用机制,阐述了ALI模型中铁死亡的典型改变,为ALI的病理生理学研究提供了新的可能机制,加深了临床对ALI发病机制的认识。然而ALI模型中导致铁死亡的分子信号通路有待阐明,仍需进一步研究。
4 总结与展望
作为新的PCD,铁死亡已被证实在多种系统疾病中发挥重要作用。近年来学者们从肺缺血再灌注损伤、脓毒症相关肺损伤、放射性肺损伤、淹溺及油酸致ALI等细胞或动物模型研究中,证明铁死亡在ALI的发病机制中发挥了不可或缺的作用,GPX4、Nrf2等是ALI中铁死亡发生发展的关键点。铁死亡有望成为治疗ALI的重要靶点,其关键是抑制铁代谢和脂质过氧化。ALI模型与铁死亡的关系见表2。
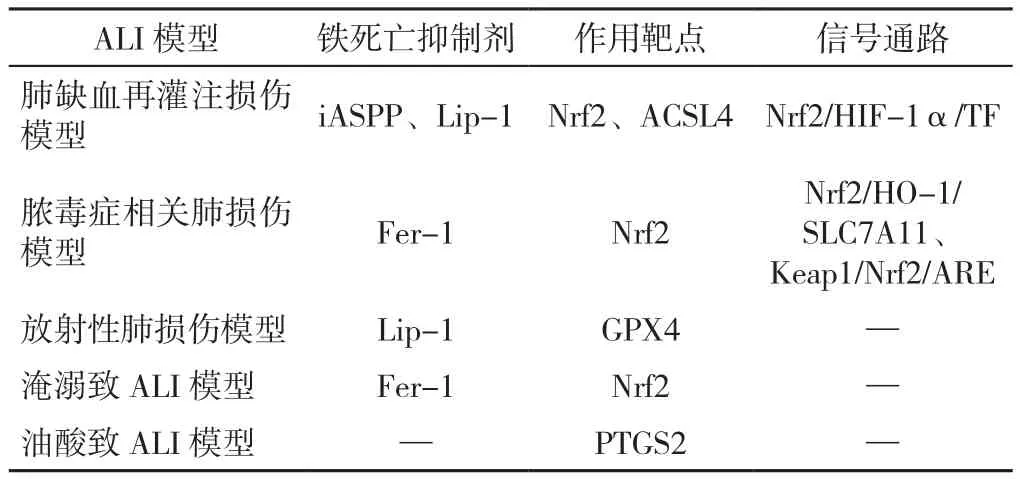
表2 ALI模型与铁死亡的关系Table 2 Relationship between ALI model and ferroptosis
铁死亡相关研究仍存在诸多局限性。关于ALI中铁死亡的具体机制尚未完全阐明,更多详细信号转导途径仍在进一步探索中,并且诸多研究尚停留在细胞、动物水平实验阶段,仍缺少大样本、多中心的临床随机对照研究和证据,还需进行更加全面和深入的研究,进一步探讨铁死亡与ALI的关系,针对不同信号转导途径进行干预治疗ALI是将来探索的方向。
综上所述,铁死亡是诱导ALI发生发展的有效机制,在ALI中起到了至关重要的作用。铁死亡可能成为临床上ALI药物治疗的靶标,为药物在ALI的优化应用开辟新的途径。依托最新技术开展大量的基础和临床研究有助于进一步了解ALI的发生发展,为防治ALI提供更多可靠手段,为临床工作提供更合理、有效的诊疗思路。
作者贡献:周思江提出研究命题,负责论文设计、起草、论文撰写;宁宗对文章整体负责,监督管理。
本文无利益冲突。

