稀土纳米材料在高分辨活体成像及诊疗中的应用
张 钤,刘雅薇,王 帆,刘 凯,,张洪杰,
(1.清华大学化学系,稀土新材料教育部工程研究中心,北京 100084;2.中国科学院长春应用化学研究所,稀土资源利用国家重点实验室,长春 130022)
荧光成像是一类重要的生物成像技术.与X射线计算机断层扫描(CT)、正电子发射断层扫描(PET)、单光子发射计算机断层扫描(SPECT)和磁共振(MR)等成像技术相比,荧光成像具有反馈速度快、灵敏度高、无电离辐射、高时空分辨率等优势[1~4].活体荧光成像作为一种非侵入式手段,在了解生物体结构、监测生命活动以及疾病诊疗等方面具有巨大的应用潜力.然而,通常使用的荧光试剂的激发和发射波长均位于可见光区域,在生物组织中会发生强烈的吸收和散射,对活体组织的穿透能力有限,穿透深度一般小于3 mm,难以用于活体成像.根据瑞利散射公式,波长较大的光受到的散射较小;此外,波长大于1000 nm后,生物组织的自发荧光也显著降低[5].以上两点使得近红外二区(NIR-Ⅱ,1000~1700 nm)生物窗口在活体荧光成像中具有更大的应用潜力.由于水在1450 nm有强烈的吸收,因此以此为界NIR-Ⅱ又被分为NIR-Ⅱa(1000~1400 nm)和NIR-Ⅱb(1500~1700 nm).戴宏杰课题组[6]于2009年用单壁碳纳米管(SWNTs)首次实现了NIR-Ⅱ的活体荧光成像,开拓了NIR-Ⅱ区吸收/发射荧光成像试剂在活体成像领域的应用.
此后,近红外激发和发射的荧光成像试剂成为研究热点,如半导体量子点(QDs)[7]、有机小分子染料[8]、半导体聚合物纳米颗粒(SPNPs)[9,10]、聚集诱导发光(AIE)分子和稀土纳米颗粒(RENPs)等材料.其中,RENPs具有丰富的能级,可以进行近红外激发的上转换(UC)和下转换(DC)发光,且具有大斯托克斯位移、高化学稳定性、长荧光寿命和尖锐的发射光谱,因而成为了一类重要的荧光成像探针.RENPs一般由惰性稀土纳米晶基质掺杂少量的发光稀土离子组成,其中,掺杂的稀土离子一般不止一种,而是由两种或更多的离子构成敏化剂-激活剂体系.稀土上转换纳米颗粒(UCNPs)主要的发射光是Er3+发射的560 nm绿光、660 nm红光以及Tm3+发射的470 nm蓝光、700 nm红光和800 nm近红外光.然而,较强的散射使得这些荧光探针的成像信噪比、灵敏度、分辨率和穿透深度并不理想[11~13].随着生物医学研究的深入,为了获得生物体结构(如血管、神经、器官等)更丰富、更精确的信息,加强对生命活动的理解和监控以及对疾病的诊疗效果,提高分辨率成为了活体荧光成像的重要发展方向.与传统活体荧光成像相比,高分辨荧光成像不仅能对肿瘤之类体积较大的组织或病灶进行成像,还能对脑血管、骨骼、转移肿瘤等体积或宽度较小、传统方法难于分辨的组织或病灶进行高精度的成像,从而大大拓宽荧光成像在诊疗中的应用范围,提高诊疗效率.与其它NIR-Ⅱ荧光成像试剂相比,RENPs拥有大斯托克斯位移、低毒性、高化学稳定性的优势,适用于生物体内的长时程成像,因此极具作为NIR-Ⅱ活体高分辨荧光成像试剂的潜力.近年来,研究者们通过多种手段增强RENPs的DC NIR-Ⅱ发射,有效提高了活体成像分辨率.目前,以RENPs为荧光探针的超分辨成像分辨率已经可以达到20~40 nm[14~16],而在活体成像方面,受限于仪器设备和组织厚度,RENPs目前可达到微米级的成像分辨率,能够在小鼠颅内、腹腔、四肢等位置实现对血管、淋巴、骨骼、肿瘤等组织的清晰成像.在实现高分辨成像的基础上,研究者们采用多种表面修饰策略增强RENPs的生物相容性、实现功能化,并以此为基础开发了一系列具有诊断、传感、治疗等功能的新型成像试剂.本文将综合评述近年来RENPs在高分辨活体成像领域的研究进展及其在医学诊疗中的应用,并对其未来发展方向进行了展望.
1 RENPs的NIR-Ⅱ荧光增强及活体高分辨荧光成像
2013年,Moghe课题组[17]首次用RENPs实现了NIR-Ⅱ活体荧光成像,并以NaYF4∶Yb,Er@NaYF4为例证明了其发射的1525 nm近红外光在血液、肿瘤以及活体小鼠中比550 nm绿光的穿透力和分辨率高,其穿透深度可达毫米级,分辨率可达微米级.2014年,张凡课题组[18]通过多层核壳结构调控优化NaYF4∶Yb,Er纳米颗粒(NPs)的发光性能,并通过Nd3+掺杂实现了穿透力更强、光热损伤更低的808 nm激光激发的1060,1525 nm双模NIR-Ⅱ下转换发光.活体成像结果表明,虽然水对1525 nm光的吸收强于1060 nm光,但更低的散射仍然使1525 nm光的成像穿透深度和检测限优于1060 nm.这说明在活体荧光成像中,散射对成像质量的影响远大于吸收.这两项工作验证了RENPs用于近红外二区活体生物成像的可行性,推动了RENPs在医学领域的发展及应用.下面将介绍不同敏化体系下的RENPs NIR-Ⅱ荧光增强策略及其在高分辨活体荧光成像中的应用.
1.1 Yb3+敏化的RENPs
Yb3+在980 nm有强吸收(2F7/2→2F5/2),且其能级可以很好地与常用的发光离子Er3+,Tm3+,Ho3+等相匹配,所以被广泛用于敏化RENPs[19].Yb3+敏化的上转换发光系统早在1972年就已经被报道[20],如今仍在RENPs中被广泛使用.
通过离子掺杂、核壳结构和基质晶格的设计来增强RENPs的NIR-Ⅱ发光,进而达到更高的分辨率和更好的成像效果是RENPs高分辨活体荧光成像的研究热点[21].2017年,戴宏杰课题组[22]发现Ce3+掺杂可以有效提高NaYbF4∶Er@NaYF4NPs的DC/UC发光强度比例[图1(A)].Ce3+与Er3+之间的交叉弛豫(CR)增大了Er3+的4I13/2能级布居数,削弱了与Yb3+发生共振能量转移达到的4I11/2能级布居数,从而增强了4I13/2→4I15/2的1525 nm DC发射,抑制了4I11/2吸收Yb3+激发态能量而产生的UC发射.在NaYbF4∶2%Er中掺杂2%的Ce3+可使其1525 nm发射强度提高9倍.通过聚(马来酸酐-alt-1-十八烯)(PMH)和氨基聚乙二醇(mPEG-NH2)修饰增强RENPs的亲水性,使其在水溶液中的量子产率(QY)提高至2.73%.用改性后的RENPs进行活体小鼠脑血管成像,可对大脑下静脉(ICV)和浅静脉(SV)分别获得5.3和3.1的信噪比,高于InAs半导体量子点[23],分辨率可达0.3 mm左右.此研究首次实现了以RENPs为成像试剂进行活体高分辨荧光脑成像.在此基础上,他们还报道了掺杂Zn2+的立方相(α相)NaYbF4∶Ce,Er@NaYF4NPs,与此前报道的相同组分的六方相(β相)RENPs相比,1525 nm处的荧光发射增强了11倍[24].通常,α相NaREF4具有较高的声子能,会通过多声子弛豫造成激发态能量损失,因此α-NaREF4的UC发光强度远不如β相[25].然而在α-NaYbF4∶Ce,Er中,α相晶格的高声子能和较强的Ln3+-F-相互作用使得4I11/2通过多声子弛豫转变为4I13/2的强度大大增强.此外,他们还通过Zn2+掺杂引入对称性破缺,进一步增强了稀土离子4f-4f宇称禁阻跃迁,使水溶液QY提高到约5%,并延长了荧光寿命.其高分辨活体脑成像信号可以实现对心跳和呼吸的检测.
郝建华和曾松军课题组[26]制备了聚丙烯酸(PAA)修饰的NaYF4∶Gd,Yb,Er纳米棒.这种纳米棒在水相中的1525 nm的QY为0.994%,高于单壁碳纳米馆(SWNTs),活体小鼠脑部血管成像分辨率可达44μm,该结果已经接近该测试条件下的分辨率极限.此外,他们通过实时追踪荧光信号在体内的分布证实了肿瘤能够通过高通透性和滞留(EPR)效应对纳米棒进行有效摄取,并实现了对直径仅4 mm肿瘤的荧光探测.他们还通过Ce3+掺杂提高了NaLnF4∶Gd,Yb,Er(Ln=Y,Yb,Lu)纳米棒的DC发射,并确定了NaLuF4为最优的纳米晶基质,QY达到3.6%[27],高于此前NaYbF4∶2%Ce,2%Er@NaYF4的2.73%[22].这种荧光纳米棒对肿瘤血管成像分辨率可达41μm,并利用EPR效应实现了对直径3 mm的转移肿瘤的成像诊断[图1(B)].此外,还制备了NaLuF4∶Gd,Yb,Er,Ce@NaYF4@PAANPs并用于活体骨/骨髓成像和骨折的诊断[图1(C)],成像信噪比和分辨率明显优于NIR-Ⅱa发射的Nd3+掺杂RENPs[28].高明远课题组[29]使用了敏化剂-激活剂空间分离的策略,突破了传统RENPs激活剂离子浓度<20%的局限,制备了NaErF4@NaYbF4@NaYF4NPs,敏化剂壳层和惰性壳层大幅增强了NIR-Ⅱ发光,在1525 nm处获得了18.7%的QY.经聚乙二醇(PEG)改性并共价修饰叶酸(FA)后,这种RENPs可以对肿瘤进行选择性成像.在活体腹膜肿瘤成像中,分辨率约0.5 mm.金大勇和袁小聪课题组[30]用CaF2惰性壳层保护NaYbF4∶Ce,Er核的猝灭位点,获得了高达48.6%的固体QY,这是目前为止报道的Er3+发射的NIR-Ⅱb RENPs的最高值.
除了传统的NaREF4,还有其它基质显示了不同寻常的发光特性和应用潜力.刘红荣课题组[31]利用KSc2F7∶Yb,Er NPs在活体小鼠上实现了分辨率达58μm的脑血管成像和50μm的腹部血管成像.与NaYF4基质相比,KSc2F7中的Sc3+具有较小的半径,缩小了晶格中离子间的距离,由于CR强度与离子间距离平方成反比[14],缩小的离子间距增强了Er3+-Er3+间的4F7/2+4I11/2→4F9/2CR,从而使Yb3+-Er3+体系的主要发射波长由NaYF4基质中的541 nm绿光变为650 nm红光.除UC发光外,PAA修饰的KSc2F7∶Yb,Er NPs在水中的1525 nm DC发光强度是NaYF4∶Yb,Er@PAA的1.7倍.此外,这种RENPs的尺寸和形貌可以容易地通过调节F-的加入量来调控,随着F-用量的减少,RENPs的形貌由不均匀的长棒状转变为均匀的短棒状,也显示了其作为一种新型成像和诊疗试剂的潜力.

Fig.1 High-resolution in vivo fluorescence imaging by using Yb3+-sensitized RENPs
1.2 Nd3+敏化的RENPs
Nd3+在808 nm处具有强吸收(4I9/2→4F5/2),Nd3+在4F5/2能级的能量可经由Yb3+传递给Er3+,Tm3+,Ho3+等发光离子,并且Nd3+自身也具有1064 nm(4F3/2→4I11/2)和1345 nm(4F3/2→4I13/2)的NIR-Ⅱ发射.与980 nm相比,808 nm激发体系的核心优势在于生物组织在此波段的吸收小,因而可以提高成像穿透深度,减少光热损伤[32],这一点对于活体高分辨荧光成像十分关键.
Nd3+自身的1064和1345 nm发射可以用于NIR-Ⅱa活体成像.张凡课题组[33]采用DNA和靶向肽修饰的NaGdF4∶Nd@NaGdF4NPs对转移性卵巢癌实施NIR-Ⅱ成像指导切除手术,成像质量优于临床批准的吲哚菁绿(ICG),肿瘤本底比值可达10以上,能对小至1 mm的肿瘤进行精确切除[图2(A)].程震课题组[34]用聚乙二醇化脂质体(DSPE-mPEG)修饰的NaYF4∶Nd@NaYF4NPs对活体小鼠骨骼和血管进行了高分辨荧光成像,其成像分辨率最高可达0.38 mm,并实现了NIR-Ⅱa成像指导的前哨淋巴结活检和血栓诊断[图2(B)].研究发现,虽然1345 nm发射的QY仅为1064 nm发射的一半,但其成像效果优于后者.受这一工作启发,进一步采用二棕榈酰磷脂酰胆碱(DPPC)、胆固醇(Chol)和DSPE-mPEG形成脂质体,对RENPs进行表面修饰及包覆以加速其在体内的排泄[35].修饰后的RENPs在小鼠后肢血管成像中分辨率达0.40 mm,静脉注射后72 h内,大于90%修饰后的RENPs被排出,血液半衰期为17.96 min,适用于动脉栓塞、局部缺血及灌注、肿瘤血管等成像应用,并能够指导前哨淋巴结活检及骨肉瘤栓塞手术.田捷课题组[36]采用脂质体(Lips)包覆NaYF4∶Yb,Er@NaYbF4@NaYF4∶Nd NPs用于对棕色脂肪组织和血管的成像,肠系膜和肠壁血管成像分辨率可达0.17 mm.研究发现,这种RENPs可以自发地在棕色脂肪组织积累,棕色脂肪组织能够产热,与人体能量代谢过程密切相关,这种荧光成像试剂为研究肥胖等能量代谢紊乱引起的疾病提供了一种安全有效的方法.

Fig.2 High-resolution in vivo fluorescence imaging by using Nd3+-sensitized RENPs
为了同时比较Nd3+敏化的Nd3+-Yb3+-Er3+体系中Yb3+的980 nm发射、Nd3+的1064 nm和1345 nm发射以及Er3+的1525 nm发射的成像效果,李富友课题组[37]制备了NaYbF4∶Ce,Er@NaYF4∶Yb@NaYF4∶Nd NPs,并通过PAA/PEG-NH2改性增强纳米材料的生物相容性.成像结果显示,1490~1580 nm区间的成像分辨率明显优于检测波长大于930 nm范围的成像分辨率,信噪比则约为后者的2倍.在注射RENPs 10 h后,通过1490~1580 nm区间仍可对血管清晰分辨,分辨率为0.25 mm.这一结果表明,Yb3+的980 nm发射、Nd3+的1064 nm和1345 nm发射成像效果不如Er3+的1525 nm发射,进一步证明了长发射波长的低散射对提高成像质量至关重要.曾松军课题组[38]制备了NaYF4∶Gd,Yb,Nd,Er,Ce@NaYF4∶Nd@PAA NPs,其肿瘤血管成像分辨率可达42μm,并可用于指导肿瘤切除手术.
1.3 其它稀土离子敏化的RENPs
除了前文提到的Yb3+,Nd3+外,Er3+在650,808,980和1530 nm均有激发带,可以用来激发其它离子[39~41],也可以发生自敏化发光[42,43].陈冠英和韩晓军课题组[44]制备了808 nm激发的NaErF4∶Yb@NaLuF4@PAA自敏化NPs,研究了Yb3+掺杂量对不同波段发射强度的影响,并在活体小鼠体内实现了脑血管的荧光成像[图3(A)].刘晓敏课题组[43]制备了NaErF4∶Tm@NaLuF4并用于NIR-Ⅱ成像.0.5%掺杂的Tm3+在Er3+间充当能量传递的中介,增加了能级密度,有利于提高Er3+在4I13/2的布居数和1525 nm的发光.经PEG改性后,这种RENPs可用于全身、脑血管以及多种脏器的成像,不开颅脑血管成像分辨率可达18.6μm.

Fig.3 High-resolution in vivo imaging applications of Er3+sensitized RENPs
张凡课题组[41]利用Er3+的1530 nm吸收敏化Ho3+以实现1180 nm的NIR-ⅡUC发光,这种NaErF4∶Ho@NaYF4NPs同时还能具有980和650 nm的Er3+自敏化发光.其中,980和1180 nm的发射均可在活体中获得较高的分辨率.在另一项研究中,他们利用Tm3+在808和1208 nm吸收分别敏化Er3+,Yb3+及Ho3+,制备了NaYF4∶Tm,Yb@NaYF4,NaYF4∶Tm,Ho@NaYF4和NaErF4@NaYF4∶Tm@NaYF43种RENPs,并用它们作为荧光墨水制备了可植入二维码[45].通过NIR-Ⅱ成像,聚二甲基硅氧烷(PDMS)为基底的二维码在活体小鼠体内清晰可见,在利用时间门控荧光成像技术消除背景后,成像质量进一步提高,从而实现了活体信息存储[图3(B)].
1.4 非稀土敏化剂敏化的RENPs
稀土发光材料的主要缺点之一是4f-4f宇称禁阻跃迁导致的吸收弱[46],且大多数局限于980或808 nm激发,限制了其应用的灵活性.为了增大荧光探针的吸收、提高发光强度,并将激发波长扩展至980和808 nm之外,研究者采用许多外源敏化剂来敏化RENPs.
在有机染料敏化方面,Prasad课题组[47]率先开发了ICG敏化的NaYF4∶Yb,Er@NaYbF4@NaYF4∶Nd NPs,能在3 mm组织深度下实现3~4 mm分辨率的活体NIR-Ⅱ成像.李贞课题组开发了一系列有机染料/无机量子点-稀土复合成像试剂,有效提高了RENPs的发光强度.通过近红外吸收的有机染料IR-808敏化NaNdF4@NaLuF4后,其在1360 nm的NIR-Ⅱ发光增强了10倍以上,在利用聚焦超声技术使其穿过血脑屏障(BBB)后,可在原位成胶质细胞瘤中聚集,从而实现成像诊断[48].此外,还开发了近红外有机染料敏化的NaYF4∶Yb,Er@NaYF4∶Nd NPs荧光成像试剂[49],有机染料Alk-pi可以大大提高RENPs在808 nm的吸收,并将Er3+的1525 nm发射提高40倍.这种荧光探针在脑血管成像中的分辨率可达48μm,并可用于肿瘤血管成像以及动脉缺血、动脉粥样硬化等血液循环系统疾病的成像诊断[图4(A)].在无机敏化方面,通过使用980 nm吸收远超Yb3+的Ag2Se QDs敏化NaYbF4∶Gd,Ce,Er@NaYF4∶Yb NPs,将其在1525 nm的发射提高了超过100倍[50].这种荧光试剂可用于脑血管成像,其成像分辨率可达52μm,并且能在大脑中动脉栓塞(MCAO)等模型中进行动态成像以及血液灌注和流动速率的定量监测[图4(B)].

Fig.4 High-resolution in vivo imaging by using organic dyes and QDs sensitized RENPs
1.5 X射线激发的长余辉RENPs
X射线激发的稀土长余辉(PL)发光材料因为无需原位激发,可以有效避免生物体自发荧光干扰,提高成像信噪比[51],X射线的超强穿透能力则使得其在深层活体成像领域潜力巨大[52].刘小钢课题组[53]利用NaLuF4作为基底实现了X射线激发的超过30 d的PL发光.张凡课题组[54]以NaYF4为基底,制备了NaYF4∶Gd,Ln(Ln=Er,Tm,Ho,Nd)@NaYF4长余辉纳米颗粒(PLNPs),在X射线辐照后均可发出NIR-Ⅱ荧光.PLNPs在X射线辐照后将能量存储于缺陷之中,在-20℃下发光较弱,可以长期保存,而在室温下发光较强,可以用于活体成像.他们用低温保存的NaYF4∶Er@NaYF4PLNPs注入活体小鼠,实现了对血管、肿瘤、输尿管的高对比度、高分辨率的PL成像,在肿瘤成像中,PLNPs的PL在经过5 min衰减后组织/背景信号强度比仍为41,而808 nm激发的荧光(FL)仅为11.在输尿管成像中,10 s后PL的分辨率为181μm,808 nm激发的FL则为267μm.
2 RENPs在活体多功能高分辨成像中的应用
2.1 多路成像
多路成像是指在同一样本中采用不同光谱特性的荧光试剂同时分别成像的技术,有助于对复杂生命体系和生命活动的观测.然而由于荧光染料和荧光蛋白等常用荧光试剂的发射波长穿透力有限、生物自发荧光及组织散射对信号的干扰较强,高分辨率的哺乳动物活体多路成像仍然是一个挑战[55].而RENPs的荧光激发和发射波长多样、荧光寿命较长且可调,为这一问题提供了解决方案.
2.1.1 基于荧光激发/发射的多路成像 传统的多路成像一般采用两种不同发射波长的探针进行成像.对于RENPs,多路成像可以通过不同激发波长、不同发射波长以及激发和发射波长均不同的RENPs实现.为了比较多种808 nm激发荧光体系并开发单一激发的多路成像系统,金大勇课题组[56]制备了一系列核壳结构RENPs,包括NaYF4∶Nd@NaYF4(1064,1342 nm发射),NaErF4@NaYF4(1525 nm发射)和NaYbF4∶Er,Ce@NaYbF4@NaYF4∶Yb,Nd(1525 nm发射),并用PMH和mPEG-NH2修饰以增强水溶性和生物相容性.在808 nm激发下,通过滤光片分别收集小于1400 nm和大于1000 nm的信号,从而实现了多路成像,成像分辨率分别为0.48和0.42 mm.其中小于1400 nm的信号主要集中在肝和腹腔中的血管,大于1400 nm的信号则遍及全身的多级血管.程震课题组[57]验证了PEG修饰的NaYF4∶Nd@NaYF4和NaYF4∶Yb,Er@NaYF4分别在808和980 nm下激发的双色活体高分辨荧光成像能力,并发现NaYF4∶Nd@NaYF4的时间分辨率较高,NaYF4∶Yb,Er@NaYF4空间分辨率较高(156μm/358μm),二者在成像中有很好的互补性.
张凡课题组[54]利用Nd3+和Er3+掺杂的两种PLNPs实现了长余辉双色成像.在X射线激发下,两种PLNPs分别通过口服和尾静脉注射给药,分别发射1064和1525 nm的长余辉荧光,分别对消化道和肝脾等脏器进行成像.他们还利用NaYF4∶Yb,Er@NaYF4NPs与Er3+-细菌叶绿素配合物EB766组成了激发正交的双路成像系统[58].这两种荧光探针能分别在980和760 nm激发下发出1525 nm荧光.通过不同给药方式,他们用这种系统对小鼠后肢淋巴/血管进行了双路成像.在另一项工作中,利用3种不同激发、不同发射的RENPs:α-NaErF4@NaYF4(655 nm激发、1525 nm发射)、α-NaYF4∶Nd@NaYF4(730 nm激发、1060 nm发射)、α-NaYbF4∶Ho@NaYF4(915 nm激发、1180 nm发射)构建了正交三色发光体系[55],通过表面修饰不同基团、不同给药时间和方式,实现了3种激发下对内脏、胃和血管3种组织的多路成像[图5(A)].此外,分别制备了在980 nm激发下具有1525 nm荧光发射的α-NaYF4@NaYbF4∶Er,Ce@NaYF4和具有1155 nm荧光发射的β-NaYF4@NaYbF4∶Ho@NaYF4[59],分别用不含FA和含FA(用于对肿瘤靶向)的DSPE-PEG修饰,实现了对全身血管和肿瘤的双色动态成像.
2.1.2 基于荧光寿命的多路成像 通过时分复用技术,利用不同荧光寿命的探针进行多路成像可以有效避免生物组织对不同波长光的不同吸收和散射系数带来的信号误差,实现高保真多路成像.而RENPs的荧光寿命可以通过稀土离子掺杂量进行有效调控,在同一发射波长内可实现3个数量级的寿命调控[60].戴宏杰课题组[22]借助RENPs的长荧光寿命,通过在表面修饰程序性细胞死亡配体-1(PD-L1)抗体,在活体小鼠中与NIR-Ⅱ发射的PbS QDs共同实现了对肿瘤免疫治疗的双路成像.PbS QDs的荧光寿命仅为数十微秒,而这种RENPs则有数毫秒,因此,他们在一个通道中用808 nm单独激发QDs获得其荧光信号,在另一通道中用980 nm同时激发QDs和RENPs,但在检测器设置1 ms的延迟以完全消除QDs的荧光信号,仅保留RENPs的信号,解决了两种同波段荧光试剂进行双路荧光成像这一挑战.张凡课题组[45]通过调节Tm3+掺杂量调控RENPs的发光强度和荧光寿命,形成了多色、多种荧光寿命的NIR-Ⅱ发射体系.他们将不同荧光寿命的NaErF4@NaYF4∶Tm@NaYF4NPs制成的二维码重叠植入小鼠体内,若不设置延迟时间,只能得到重叠失真的图像.而通过算法分析不同时间门控下的图像可以获得两种RENPs存储的信息,从而实现了活体信息解码[图5(B)].

Fig.5 High-resolution in vivo multiplexed imaging with RENPs
2.2 多模态成像
由于单个成像方法各有优点和局限性,且提供的生理信息不同,因此在活体成像领域,多模态成像是获得全面、准确信息的重要手段[61].稀土离子除发光之外,也具有顺磁性和X射线吸收等特性[62,63],经常被用作多模态成像纳米平台[64,65].在高分辨活体成像中,也有一些以RENPs为基础的多模态成像应用.程震和屈军乐课题组[66]制备了NaYF4∶Yb,Nd,Tm@NaYF4@NaYF4∶Nd NPs与偶氮苯修饰的聚丙烯酸(PAA-Azo)复合形成的NIR-Ⅱ/光声(PA)双模高分辨成像试剂.808 nm激发下,Tm3+的365 nm紫外发射和475 nm蓝光发射可使偶氮苯发生可逆的光异构化,从而产生光声效应.而Nd3+的1345 nm发射则用于NIR-Ⅱ成像[图6(A)].对小鼠后肢的PA和NIR-Ⅱ成像分辨率分别为558和497μm.张凡课题组[54]利用Gd3+的顺磁性并采用18F标记NaYF4∶Er@NaGdF4PL NPs,首次实现了PL/MR/PET三模态成像,除高分辨PL成像外,其PET成像质量与已有报道相近,MR成像则优于临床使用的钆喷替酸葡甲胺(Gd-DTPA)造影剂.刘小钢和盛宗海课题组[67]开发了生物正交基团氮杂环辛炔(DBCO)修饰的NaYF4∶Yb,Er,Ce@NaYF4∶Nd@NaGdF4NPs,用于对肿瘤靶向的NIR-Ⅱ/MR双模成像.他们用叠氮基标记的非天然糖与胶质瘤细胞共孵育使其在膜表面表达含叠氮基的唾液酸,DBCO会与叠氮基特异性结合,从而实现对肿瘤的精准靶向.这种RENPs对小鼠后肢的NIR-Ⅱ成像分辨率可达512 μm,生物正交标记后,RENPs的NIR-Ⅱ信号在小鼠皮下肿瘤中增强了20倍,MR信号增强了2倍,并且可以持续存在48 h以上,适用于对肿瘤的实时活体成像监测[图6(B)].

Fig.6 High-resolution in vivo multimodal imaging with RENPs
3 RENPs在疾病诊断、生物传感与诊疗一体化中的应用
过去20年,RENPs的表面修饰策略得到了广泛而深入的研究[68,69],各种表面功能化的RENPs可以针对性地对某些疾病部位成像、对生物信号分子进行传感或在成像的同时发挥治疗作用.
3.1 功能化RENPs在疾病诊断中的应用
利用表面功能分子与生物信号分子或生物器官的相互作用,RENPs可以在特定部位靶向聚集成像,通过代谢速度、荧光强度等差异实现对疾病的诊断.张凡课题组[70]制备了谷胱甘肽(GSH)修饰的NaGdF4∶Nd@NaGdF4NPs并用于炎症部位的特异性成像.炎症部位会产生大量的活性氧(ROS)[71],而GSH分子间在ROS存在时会形成二硫键而发生交联,因此,RENPs会在炎症处会发生特异性聚集,从而实现诊断和增强成像,其信噪比是无交联RENPs的近3倍[图7(A)].此外,由于NaGdF4基质较小的尺寸(电子显微镜下4.38 nm,水合粒径5.3 nm),这类RENPs可以容易地被排出,14 d后体内残留不足15%.金大勇和袁小聪课题组[30]通过在RENPs表面修饰与肠粘膜具有良好黏附性的阿拉伯胶(GA),实现了胃肠道(GI tract)的高分辨成像,分辨率约1~2 mm,明显优于NIR-Ⅱa发射的Nd3+掺杂RENPs(2~4 mm)和NIR-I发射的ICG(3~6 mm),并用光片照明技术重构了胃肠道的三维(3D)影像.他们进一步利用溃疡性肠炎的肠粘膜渗透性增加使RENPs滞留时间增长的特点,通过羧甲基纤维素钠(CMC-Na)修饰RENPs实现了对溃疡性肠炎(IBD)的有效诊断和治疗过程的实时监测[图7(B)].

Fig.7 High-resolution in vivo fluorescence image-guided diagnosis by using RENPs
3.2 功能化RENPs在高分辨生物传感中的应用
功能化RENPs表面修饰分子与生物体内特定物质的相互作用可影响其荧光,从而实现高分辨生物传感.张凡课题组[41]将NaErF4∶Ho@NaYF4NPs、Fe2+和一种对芬顿反应十分敏感、在800~1100 nm有强吸收的有机染料IR1061一同封装,制备了H2O2传感探针.H2O2是一种炎症反应中产生的ROS,其与Fe2+同时存在时会发生芬顿反应,使IR1061被破坏,从而无法吸收RENPs发射的980 nm光,使得整个体系的980 nm荧光增强.因此在1530 nm激发下,通过980和1180 nm两个通道的发射强度比值即可实现H2O2浓度的传感.他们利用这种探针制成的微针阵列补片在小鼠皮下炎症模型中验证了其活体生物传感性能[图8(A)].在另一项工作中,在NaY0.5Er0.5F4@NaYF4NPs表面修饰了商用花菁染料Cy7.5,制备了次氯酸比例响应荧光探针[72].次氯酸也是一种炎症反应中产生的ROS,当次氯酸存在时,Cy7.5在800 nm左右的吸收急剧增加,从而抑制了808 nm激发下RENPs的荧光,而980 nm激发则不受影响.因此,在980和808 nm同时激发下,通过两种波长激发下的NIR-Ⅱ信号强度比值的变化即可实现对炎症的成像诊断.以淋巴炎为模型,这种探针在活体小鼠后肢中进行的炎症荧光成像分辨率可达273μm,可以有效诊断炎症[图8(B)].利用类似的原理,他们使用对ClO-有特异性响应的有机染料聚集体FD-J猝灭NaYF4∶Er@NaGdF4@NaYF4∶5%Nd@NaGdF4NPs的1330 nm发光,而不影响1550 nm发光,同样实现了对ClO-的比率荧光传感,分辨率可达249μm[73].GSH是癌症的重要信号分子,在肿瘤中浓度显著高于正常细胞[74].宋继彬课题组[75]采用具有GSH响应的有机染料NPh(4-硝基酚-Cy7)修饰NaYF4∶Yb,Er@NaYF4∶Nd NPs,用于对GSH的比率传感.NPh本身不发射荧光,但在GSH存在下能发生结构转变生成Cy7-SG,在808 nm激发下与RENPs发生非辐射能量转移(NRET),从而增强其发光.与此同时,980 nm激发下的荧光强度则不随GSH浓度而发生改变.因此,利用两种波长激发下1525 nm发射强度的比值对GSH浓度进行高精确度、高分辨率的传感[图8(C)].
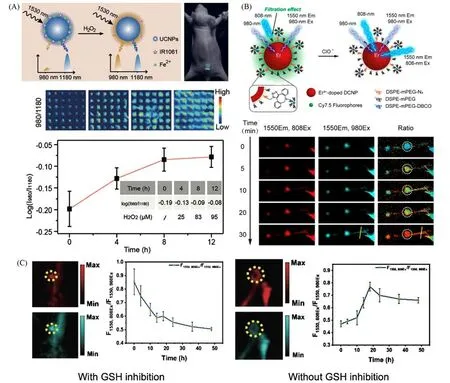
Fig.8 High-resolution biosensing applications of RENPs
3.3 功能化RENPs在诊疗一体化中的应用
诊疗一体化是指将诊断与治疗功能集成于同一平台上,对癌症或其它疾病进行同时诊断和治疗,从而达到精确、有效的治疗效果[76].RENPs的光激发本性以及多种表面修饰和复合策略赋予了其在诊疗一体化领域巨大的应用潜力.
光热治疗(PTT)因其光引发特性被广泛用于与RENPs协同诊疗[77~79].郝建华、曾松军和刘红荣团队[80]在PAA-NaYF4∶Gd,Yb,Er纳米棒表面修饰了Cu2-xS QDs,并用于NIR-Ⅱ高分辨荧光成像指导的PTT.在980 nm激发下,这种纳米棒基本保留了原有的高分辨荧光成像性能,脑血管成像分辨率可达44.2μm;同时,在808 nm激发下纳米复合物具有超过30%的光热效率,优于传统光热剂金纳米棒的21%,能有效减小肿瘤体积(图9).在另一项工作中,利用聚多巴胺(PDA)为光热剂修饰NaLuF4∶Gd,Yb,Er纳米棒,光热效率超过40%,成像分辨率可达45.2μm,同样达到了良好的成像和治疗效果[81].

Fig.9 Theranostics applications of RENPs[80]
除了外加光热试剂,高比例掺杂Nd3+的RENPs自身也具有一定的光热性能,且不同发射波长强度比值对温度具有响应性[82,83],为诊疗一体化提供了基础.然而,Nd3+自身在808 nm激发下的光热性能并不理想,NaNdF4NPs的光热效率仅为8.7%,但在与普鲁士蓝(PB)复合后,两者之间的CR可大大提高复合物的光热效率,光热效率高达60.8%[84],是一种良好的PTT试剂.为了将这一治疗功能与RENPs的成像功能相结合,陈冠英课题组[85]利用PB的光谱特性开发了NaErF4@NaYF4@NaNdF4@PB@PEG NPs.980 nm激发下,PB吸收较低,RENPs能发射Er3+自敏化的1525 nm荧光,实现活体高分辨成像;而808 nm激发下PB吸收较高,以产热为主,光热效率超过50%,能够对肿瘤进行有效治疗.
吕锐婵课题组[86]用单甲氧基聚乙二醇-乳酸-羟基乙酸共聚物(mPEG-PLGA)对NaGdF4∶Nd@NaLuF4NPs和阿霉素(DOX)进行封装,制备了具有NIR-Ⅱ高分辨成像和pH响应化疗功能的纳米诊疗试剂.这种直径300 nm的纳米试剂可以通过EPR效应在肿瘤中富集,且降解后释放的RENPs直径仅6 nm,易于排泄,增加了其安全性.
4 总结与展望
近年来,在组织中低散射的NIR-Ⅱ区发射RENPs在高分辨活体成像中得到了广泛应用并取得了快速发展.通过对RENPs的晶相、掺杂比例和核壳结构的设计来调控稀土离子间的能量传递过程,选择性地增强NIR-Ⅱ发光,从而提高成像质量.在传统的Yb3+,Nd3+敏化之外,对Er3+,Tm3+以及各类有机、无机的敏化剂进行了探索、扩展了激发范围,提高了发光强度,有效增强了成像效果,提高了应用灵活性.借助稀土离子多样的发光和其它特性,一系列多路成像和多模态成像试剂被开发.此外,通过丰富的表面修饰策略,高分辨活体成像试剂被赋予各类靶向、传感、诊断和治疗功能,表现出生物医学应用的巨大潜力.虽然RENPs在高分辨活体荧光成像领域已经取得了许多进展,但受限于较低的吸收强度、较差的生物相容性,还有很大的发展空间,其未来发展方向主要包括以下几点:
(1)进一步丰富激发波长.与发射光相同,激发光波长的红移同样能增加穿透深度、提高亮度、增强信噪比和分辨率.然而,目前绝大多数的研究工作仍然以传统的980或808 nm进行激发,仅有一个Tm3+敏化的体系能够在NIR-Ⅱ区段被激发[45].对Tm3+,Er3+,Dy3+,Sm3+等在NIR-Ⅱ有较强吸收的稀土离子掺杂的发光体系进一步探索,将为未来这一方面的研究突破提供可能性[46].
(2)提高发光强度.这一问题的解决需要多方面的努力,包括吸收强度的提高和能量传递过程的调控.RENPs较低的吸收强度使得活体应用时需要采用较高的能量密度来激发,带来对生物体造成光热损伤的风险.在稀土离子固有吸收较低的背景下,有机/无机杂合敏化体系的研究将对提高RENPs的吸收强度至关重要.目前已经有许多研究聚焦于通过调控RENPs内部的能量传递过程来调整其发射比例,以增强NIR-Ⅱ的发光强度,采用的策略包括离子掺杂(如Ce3+[22])和基质晶格的重新选择(如α-NaREF4[24]和KSc2F7[31]).Ce3+的掺杂建立了一条新的CR路径,从而大大增强了NIR-Ⅱ发射.通过引入其它稀土离子或过渡金属离子建立新的CR通路可能为这一领域再次带来变革.另一方面,当前研究中广泛采用的用于UC发射的β-NaYF4基质对于主要强调DC发射的RENPs来说并不是最合适的,晶格的改变可以带来离子间距的改变,调控CR的强度.探索更适合高分辨成像的纳米晶基质将成为该领域的一大挑战.
(3)提高成像试剂的生物相容性和生物稳定性.目前的研究主要集中于小鼠模型中,实现其在人体内的安全应用仍然任重道远:一方面,为了提高生物相容性,亲水化修饰将继续成为研究的焦点;另一方面,为了提高在体内的循环和代谢速率,需要尽量缩小RENPs的尺寸.但由于表面猝灭作用,RENPs的发光强度随尺寸的减小而急剧下降.因此,亟需发展水溶性、可降解、可排泄、高分辨的新型成像试剂,用于克服现有RENPs的这种固有缺点.目前,也有一些具有良好生物相容性或能够在生物体内降解的新型RENPs被报道[87~89],为未来高分辨荧光成像试剂的发展提供了新方向.
(4)集成更多诊断与治疗功能.UCNPs已经被广泛用于诊疗一体化方面的研究.而NIR-Ⅱ发射的高分辨RENPs探针的诊疗应用研究数量仍然有限:一方面,附加光激发的治疗功能会降低诊疗试剂的荧光强度,不利于高分辨成像;另一方面,当前的诊疗一体化主要集中在癌症诊疗[90],而实体瘤并不需要很高的分辨率即可成像和诊断.未来高分辨活体荧光试剂的诊疗一体化应用方向可能集中于癌症的早期诊断以及更精细的生命结构(如血管、神经、泌尿系统以及脑部疾病)的检测和治疗中[91~93].
综上所述,虽然稀土发光材料已经被大量研究,但在高分辨活体荧光成像领域尚处于起步和探索阶段.相信随着研究的进一步深入,稀土荧光成像试剂在生物相容性、成像分辨率和诊疗功能化等方面会得到更大的发展,并在生物医学领域具有更广泛的应用.

