自组装多肽探针在磁共振成像中的应用
徐海东,王 睿,梁高林
(东南大学生物科学与医学工程学院,生物电子学国家重点实验室,南京 210096)
近年来,随着计算机科学、物理学、分子生物学和材料化学等学科的发展,已有多种无创生物成像技术被开发并广泛应用于疾病诊断,如计算机断层扫描(CT)[1]、磁共振成像(MRI)[2]、光学成像(OI)[3]、正电子发射断层扫描(PET)[4]和超声成像(US)[5]等.其中,MRI利用核磁共振原理,通过被检测组织的物理和生物学特征(如水分子、铁离子、脂肪及血管外血液等)进行成像,从而评估病变过程,具有深组织穿透和高空间分辨率等优点[6].目前,多种自旋核被应用于MRI,如1H,2H,11B,13C,19F,23Na,31P和35Cl等[7].1H核具有核自旋磁矩,因在人体内广泛分布而被广泛应用.19F是1H后最适合应用于MRI的原子核,具有100%的自然丰度,且没有放射性,旋磁比和灵敏度分别为1H的94%和83%;而且肿瘤微环境的微小变化可以显著影响氢核(1H)和氟核(19F)的弛豫参数,从而反映疾病的发生,因此,基于1H MRI和19F MRI的肿瘤早期诊断和定位成为了研究热点[8].
1H大部分存在于人体内的水和脂肪中,产生的活体磁共振信号较强,具有高检测灵敏度.因此,1H MRI可提供大量的病理信息,对临床中一些疾病的诊断和预后都有显著的帮助,是生物医学研究和临床上最常用的成像技术之一[9].相比之下,正常生物体内氟的含量很少,因此19F MRI中信号受到的干扰较少,使其具有很高的选择性[10,11](表1).目前,19F MRI已经被应用于动态监测细胞内的离子(如Ca2+和Mg2+)[12]、pH值[13]及膜电位等生物指标.虽然基于1H和19F核的MRI已经得到了广泛应用,但是临床上肿瘤组织与正常组织的磁共振信号有时差异不大,导致图像分辨率较低从而影响诊断的准确性.为了进一步提升诊断的准确性,临床上经常使用造影剂来提高肿瘤区域的成像对比度.传统MRI造影剂往往局限于小分子探针,它们虽然能够被细胞摄取,有一定的优势,但其信号强度通常较弱,使得肿瘤病灶区域的成像对比度有限.随着纳米技术的迅速发展,已设计出大量新型纳米材料用于提高MRI成像的对比度[14].尤其是对于肿瘤的MRI造影而言,实体瘤组织的高通透和滞留(Enhanced permeability and retention,EPR)效应可以使纳米成像探针靶向肿瘤并在瘤内富集[15],从而放大信号并提高成像对比度.

Table 1 Comparisons between the 1H MRI and the 19F MRI[9,10]
在各种纳米探针中,基于自组装多肽的纳米探针因其合成简单、生物相容性好等优点[16]而备受关注.自组装多肽可以负载药物[17]、荧光分子[18]和磁共振分子等基团,在响应一些在病灶区域表达异常的活性酶后可使特定肽段序列被特异性剪切.如,利用凋亡细胞高度表达Caspase-3酶的特性,Shi等[19]设计了含有Caspase-3底物Ac-DEVD序列的多肽分子,在酶切后疏水残基聚集诱导荧光增强,由于Caspase-3在肿瘤中高表达,因此该探针具有肿瘤特异性,可以增强对比度,并减少假阳性的干扰.设计能够响应酶的多肽序列后,利用特定多肽序列或点击反应后产物的分子间非共价相互作用[20],如氢键[21]、π-π堆积[22]、范德华力[23]和静电力[24]等作用,自发原位形成纳米结构(如纳米纤维或纳米颗粒等)[25],从而实现病灶区域的靶向和累积.为了在多肽上负载药物,可以在多肽序列中加入侧链带有氨基的氨基酸.如,Wang等[26]基于CBT-Cys点击缩合反应,设计了在Lys侧链上负载光声药物Cypate的探针Val-Cit-Cys(SEt)-Lys(Cypate)-CBT,该探针经肿瘤高表达的CTSB特异性激活,其上的特定底物序列Val-Cit被剪切,使得分子间发生点击反应生成二聚体,然后通过π-π堆积作用自组装成尺寸较大的纳米粒子.此外,Gao等[17]设计了多肽-羟基氯喹(HCQ)探针Cypate-Phe-Phe-Lys(SA-HCQ)-Tyr(H2PO3)-OH,其磷酸根在碱性磷酸酶(ALP)的作用下被去除,亲水的Tyr与疏水的Phe-Phe多肽之间通过疏水相互作用和氢键相互作用自组装成纳米颗粒,促进了近红外染料Cypate在肿瘤区域的积累,增强了近红外光照射下的光热效应.同时,释放出的HCQ可以抑制细胞自噬过程,降低细胞耐热性,提高其对温和PTT的敏感度.Xu等[27,28]研究了小分子自组装形成水凝胶的机制,在超分子水平上开发出新的生物材料和治疗方法.此外,他们还利用酶响应的多肽自组装来选择性地杀死未分化的人类诱导多能干细胞(iPSC),从而降低iPSCs临床应用中的致癌风险[29].除了用于肿瘤治疗和药物递送,一些研究组还利用自组装多肽探针进行成像研究,如自组装多肽磁共振探针.自组装多肽磁共振探针由成像功能分子和自组装序列组成,在病灶区域活性酶的酶切作用下,对应多肽序列的自组装/解组装过程可以控制成像信号的“开”或“关”,减少细胞内其它环境的干扰,从而显著提高成像的对比度和灵敏度.同时,自组装多肽探针具有较高的稳定性.为了验证这一点,Hai等[30]测试了自组装多肽探针7 d内的紫外-可见光谱和高效液相色谱,两者均无明显变化,证明了自组装多肽探针具有很高的理化稳定性.Yan等[31]测试了探针在不同pH值或含10%血清的Tris缓冲溶液中形成的纳米颗粒的水动力尺寸,发现均无明显变化,即在不同的生理条件下,以多肽-酶为原理的造影剂分子具有良好的稳定性.本文综述了这些自组装多肽磁共振探针应用于不同MRI模式的最新进展,并展望了该领域未来的发展方向.
1 自组装多肽探针在1H MRI中的应用
应用于1H MRI中的造影剂有纵向弛豫造影剂(T1造影剂)和横向弛豫造影剂(T2造影剂)两种.T1造影剂通过水分子中的氢核与顺磁金属离子的直接作用,缩短了纵向弛豫时间(T1),从而增强了磁共振信号,使肿瘤区域更亮[32],在观察解剖结构方面具有优势.在众多T1造影剂中,钆离子(Gd3+)具有7个不成对电子的特性,使其具有较长的电子弛豫时间,有利于增加附近水分子的1H弛豫速率,从而获得较大的MRI信号增强倍数[33],因此钆基造影剂已经被广泛应用于临床T1MRI[34].T2造影剂缩短了横向弛豫时间(T2),病灶区域显得更暗,有利于观察病变,尤其是在判断出血点的位置时会更为明显.以超顺磁性氧化铁颗粒(SPIO)为例的T2造影剂可以显著缩短T2,在T2加权成像上表现为更暗,因此也得到了广泛应用[35].多肽自组装探针在两种模式下都有较好的表现,下面将分别介绍多肽自组装探针在两种模式下的应用.
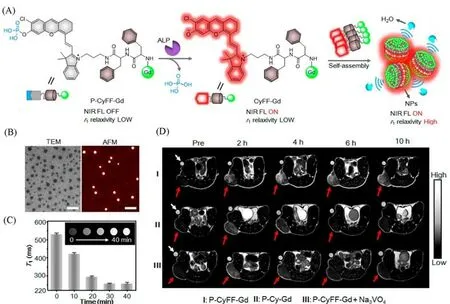
Fig.1 Schematic illustration of P-CyFF-Gd and fluorogenic reaction and in situ self-assembly of P-CyFF-Gd into NPs mediated by ALP that show increased NIR FL and r1 relaxivity(A),TEMand AFMimages of NPs after incubating P-CyFF-Gd(200μmol/L)with ALP(2 U/mL,37℃)for 30 min(Scale bars:200 nm)(B),T1-weighted MR images and T1 values(0.5 T)of P-CyFF-Gd(200μmol/L)in Tris buffer by incubating with ALP(2 U/mL)for 0—40 min(C),T1-weighted MR images of HeLa tumor-bearing mice receiving i.p.injection of P-CyFF-Gd(I),P-Cy-Gd(II),P-CyFF-Gd(III)together with Na3VO4.Images were acquired before(Pre)or 2,4,6,10 h after injection using TE/TR=15/446 ms at 1.0 T.White arrows indicate the Dotarem solution(1 mmol/L)as the internal standard.Red arrows point the tumor locations in mice(D)[31]
1.1 自组装多肽T1造影剂在1H MRI中的应用
在T1加权MRI中,传统小分子Gd造影剂在给药后会被快速清除,导致成像对比度较低,成像时间窗口较短.而通过生物标志物(如活性酶等)响应的多肽自组装使其原位聚集成纳米结构,即可达到肿瘤靶向和延长滞留时间的目的.如,利用肿瘤细胞膜高表达碱性磷酸酶的特性,2019年,Yan等[31]设计了一种ALP激活的近红外(NIR)荧光/MRI双模探针P-CyFF-Gd[图1(A)].该探针包含了被预猝灭的NIR荧光基团(部花青素,Cy-Cl)、用于MRI的顺磁性DOTA-Gd螯合物、能够被ALP特异性识别的磷酸基团(—PO3H)和促进自组装的疏水性二肽Phe-Phe(FF)的多肽结构.P-CyFF-Gd具有分子尺寸小和亲水性强的特点,因此可以渗入并弥散至肿瘤组织深处,并被肿瘤组织中高表达的ALP酶切,释放出具有疏水性结构的去磷酸化产物CyFF-Gd.由于这个产物具有FF的二肽结构,可以依靠分子间作用力π-π堆积自组装成纳米颗粒,动态光散射分析组装后的纳米颗粒的水动力尺寸约为66 nm,TEM和AFM测试结果验证了单分散纳米颗粒的形成[图1(B)].
随着ALP作用时间的增加,组装后含Gd的纳米颗粒尺寸变大,在0.5 T的场强下逐渐缩短水质子的T1,以产生更亮的T1加权磁共振图像,从而显著增强肿瘤区域的成像对比度[图1(C)和(D)].DOTA-Gd的稳定性和安全性都较高,属于一种低风险的造影剂.细胞毒性实验表明,该探针对细胞活性的影响不大,是一种生物相容性探针,经体内给药后最终可经肝脏代谢出体外.而将MRI与荧光成像结合,可以通过监测ALP的活性来监测疾病.除了Gd3+之外,高自旋数且具有生物相容性的T1造影剂锰离子(Mn2+)也可以被设计成自组装多肽T1造影剂.2018年,Zhang等[36]设计了一个超分子纳米平台,从而将MRI造影剂(Mn2+)和光敏药物(Ce6)结合在一起,并由两亲性的氨基酸Fmoc-L-L和Mn2+协同作用自组装.该探针既有良好的生物相容性和优异的稳定性,还能在谷胱甘肽(GSH)的作用下发生分解.在肿瘤病灶区中,Mn2+和Ce6可在细胞内高水平GSH的还原作用下释放,因此表现出增强的T1加权对比度以及滞留时间的延长.游离的光敏药物Ce6能够通过肾脏以及肝脏代谢,该超分子纳米平台连接Ce6后同样能够通过肾脏和肝脏代谢.该探针可以通过有效递送光敏剂,并原位产生GSH/Mn2+复合物以降低细胞内的活性GSH水平,从而促进活性氧(ROS)的累积,改善还原性肿瘤微环境,实现增强型光动力治疗(PDT)损伤肿瘤细胞和组织.同时,该探针通过释放到肿瘤组织中的Mn2+提升T1MRI对比度,从而利用MRI进行长期观察和临床评估.以上研究证明了基于多肽自组装的T1造影剂在MRI中的实用性.
1.2 自组装多肽T2造影剂在1H MRI中的应用
作为一种常用的T2加权MRI造影剂,SPIO纳米粒子具有尺寸分布窄、弛豫性强和靶向能力强等特点[37],这些特性使得SPIO纳米粒子在肿瘤检测中的灵敏度和精度相对较高[38,39].尤其是近期研究表明,当SPIO纳米粒子粒径较小,成为超小超顺磁氧化铁(USPIO)时,其饱和磁化强度和横向弛豫率均得到大幅提高,加之其具有很高的生物相容性和体内安全性,因此被广泛研究[40,41].而酶响应多肽自组装的策略可以进一步增强其成像对比度,延长其肿瘤病灶滞留时间,并赋予其生物标志物特异性成像的能力.2016年,Yuan等[42]设计了一种Caspase 3/7响应的USPIO纳米颗粒(Fe3O4@1纳米颗粒)胞内共价聚集的智能策略,用于增强肿瘤凋亡细胞的T2加权MRI.Fe3O4@1纳米颗粒探针包含了能够被Caspase 3/7特异性识别并切割的Ac-Asp-GluVal-Asp(DEVD)底物、侧链上结合了Fe3O4纳米粒子的赖氨酸(Lys)、用于CBT-Cys缩合的半胱氨酸(Cys)基序和2-氰基苯并噻唑(CBT)基序.当探针Fe3O4@1纳米颗粒进入Caspase 3/7过度表达的细胞(如凋亡的HepG2细胞)后,被保护的巯基会被胞内高水平的谷胱甘肽(GSH)还原,且DEVD结构的肽底物被Caspase 3/7切断,从而引发CBT与Cys发生缩合反应,使得Fe3O4纳米颗粒聚集.聚集后的纳米颗粒显著缩短了周围水质子的T2值,其横向弛豫率(r2)比对照组增强了约65.2%[图2(A)].9.4 T场强的1H MRI活体成像显示,Fe3O4@1纳米颗粒在体内的响应性聚集能够明显增强凋亡肿瘤的T2加权MRI[图2(B)和(C)],并且无明显的细胞毒性.在注射阿霉素(DOX)后的小鼠肿瘤中,凋亡细胞数量明显大于注射生理盐水的小鼠肿瘤中的凋亡细胞数量;在注射Fe3O4@1纳米颗粒后,能够明显观察到DOX治疗后的小鼠T2磁共振信号增强.该工作证明了基于多肽自组装的智能探针可以在活体生物上实现高效的T2加权MRI,还可以通过MRI监测肿瘤的化疗效率[图2(D)].
除了Caspase 3/7外,2020年,Wang等[43]还使用弗林酶(furin)来诱导多肽自组装.SPIO@1NPs具有良好的生物相容性,在furin酶过表达的肿瘤细胞中,SPIO@1纳米颗粒经过furin酶介导发生缩合反应产生自聚集,实现了比单分散SPIO更高的磁共振的r2值,从而增强T2加权MRI.
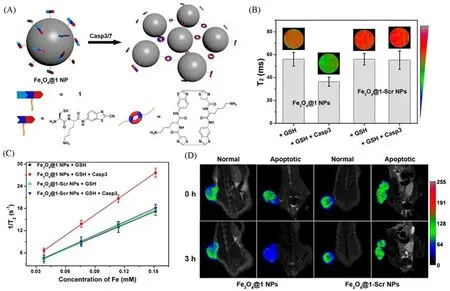
Fig.2 Schematic illustration of intracellular Casp3/7-instructed aggregation of Fe3O4@1 NPs(A),T2-weighted MR phantom images(echo time:75 ms)and T2 relaxation times of Fe3O4@1 NPs treated with 1 mmol/L GSH for 2 h at 37℃or 1 mmol/L GSH and 5 unit Casp3 for 8 h at 37℃,Fe3O4@1-Scr NPs treated with 1 mmol/L GSH for 2 h at 37℃or 1 mmol/L GSH and 5 unit Casp3 for 8 h at 37℃on a 9.4 T MR scanner(TR 5,500 ms,TE 15—180 ms)(B),transverse relaxation rates(1/T2)of Fe3O4@1 NPs or Fe3O4@1-Scr NPs at different concentrations in the presence/absence of Casp3(C),T2-weighted coronal MR images of Fe3O4@1 NPs-injected saline-treated mice,Fe3O4@1 NPs-injected DOX-treated mice,Fe3O4@1-Scr NPs-injected saline-treated mice,and Fe3O4@1-Scr NPs-injected DOX-treated mice after 0 h or 3 h injection(D)[42]
1.3 自组装多肽T1/T2造影剂在1H MRI中的应用
T1造影模式和T2造影模式都有其特有的优势和局限性,为了拓宽MRI的应用场景,研究者们开发出各种T1/T2双模态造影剂[44,45],以及T1/T2可切换造影剂[46,47]来提高特定场景(如低磁场或强磁场)下的MRI对比度,从而获得更精确的诊断.2017年,Dong等[46]研究发现Gd造影剂虽然通常被用作T1加权MRI,但是在高磁场下,自组装形成的Gd纳米纤维也可以作为T2加权MRI造影剂.他们将Gd-DOTA与ALP可激活的短肽共价结合,开发了一种ALP激活的自组装多肽前体Nap-FFFYp-EDADOTA(Gd).当被细胞膜过表达的ALP激活后,该前体被转化为水凝胶剂,并在肿瘤病灶周围自组装形成Gd纳米纤维,可以对周围水质子的横向弛豫率(r2)而非纵向弛豫率(r1)产生较大影响,实现了在9.4 T高磁场下的T2加权MRI对比度增强.
为了进一步探究T1/T2可切换造影剂的可行性,2022年,Li等[47]探究了胞内形成的Gd纳米粒子在低、高磁场下的磁共振特性.他们设计的探针Glu-DOTA-Gd-CBT被肝脏肿瘤细胞摄取后首先被γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,GGT)激活,而后被细胞中的GSH还原后自组装形成Gd纳米颗粒[图3(A)].在低场强(1.0 T)下,该Gd纳米颗粒DOTA-Gd-CBT-NP与前体分子Glu-DOTA-Gd-CBT相比,r1值增加了1.49倍,r2值增加了1.43倍,具有较低的r2/r1比值(0.91),表明了其可以特异性地增加肝脏肿瘤在1.0 T的T1加权MRI[图3(B),(C),(F)].而在高场强(9.4 T)下,聚集后形成的DOTA-Gd-CBT-NP与Glu-DOTA-Gd-CBT相比,r1值降低了0.74倍,r2反而显著增加了15.7倍,r2/r1比值大幅提高至11.8,从而显著增强肝肿瘤的T2加权MRI对比度[图3(D),(E),(G)].此工作将T1与T2加权MRI结合,拓宽了钆造影剂在临床上的使用,当9.4 T的MRI投入临床使用后能够同时对早期肝癌进行T1和T2加权MRI诊断.
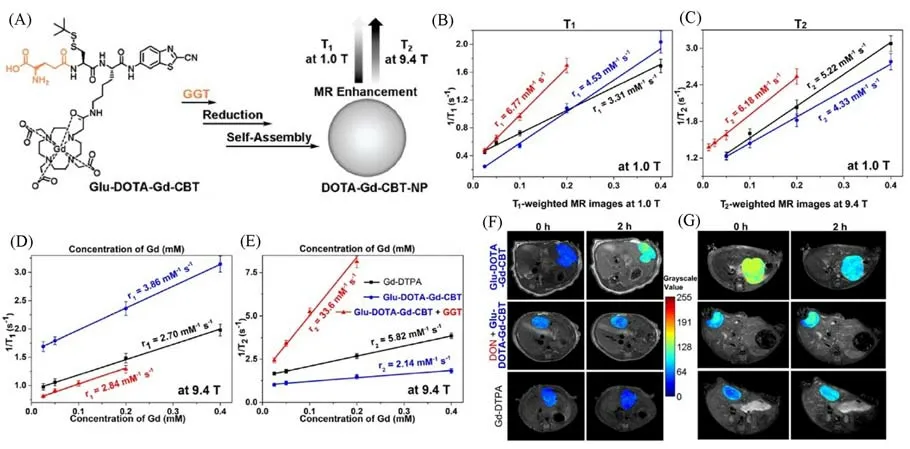
Fig.3 Schematic illustration of the formation of DOTA-Gd-CBT-NP guided by GGT to enhance T1 and T2 MR contrasts at low(1.0 T)and high(9.4 T)magnetic fields(A),longitudinal relaxation rates(1/T1)and transverse relaxation rates(1/T2)of Group Glu-DOTA-Gd-CBT+GGT,Group Glu-DOTA-Gd-CBT,and Group Gd-DTPA at low(1.0 T)or high(9.4 T)magnetic field(B—E),T1-weighted transverse MR images at 1.0 T and T2-weighted transverse MR images at 9.4 T of liver tumors in groups in(C)at 0 h and 2 h(F,G)[47]
2 自组装多肽造影剂在19F MRI中的应用
与1H MRI相比,19F MRI背景信号干扰小,具有较高的选择性,但其灵敏度较低,为了达到与1H MRI相当的图像质量通常需要注射高剂量的19F探针以增强其体内成像信号.相比之下,自组装多肽19F磁共振探针可以在低注射剂量的情况下,通过在靶标部位自组装积累以实现19F的高局部浓度[48,49],从而获取高灵敏度的图像,因此具有良好的应用前景.2015年,Yuan等[50]将多肽自组装与19F磁共振结合开发了一种双功能的19F磁共振纳米探针.该探针由Cys,CBT和DEVD底物以及侧链上结合了19F核素3,5-双三氟甲基苯甲酸(19F MBA)基序的Lys组成.探针在被GSH还原后通过缩合自组装成纳米颗粒,此时19F磁共振信号由于聚集效应被猝灭,表现出关闭状态;当该纳米粒子被Caspase 3/7分解后,可以很容易地原位获得高浓度的19F,从而点亮19F磁共振信号[图4(A)].利用这一策略,该探针可以对凋亡细胞中的Caspase 3/7活性进行检测[图4(B)],并且在14.1 T低剂量磁场下实现凋亡斑马鱼体内的Caspase 3/7活性成像.该工作开发了一种可以检测GSH和Caspase3/7活性的高灵敏度成像探针,19F纳米粒子在凋亡部位的解聚现象有效地阻止了由于局部19F聚集浓度过高而导致的信号猝灭,是一种良好的19F MRI方法,还可以应用于肿瘤患者治疗的预后评估[图4(C)].2016年,Zheng等[51]开发了另外一种由表皮生长因子受体(Epidermal growth factor receptor,EGFR,一种酪氨酸激酶)和ALP催化的19F磁共振纳米探针,有助于药物研究人员在没有空间位阻的情况下筛选这两种酶的新抑制剂.他们利用ALP诱导多肽自组装以制备超分子水凝胶,通过磁自旋的快速横向弛豫来预猝灭19F信号.EGFR催化水凝胶的磷酸化将水凝胶分解到溶液中,使得19F探针处于自由状态,从而开启19F磁共振信号,监测和检测EGFR的酶活.这两项工作都运用了组装/解组装的策略,将原位可激活自组装多肽纳米探针用于检测肿瘤部位特定酶的活性.
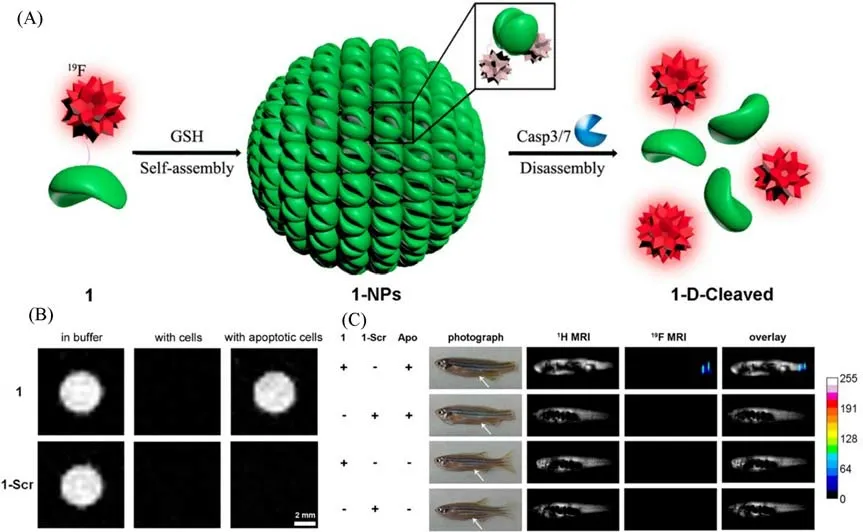
Fig.4 Schematic illustration of GSH-controlled self-assembly of 19F probe to turn 19F NMR signals“off”and Caspase 3/7-controlled disassembly of 19F NPs to turn 19F NMR signals“on”(A),19F MR imaging of 1 or 1-Scr in RIPA lysis buffer,in cell lysate after being incubated with HepG2 cells at 37℃for 30 min,and in cell lysate after being incubated with apoptotic HepG2 cells at 37℃for 30 min(B),2.1 g/kg of 1 and 1-Scr(10μL,dissolved in DMSO)injected into the enterocoelia of zebrafish 3 h after tail amputation and a healthy zebrafish(White arrows indicate the injection sites)(C)[50]
3 自组装多肽造影剂在双自旋核MRI中的应用
近年来,研究者们发现将1H和19F两种MRI方式结合起来能够进一步提高成像灵敏度和选择性,并降低背景噪声[52].如,Hu等[53]提出了一种肝靶向和GSH诱导的三模态探针(GdNPs-Gal).结合荧光成像、T1加权1H MRI和19F MRI,该探针可以通过对肝脏GSH水平的无创、实时成像,快速评估脂多糖(LPS)诱导的急性肝脏炎症.
2019年,Ding等[54]利用酶控多肽自组装的策略,设计了一种双自旋核MRI探针IONP@1.IONP@1包含了可被furin裂解并提供19F MRI信号的多肽底物(TFMB)-Arg-Val-Arg-Arg(TFMB-RVRR),CBT,Cys和T2MRI造影剂IONP.Fe3O4纳米颗粒具有非常好的生物相容性,所设计的MRI探针即使在高浓度下也只表现出了微弱的细胞毒性.通过集成IONP纳米颗粒造影剂的高灵敏度和19F MRI探针的优良选择性,同时实现T2加权磁共振信号增强和19F磁共振信号的“点亮”.当IONP@1被furin酶高表达的癌细胞摄取后,在胞内GSH和furin酶作用下发生CBT-Cys点击缩合反应控制IONP@1缩合自组装,形成IONP聚集物,“点亮”19F MRI信号并增强T21H MRI信号.经GSH处理后的IONP@1的T2值为28.8 ms,而经GSH和furin处理后的IONP@1的T2值下降到16.3 ms[图5(A)].由于顺磁松弛增强(Paramagnetic relaxation enhancement,PRE)效应,IONP@1探针最初表现为关闭的19F MRI信号.furin酶使得探针中的底物片段被剪切,引发CBT-Cys反应,导致IONP聚集体的形成,从而显著提高了水质子的横向弛豫,该策略在斑马鱼肿瘤中显示出更强的T2磁共振信号[图5(B)].同时,由furin激活后,TFMB-RVRR与IONP分离缓解了PRE效应,从而开启19F磁共振信号;并且通过IONP的聚集,可对furin酶活性进行体外检测[图5(C)和(D)].该工作通过蛋白酶控制多肽触发IONP聚集和PRE效应缓解,可以应用于精确的1H MRI和19F MRI,同时实现了高选择性和高灵敏度的肿瘤检测.
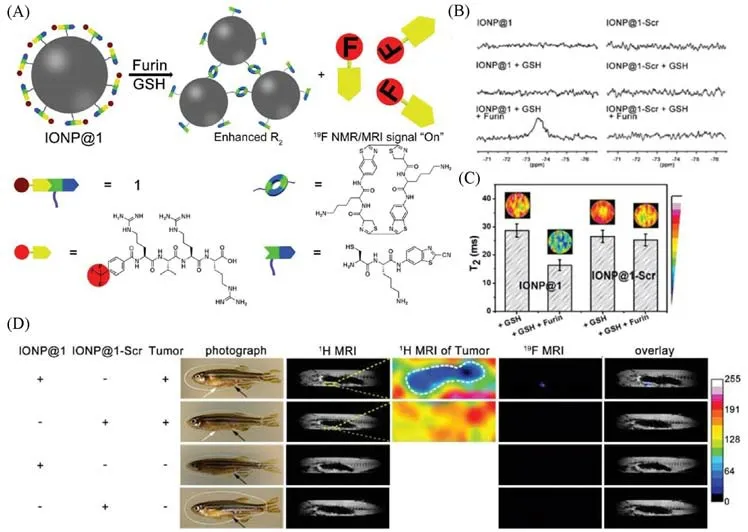
Fig.5 Schematic illustration showing furin-mediated formation of IONP aggregates for enhanced r2 and release of TFMB-Arg-Val-Arg-Arg-OH to“turn on”19F NMR/MRI signal(A),19F NMR spectra recorded for IONP@1 or IONP@1-Scr before or after incubation with GSH,and after co-incubation with GSH followed with furin(B),T2 images of phantoms,and corresponding T2 value of samples in IONP@1 and IONP@1-Scr after treating with GSH,or GSH and furin(C),1H MRI and 19F MRI of the enterocoelia of a healthy zebrafish or tumor-bearing zebrafish using IONP@1 or IONP@1-Scr(D)[54]
4 总结与展望
本文综述了酶响应多肽自组装MRI探针在不同磁共振模式(1H MRI,19F MRI和双自旋核MRI)中的研究进展.这些多肽自组装策略利用能够被酶激活的多肽结构进行原位自组装,由于肿瘤组织中高表达的酶具有特异性,使得装载在多肽上的造影剂分子能够在特定酶高表达的区域聚集,提高造影剂的滞留时间,在肿瘤区域实现精确和灵敏的MRI造影.多肽自组装MRI探针具有很高的安全性和靶向性,不仅可以提高磁共振成像质量还能够与药物、荧光试剂联合作用,实现多功能作用.虽然针对多肽自组装MRI探针的研究已经取得了较大的进展,但是目前该领域仍存在一些关键问题和挑战,在此我们给出了相应的对策和发展方向:(1)多肽本身的生物相容性和生物可降解性很高,但在多肽结构上连接了MRI材料后,其生物安全性仍然需要进一步评估.在后续的研究中,研究者们应进一步改进多肽的结构和序列,减少毒副作用,增强稳定性和在肿瘤细胞中的富集.(2)肿瘤的内源性标志物水平和活性可能会因为肿瘤的类型和物种的不同而产生差异.本综述中涉及到的探针只覆盖了一小部分的酶标志物及肿瘤,临床上仍有大部分肿瘤类型无法用自组装型探针识别出来.因此,仍需要针对不同的肿瘤,探索出其独特的、高度特异性和高表达的生物标志物,以设计更多具有高响应性的多肽自组装磁共振探针.(3)为了促进研究向临床的转化,磁共振成像不仅需要注重放大成像信号,还要注意探针在体内的药代动力学,关注其生物毒性以及代谢方式.在设计探针时,应当避免使用重金属造影剂,尽量选择临床上已经使用或者确认安全的造影剂分子,在最大程度上降低安全风险.此外,研究者们也应当严格控制给药剂量,并关注探针的长期毒副作用,比如生殖毒性和致敏作用等.(4)以多肽-酶为原理的造影剂分子在细胞中可能会受到多种因素的影响,为了进一步提高成像探针的稳定性及抗干扰性,并减少测试假阳性,研究者们需要不断优化探针的设计,如设计多酶响应探针、增强探针的肿瘤特异性及减少正常细胞的内化等.(5)随着越来越多的功能分子被开发出来,多模态成像成为了未来的肿瘤成像趋势.如将治疗与成像结合,通过MRI实时监控临床疗效.在未来的工作中,需要多学科的研究人员共同推进多肽自组装磁共振材料的开发和临床应用,从而实现非侵入性、实时、精确、高灵敏度的磁共振肿瘤成像.

