一步法高通量可控制备生物相容水/水微囊及其响应释放
翟小威,潘湄蝶,石 盼,赵 鹏,陈 东,
(1.浙江省智能生物材料重点实验室,浙江大学化学工程与生物工程学院,杭州 310027;2.浙江大学能源工程学院,能源清洁利用国家重点实验室,杭州 310003;3.浙江大学医学院附属第一医院肿瘤内科,杭州 310003)
随着微流控技术的发展,自上而下制备微囊的技术开始得到开发[9].微流控技术是一种在微米尺度对微量流体进行精确操控的技术,可广泛应用于生物检测[10,11]、药物分析[12,13]、细胞测序[14,15]、材料制备[16,17]、载体设计[18,19]等领域.微流控具有微型化、集成化等特征,可以对流体进行精准控制[20],从而精确控制剪切过程,能够一步法生成双重乳液,然后以此为模板,制备具有核壳结构的微囊.微流控技术已成功实现一步法制备各种水包油或油包水微囊[21~23],且具有尺寸均一、结构可控[24~27]、壁厚可调、包裹率高、装载率大[28,29]等诸多优势.目前,微流控技术制备的微囊主要是基于水油体系,即水包油(油/水)或油包水(水/油)微囊[30].但随着应用需求的不断增加[如污水净化[31]、液滴制备[32]、细胞提取与分离[33]、三维(3D)生物打印[34]、生物相容材料制备[35]等诸多领域],水包水(水/水)微囊开始得到越来越多的关注.但是水/水微囊与水/油微囊或油/水微囊不同,水/水微囊内外相均为水相,内外相的密度差较小,界面张力较低[36],较难控制形成微囊,通常需要外加电场或声场辅助乳化[37].此外,药物递送、医学治疗等领域的应用,在生物相容性、微囊后处理、可控制备、响应释放、大通量生产等方面对水/水微囊提出了更高的要求.因此,设计微流控器件一步法高通量可控制备生物相容水/水微囊,实现载体的可控释放,具有重要意义.
本文采用同轴微流控器件一步法制备大小均匀、尺寸可控、壁厚可调、生物相容的水/水微囊;系统研究了微流控器件结构对水/水微囊形成过程的影响规律,并进一步结合数值模拟,揭示内相和外相流速、外相/空气和内相/外相界面张力、内相和外相黏度对水/水微囊尺寸和壁厚的调控规律;通过pH刺激响应,展示了水/水微囊囊壁溶解和微囊释放过程及其内在机理;最后利用微通道流动阻力分析,设计多通道平行放大微流控器件,实现了尺寸均匀可控水/水微囊的高通量制备.本文制备的水/水微囊具有器件结构简单、操作便捷、一步法成型、通量高、微囊结构稳定、尺寸均一可控、无需后处理等优点.
1 实验部分
1.1 试剂与仪器
黄原胶(化妆品级)、透明质酸钠(化妆品级)和普鲁兰多糖(化妆品级)均购于山东优索化工科技有限公司;海藻酸钠(分析纯)和柠檬酸钠(分析纯)均购于上海阿拉丁试剂有限公司;无水氯化钙(分析纯)购于国药集团化学试剂有限公司;甘油(纯度≥99%)购于上海麦克林生化科技有限公司;十二烷基硫酸钠(纯度约99%)购于上海伊卡生物技术有限公司.
P-1000型拉伸仪,美国Sutter Instrument公司;LSP01-1A型注射泵,保定兰格恒流泵有限公司;LabN1/YZ1515x型蠕动泵,保定申辰泵业有限公司;玻璃毛细管,北京中成石英玻璃有限责任公司;RCT基本型磁力搅拌热台(MAG),德国IKA公司;ME204E型电子天平,上海梅特勒-托利多仪器有限公司;SZN型连续变倍体视显微镜,宁波舜宇光学科技有限公司;Orange 4K型光固化3D打印机,深圳长朗科技有限公司.
1.2 实验过程
1.2.1 同轴玻璃管微流控器件的制备 通过拉伸仪将内径0.55 mm、外径0.96 mm的圆柱形玻璃管和内径1.00 mm、外径1.40 mm的圆柱形玻璃管一端拉伸成锥状,并利用砂纸将锥状管口分别打磨至300和600μm.管口尺寸通过体显微镜进行精确测量.然后将外径0.96 mm的玻璃管(内管)插入内径1.00 mm的玻璃管(外管),分别制备内管管口内缩300μm、内/外管管口平齐、内管管口伸出300μm、内管管口内缩300μm外管管口不拉伸的同轴微流控器件,最后通过AB胶环氧树脂固定.
1.2.2 微流控器件制备水/水微囊 内/外相各成分含量均为质量分数:内相为0.2%黄原胶(增稠剂、稳定剂[38])、0.1%透明质酸钠(保湿剂[39])、2%普鲁兰多糖(抗氧化剂[40])、5%甘油(保湿剂[41])的水溶液(以下简称黄原胶水溶液),由内管注入微流控器件;外相为1%海藻酸钠(包材,可被钙离子交联形成稳定囊壁[42])、0.05%十二烷基硫酸钠(表面活性剂)的水溶液,由外管注入微流控器件.内相在外相的剪切下形成液滴,同时外相在重力作用下脱离管口生成水包水的水/水微囊,并进一步通过接收池(质量分数为5%氯化钙水溶液)中的钙离子交联海藻酸钠水凝胶网络,形成稳定的核壳结构.为了便于观察水/水微囊的特征,采用黄色染色剂对内相进行染色.通过系统改变内相流速和外相流速,研究微流控器件结构对水/水微囊成型的影响,最终确定水/水微囊的制备相图.
1.2.3 流速对水/水微囊制备的影响 内管管口内缩300μm的同轴微流控器件制备水/水微囊具有较好的稳定性,若无特别说明,后续均采用该种设计.保持外相流速不变,研究内相流速对水/水微囊直径和壁厚的影响.然后保持内相流速不变,研究外相流速对水/水微囊直径和壁厚的影响.水/水微囊的直径和壁厚通过随机选取100颗微囊进行测量计算得到.内相流速为40 mL/h,外相流速为20 mL/h,制备得到的水/水微囊具有较薄的壁厚,若无特别说明,后续均采用该内相/外相流速.
1.2.4 水/水微囊形成过程的数值模拟 数值模拟采用SolidWorks软件建立几何模型,使用ANSYS Workbench完成网格划分和模拟过程.模拟器件参数与实验器件参数保持一致,即内管外径0.96μm、内径0.55 mm、管口300μm,外管外径1.40 mm、内径1.00 mm、管口600μm,内管管口内缩300μm.由于同轴微流控器件通道结构具有轴对称性,将模型简化为二维模型.模型总体尺寸为20 mm×5.4 mm,包括上方微通道结构和下方20 mm长的空气域.微通道结构和内外相采用非结构化四边形网格划分.几何模型分别设置20,25,30,35,40和45μm等6种网格尺寸对模型进行网格无关性检验,最后选取网格尺寸为30μm,对应微囊直径为2.756 mm.内相和外相进口为速度型入口,出口为压力型出口,壁面为静止无滑移的疏水表面.初始化后,内相充满内通道,外相充满外通道.流动模型设置为层流模型,瞬态求解过程中的压力速度耦合采用SIMPLE算法,残差收敛精度为10-5,时间步长为10-4s.数值模拟研究两相流速、界面张力及两相黏度对水/水微囊直径和壁厚的影响时,模拟采用的温度为25℃,操作压力为0 Pa,外相/空气界面张力为30 mN/m,内相/外相界面张力为0.5 mN/m,内相0.2%黄原胶水溶液密度为1200 kg/m3,黏度为0.48 Pa·s,外相1.0%海藻酸钠水溶液密度为1135 kg/m3,黏度为0.30 Pa·s,空气密度为1.225 kg/m3,黏度为1.79×10-5Pa·s.
1.2.5 水/水微囊的pH响应和可控释放 分别用HCl溶液和柠檬酸钠调节溶液pH为1.0或8.0,静置观察水/水微囊在酸性或碱性溶液中随时间的变化.
如表1所列测点偏移量对应关系,解析程序即按此进行数据包解析,同时生成一项测点信息的配置表存储在数据库中,便于之后作为某台盾构的特征信息查看。在生成测点信息配置表过程中,以各测点所属盾构机子系统分组,如此在后续对盾构机子系统部件进行分析时提供便利,如图3。
1.2.6 平行放大微流控器件的设计和水/水微囊的高通量制备 首先通过微通道流动阻力分析,设计平行放大10通道微流控器件,微流控器件内相主管道直径4.0 mm,内相分管道直径0.5 mm,外相主管道直径3.5 mm,外相分管道直径1.2 mm.然后通过三维建模软件SolidWorks建立微流控器件模型.最后通过光固化3D打印机直接打印微流控器件.
2 结果与讨论
2.1 同轴微流控器件的设计和水/水微囊的制备
为了实现一步法制备大小均匀、尺寸可控、壁厚可调、生物相容的水/水微囊,需要设计同轴微流控器件,如图1(A)所示.内相黄原胶水溶液由内管注入微流控器件;外相海藻酸钠水溶液,由外管注入微流控器件.内相在外相的剪切下形成液滴,同时外相在重力作用下脱离管口生成水包水的水/水微囊,并进一步通过钙离子交联海藻酸钠水凝胶网络,如图1(B)所示.由于微流控器件对内外相的精准调控,水/水微囊在光学显微镜下具有清晰稳定的核壳结构[图1(C)],平均尺寸(D)为(2.83±0.09)mm[图1(D)].该方法制备水/水微囊具有器件结构简单、操作便捷、一步法成型、微囊尺寸均一可控、核壳结构稳定、无需后处理等优点[图1(E)].
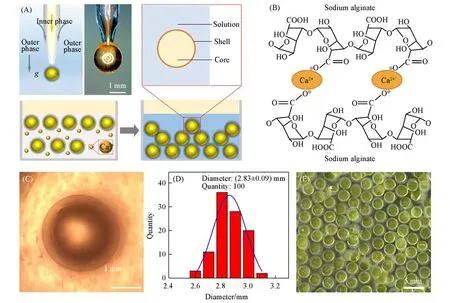
Fig.1 Design and preparation of water/water microcapsules
2.2 微流控器件结构对水/水微囊成型过程的影响
为了深入研究微流控器件结构对水/水微囊成型过程的影响规律,分别制备了内管管口内缩、内外管管口平齐、内管管口伸出、内管管口内缩外管管口不拉伸等4种同轴微流控器件,并通过系统改变内相和外相流速,判断水/水微囊的成型情况,最终确定水/水微囊的制备相图,分别如图2(A)~(D)所示.水/水微囊形成的关键是内相在外相的剪切下形成液滴,同时外相在重力作用下脱离管口生成水/水微囊.由于内外相均是水溶液,内相/外相界面张力较小,并且流体黏度较大,内相不容易在外相的剪切下形成液滴,进而被外相包裹形成水/水微囊,因此外相流速增大,对内相剪切加强,更易形成水/水微囊.
此外,内管管口内缩和外管管口拉伸,有利于外相在外管管口处通过流动聚焦剪切内相,因此内管管口内缩和外管管口拉伸的同轴微流控器件制备水/水微囊内核居中,壁厚均匀,且具有较好的稳定性和较大的制备区间.当外管管口不拉伸时,外相对内相的剪切作用减弱,其水/水微囊的制备区间变窄,且在较大流速区间内,只能得到变形的水/水微囊,如图2(D)所示.通过实验观察,若无特别说明,后续均采用内管管口内缩和外管管口拉伸的同轴微流控器件制备水/水微囊.

Fig.2 Tuning of water/water microcapsules by coaxial microfluidic devices
2.3 内相/外相流速对水/水微囊直径和壁厚的影响
微流控技术的优点在于对内相/外相流速及其乳化过程的精准控制.因此可以调节内相/外相的流速,研究其对水/水微囊直径和壁厚的影响,如图3(A)和(B)所示.当内相流速为40 mL/h,外相流速为20 mL/h时,水/水微囊的直径和壁厚分别为2.92和0.06 mm,尺寸偏差小于5%,装载率(水核体积/微囊体积)高达87%.由于水/水微囊直径的大小主要取决于微囊从微流控器件管口脱落的过程,与外相/空气界面张力和内外相重力的共同作用有关,界面张力使微囊悬挂在管口,重力使微囊脱离管口,可以用邦德数Bo(重力/界面张力)描述.由于界面张力和重力均与内相/外相流速无关,水/水微囊的直径基本不随内相/外相流速变化.在水/水微囊直径不变的情况下,其壁厚的大小主要取决于内相与外相的比例.因此内相流速增加或外相流速减小,都将造成水/水微囊壁厚减小.

Fig.3 Effect of inner phase flow rate on the diameter and wall thickness of water/water microcapsules(the outer phase flow rate:20 mL/h)(A),effect of outer phase flow rate on the diameter and wall thickness of water/water microcapsules(the inner phase flow rate:15 mL/h)(B)
2.4 水/水微囊形成过程的数值模拟
在微流控器件中,水/水微囊的形成受内相/外相流速、黏度、界面张力等因素影响[43,44].为了进一步验证实验结果和指导实验设计,通过参照实验流体物性参数,对水/水微囊形成过程进行了数值模拟,如图4(A)所示.随着悬挂在管口处的液滴不断长大,重力逐渐增大,最终克服界面张力,出现颈缩现象,液滴脱离管口,形成水/水微囊.

Fig.4 Numerical simulations showing the formation of water/water microcapsules
数值模拟与实验结果具有较好的一致性,数值模拟内相/外相流速对水/水微囊直径和壁厚的影响,得出了与实验数据一致的规律,即水/水微囊的直径基本不随内相/外相流速的变化而变化,而水/水微囊壁厚随内相流速增加或外相流速减小都将减小,如图4(B)和(C)所示.与实验相比,数值模拟可以更系统地调节各个参数,如外相/空气界面张力、内相/外相界面张力对微囊直径和壁厚的影响[图4(D)和(E)].随着外相/空气界面张力的增加,水/水微囊直径成比例增加,这是由于外相/空气界面张力使微囊悬挂在管口,重力使微囊脱离管口,当外相/空气界面张力增加,需要的重力相应增加,造成水/水微囊直径增加.当内相/外相界面张力增大时,水/水微囊直径略有增加.
数值模拟还研究了内相黄原胶水溶液浓度和外相海藻酸钠水溶液浓度对水/水微囊直径和壁厚的影响规律,如图4(F)和(G)所示.内相黄原胶水溶液属于剪切变稀非牛顿流体,其黏度随剪切速率的增大而减小,因此不同浓度的黄原胶水溶液具有相似的剪切变稀流变曲线,对水/水微囊直径和壁厚的影响较小.外相海藻酸钠水溶液也是一种非牛顿流体,其黏度随浓度增大而增大.当海藻酸钠溶度增加时,包裹内相难度增大,水/水微囊的生成开始伴随内相卫星液滴的出现,造成微囊壁厚增加.
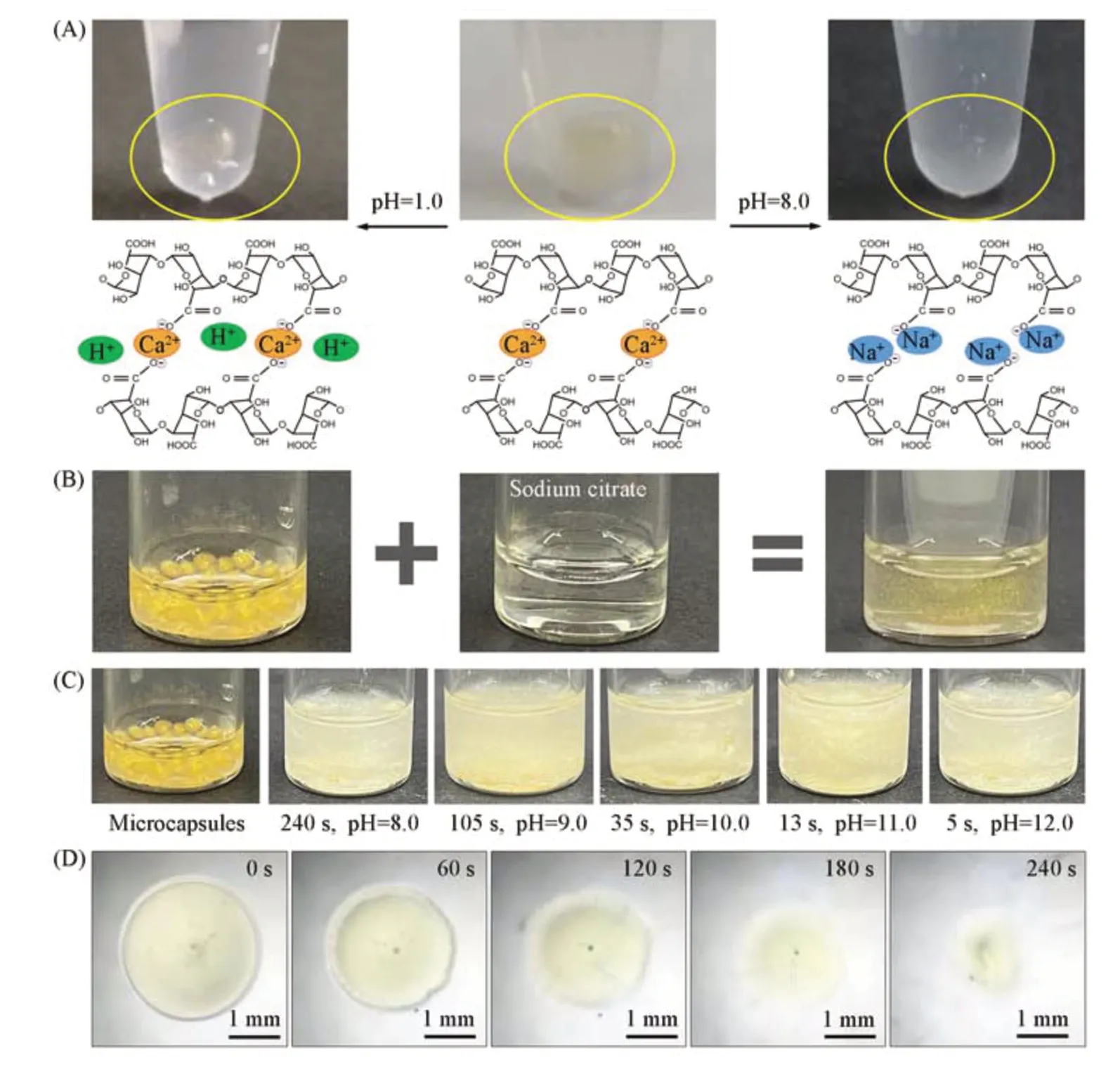
Fig.5 pH response and controlled release of water/water microcapsules
2.5 水/水微囊的pH响应和可控释放
所制备的水/水微囊具有良好的生物相容性、尺寸均一性及较高的包裹率和装载率,是各种活性物质的理想载体,并且能够对pH变化做出响应,实现可控释放.如图5(A)所示,水/水微囊的壳层是由二价钙离子交联的海藻酸钠水凝胶组成,在酸性环境下具有良好的稳定性,但在碱性环境下海藻酸钠水凝胶与二价钙离子的结合能力变弱,交联网络被破坏,从而释放内核活性物质.如果在溶液中加入柠檬酸钠,二价钙离子更倾向于与柠檬酸根结合,从而破坏交联网络,也可以溶解水/水微囊[图5(B)].如图5(C)所示,水/水微囊的溶解速率随pH的增大而提高.当水/水微囊的囊壁被溶解后,内核物质逐渐被释放出来,展现出良好的pH响应性和可控释放[图5(D)].
2.6 平行放大微流控器件的水/水微囊的高通量制备
如图6(A)和(B)所示,平行放大微流控器件采用梯形结构设计,微流控器件由一个主干通道和多个分支通道组成,每个分支通道组成一个水/水微囊生成器.流体在微通道内的流动类似电流在电路中的传输[45],微通道两端的压力差(ΔP)类似电压,微通道的流动阻力(R)类似电阻,类比微通道中流体的流量(Q)类似电流,且具有类似欧姆定律关系式Q=ΔP/R.在平行放大微流控器件中,每个微通道压力差ΔP一致,但由于离总入口距离不同,每个微通道的流动阻力不同,第N个分支通道阻力为Ru+NRc(其中,Ru是分支通道流动阻力,NRc是N段主干通道流动阻力Rc).为了保证每个微囊生成器的流量一致,生成的微囊尺寸均一,需要保证主干通道的流体均匀分配至每个分支通道,即NRc≪Rc,Q=ΔP/(Ru+NRc)≈ΔP/Ru.由于圆形微通道在层流状态下的流动阻力[46,47]为R∝μl/d4(其中,μ是流体的黏度;l是微通道的长度;d是微通道的直径),由此可见,流动阻力主要受微通道直径影响.计算分析表明,采用内相主干通道直径4 mm,分支通道直径0.5 mm,保证NRc<0.01Ru,可实现各内相分支通道流量相同.以此类推,采用外相主干通道直径3.5 mm,分支通道直径1.2 mm(由于外相分支通道采用同轴设计,分支通道横截面积实际有效直径为0.4 mm).

Fig.6 High-throughput preparation of water/water microcapsules by parallel amplification of microfluidic devices
在确定平行放大微流控器件通道结构尺寸设计后,通过SolidWorks建立三维模型,并利用光固化3D打印机直接打印微流控器件[图6(C)].实验表明,10个并排微流控通道均可以稳定生成水/水微囊,并且所生成的微囊具有较一致的尺寸大小和较均匀的分散性[图6(D)].综合统计10个微流控通道形成的微囊分布,可以得到D=(2.75±0.10)mm[图6(E)].在10个平行微流控通道设计下,水/水微囊的产率可以达到0.5 kg/h,并可依据相同原理,进一步增加平行通道的数量,提高产率,实现尺寸均一水/水微囊的高通量制备[图6(F)].
3 结 论
采用玻璃毛细管设计同轴微流控器件,结合数值模拟优化和流动阻力分析,实现一步法高通量可控制备大小均匀、尺寸可控、壁厚可调、生物相容的水/水微囊.在实验研究与数值模拟相结合下,揭示了器件结构、内相/外相流速、界面张力、内相/外相黏度等参数对水/水微囊直径、壁厚的影响规律,并实现了水/水微囊的可控制备.该方法制备水/水微囊具有器件结构简单、操作便捷、一步法成型、高通量、微囊尺寸均一可控、核壳结构稳定及无需后处理等优点.所制备的水/水微囊具有良好的生物相容性和尺寸均一性以及较高的包裹率和装载率,是各种活性物质的理想载体,并且能够对pH变化做出响应,实现可控释放.最后通过微通道流动阻力分析,设计多通道平行放大微流控器件,实现了尺寸均匀可控水/水微囊的高通量制备,为水/水微囊在药物递送、医学治疗等领域的应用进一步奠定了基础.

