Cr/Al/B/diamond体系中金刚石表面的热爆反应涂层*
韩警贤, 刘嘉霖
(1.郑州职业技术学院 机械工程系, 郑州 450010)
(2.中原工学院 机电学院, 郑州 450007)
具有超高硬度、超高热导率的金刚石是硬脆材料精密加工、复合镀层耐磨增强及电子封装导热增强等领域的理想材料[1-2]。但由于金刚石与绝大部分金属或陶瓷润湿性不佳,且在高温下易产生氧化或石墨化等,使电镀金刚石制品在制造过程中难以快速均匀上砂(沉积),与结合剂结合不牢固,且与结合剂界面产生较大热阻等,这些问题在金刚石的具体应用中亟待解决。
金刚石表面涂覆就是解决这些问题的有效手段之一。在金刚石颗粒表面涂覆涂层可以增强金刚石与结合剂的界面结合能力,显著提高结合剂与金刚石的结合强度[3],同时隔离保护金刚石以减轻金刚石的热损伤程度,并改善金刚石与结合剂界面的物理化学性能。经过几十年发展,金刚石的表面涂覆技术不断完善,其中的化学镀[4]、物理气相沉积[5]、原子层沉积镀[6]、熔盐涂覆[7]等多种方法已广泛应用于金刚石的表面涂覆中。
热爆反应是合成多孔金属间化合物的重要技术[8-10],具有高效、低能和设备工艺简单等优点。通过对含金刚石的试样坯体加热到临界温度点,试样坯体突然发生热爆反应,反应在极短时间内完成;且热爆反应产生的反应温度极高,试样中的元素与金刚石颗粒表面会瞬时发生化学反应,并在金刚石表面形成涂层。因此,金刚石的热爆反应涂覆技术相对以上的涂覆技术,具有许多优点:(1)反应时间极短,确保了金刚石颗粒表面不会产生严重的石墨化;(2)可实现快速涂覆;(3)工艺简单,仅需压片和管式炉热处理即可。但到目前为止,利用热爆反应技术在金刚石表面实现涂覆的报道还很少[11]。
所以,以Cr/Al/B为主反应结合剂,并在原料中添加不同含量的金刚石,同时添加Cr2O3或B2O3以诱发热爆反应,在金刚石表面实现金属/陶瓷复合涂层。反应后从试样中分离出金刚石颗粒,研究热爆反应后金刚石颗粒表面的涂覆状况。同时,采用DSC-TG技术,研究金刚石表面涂覆处理后的抗氧化性能。
1 试验过程
试验原料为Cr粉(纯度>99.0%,平均颗粒粒径为74 μm) ,Al粉 ( 纯 度 >99.0%,平 均 颗 粒 粒 径 为53 μm),B 粉(纯度>99.0%,平均颗粒粒径为 2 μm),Cr2O3和B2O3粉(二者纯度>99.0%,平均颗粒粒径均为 20 μm), 单晶金刚石颗粒 (平均颗粒粒径为 135 μm )。除金刚石外的原料粉末按不同质量比进行称量后,用球磨机低转速下球磨2 h,使之混合均匀;然后,在混合后的粉料中加入不同质量分数(10%,20%,30%和40%)的金刚石手工混合1 h,以使金刚石与粉料混合均匀。
表1为Cr/Al/B结合剂中可能发生的化学反应焓变值。由表1可知:由于Cr/Al/B结合剂的反应放热量较低,难以通过电炉辅助加热发生自发的热爆反应,因此需要采用化学方法进行预热,使其发生热爆反应。采用的化学方法就是用可自发发生热爆反应的Ti-Al压片(其中的Ti、Al元素质量比为1∶3,其厚度为3~4 mm,直径与需热爆反应的Cr/Al/B/Diamond压坯的尺寸相同)和Cr/Al/B/Diamond压坯叠加在一起,以诱使后者发生热爆反应。

表1 Cr/Al/B结合剂中可能发生的化学反应焓变值Tab.1 Enthalpy changes of possible chemical reactions in Cr/Al/B binder
把含金刚石的混合粉体放入不锈钢模具中, 经压片机加压得到直径为10 mm、厚度为3~4 mm的Cr/Al/B/金刚石致密压坯;后在压坯表面叠放一个引爆的Ti-Al压片,放入石英坩埚里;最后将坩埚放入TTI型快速加热管式炉中加热。加热过程为:(1)通入纯度为99.99%的高纯Ar进行保护;(2)升温、保温,升温速度为40 ℃/min,最高温度为800 ℃,在最高温度时保温1 min;(3)把加热过的坯体快速移出加热部位,使其在Ar中快速冷却至室温。Ti-Al压片热爆后,其热爆产物为略变形的较致密的块体;而Cr/Al/B/Diamond压坯的热爆产物为粉末状,二者容易分离,且不会引入Ti杂质。冷却后的坯体试样呈粉末状,用研钵研细后,再通过200目的筛网(筛网网孔尺寸为74 μm)筛分。筛网上会留下所有粗大的金刚石颗粒和少量较粗的结合剂颗粒,用镊子把棱角分明的金刚石颗粒挑选出来。
用Rigaku Ultima IV转靶X射线多晶衍射仪对热爆后的试样和分离的金刚石颗粒的物相进行分析。用ZEISS SUPRA 55场发射扫描电子显微镜观察金刚石颗粒表面的显微形貌。用NETZSCH STA 2 500型差热分析仪研究金刚石原料和涂覆后金刚石的抗氧化性能。
2 试验结果及讨论
前期的研究中发现,2Cr/Al/2B(Cr、Al和B元素的质量比为2∶1∶2)压坯通过Ti-Al压片进行引爆也不会发生热爆反应。原因在于2Cr/Al/2B结合剂中二元相的化学反应放热量较小(表1),不足以诱发热爆反应。但Cr-Al反应生成的化合物种类较多,有7种[12],其反应焓变值非常相近,表1只选择了2个代表性的CrxAly化合物。考虑到Al反应时具有较高的放热量,可以尝试在Cr/Al/B/Diamond体系中引入少量的Cr2O3或B2O3,使其和Al发生铝热反应,从而引爆整个体系。
2.1 Cr/Al/B/Cr2O3/Diamond体系的热爆反应
在Cr/Al/B体系中引入0.1 mol的Cr2O3替代部分Cr, 具 体 的 Cr, Al, B, Cr2O3的 原 料 质 量 配 比 为1.8∶1.2∶2.0∶0.1。在此基础上,再在原料中添加质量分数为10%、20%、30%和40%的金刚石,研究热爆反应后金刚石颗粒表面的涂覆情况。
图1为各热爆试样的外观。从图1可见:经过热爆反应后,试样产生了严重的粉末化。含质量分数为10%金刚石的试样基本保持原来的圆柱状,但已经变得非常易碎。随着金刚石质量分数增加到20%~40%,试样已完全变成粉末。

图1 热爆试样的外观Fig.1 Appearances of thermal explosion samples
通常而言,热爆反应的产物大都是较坚硬的多孔块体材料。多孔块体很难通过研钵研细成粉末,这明显增加了热爆产物中金刚石颗粒与结合剂分离工作的难度和工作量。但图1中研究的原料体系发生热爆反应后,试样没有变成坚硬的块体,而是变成粉末,容易研磨成较细的粉末,然后通过筛网进行金刚石分离。显然,热爆后的试样粉末化会容易分离金刚石颗粒。
图2为不同金刚石质量分数下试样中分离的金刚石颗粒的外观。从图2a、图2b可见:金刚石质量分数较低时,金刚石表面涂覆较好,淡黄色的金刚石颗粒表面呈现黑色;随着金刚石质量分数增加到30%时,少量金刚石未涂覆,呈现原来的淡黄色(图2c);当金刚石质量分数为40%时,半数左右的金刚石呈现原来的淡黄色(图2d)。

图2 分离的金刚石颗粒的外观Fig.2 Appearances of separated diamond particles
图2的结果表明,原料中金刚石的含量直接影响了产物中金刚石的涂覆程度。含10%和20%质量分数金刚石的热爆试样中分离得到的金刚石颗粒表面涂覆良好,而金刚石含量再提高时则其表面涂覆较差。这应该跟图1的试样粉末化相关,试样粉末化会导致金刚石与结合剂组元的接触变差,相应地结合剂组元中的元素无法与金刚石表面充分反应并形成涂层。
图3为热爆反应试样中分离金刚石后得到的结合剂粉末的XRD图谱。从图3可见:不添加金刚石的情况下,反应后产物的主相为CrB,同时含有少量AlCrx和Al2O3物相;添加10%金刚石后,除前述物相外,还出现了较多的Cr2AlB2物相;同时,随着金刚石含量的增加,CrB的衍射峰强度下降,而AlCrx的衍射峰强度逐渐增大。图3的结果表明,结合剂原料中添加适量的金刚石有助于促进高含量Cr2AlB2物相生成。Cr2AlB2是一种新型而重要的陶瓷材料,它的合成,有助于促进其应用。

图3 热爆试样中结合剂粉末的XRD图谱Fig.3 XRD patterns of binder powders in thermal explosion reaction samples
图4为金刚石原料和添加不同质量分数金刚石的热爆试样中分离的金刚石颗粒的XRD图谱,图中金刚石的衍射峰强度远大于杂质相的衍射峰强度。如图4a所示:除强的金刚石衍射峰外,没有观察到杂质相的衍射峰。把图4a中的纵坐标强度压缩100倍后可得到图4a中的小图,从小图中才可观察到杂质相的衍射峰,主要是杂质相的衍射峰强度弱造成的。因此,金刚石原料中存在微量杂质,可能是高温高压合成过程中由触媒引入的。

图4 金刚石原料和分离的金刚石颗粒的XRD图谱Fig.4 XRD patterns of diamond raw material and separated diamond particles
从图4b可见:当金刚石的质量分数为10%时,金刚石表面有多种物质,包括Al、Cr3C2、石墨、杂质物相等。这表明金刚石与Cr发生了化学反应,生成了含Cr3C2的涂层;同时,微弱的石墨峰表明在热爆反应作用下,金刚石的表面产生了微量的石墨化。随着金刚石含量提高,Al和Cr3C2的衍射峰逐渐减弱。这表明金刚石表面与Cr等的化学反应下降,金刚石表面的涂覆效果在逐渐变差。这一结果与图2的结果相吻合。相比杂质相较强的衍射峰,Al和Cr3C2的衍射峰较弱,说明其含量可能低于杂质相的含量。
此外,从图4b还可见:加入的金刚石量越多,杂质相的衍射峰有的变强,有的变弱,这可能是由于杂质相的种类不同造成的。同时,还需考虑每次使用的金刚石原料存在细微差别,从而导致其XRD图谱也会有细微差别。
图5为含10%质量分数金刚石的试样中分离的金刚石颗粒表面典型的SEM形貌。从图5a可见:金刚石颗粒表面的涂层包裹良好。涂层由大量不规则的晶粒组成,晶粒尺寸为0.5~7.0 μm(图5b)。

图5 分离的金刚石颗粒表面典型的SEM形貌Fig.5 Typical SEM morphology of separated diamond particle surface
图6为图5b中金刚石颗粒表面框选区域的EDS结果。图6中的涂层组织主要由Al、Cr和C等元素组成,该结果与图4的XRD结果相吻合,涂层组织主要由Al和Cr3C2相构成,即主要包含Al、Cr和C元素。由于EDS可穿透涂层达到金刚石内部,故EDS数据中C元素的含量较高。
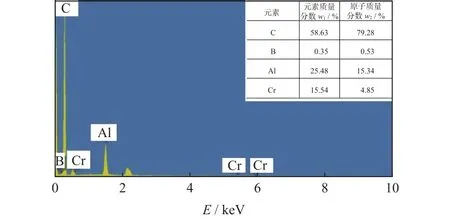
图6 图5b中金刚石颗粒表面框选区域的EDS结果Fig.6 EDS results of framed area on the surface of diamond particle in Fig.5b
2.2 Cr/Al/B/B2O3/Diamond体系的热爆反应
在Cr/Al/B/Diamond体系中引入0.1 mol的B2O3替代部分 Cr,其 Cr,Al,B,B2O3的结合剂原料质量比为2.0∶1.2∶1.8∶0.1。在此基础上,再在结合剂原料中添加不同质量分数的金刚石,研究热爆反应后金刚石颗粒表面的涂覆情况。该体系的热爆反应产物同Cr/Al/B/Cr2O3/Diamond体系的热爆反应产物外观相同,也呈粉末状。
图7为Cr/Al/B/B2O3/Diamond体系试样中分离的金刚石颗粒的外观。从图7可见:金刚石表面的涂覆效果较差,即使是在金刚石含量较低的情况下,金刚石颗粒有将近一半没有良好地涂覆;当金刚石质量分数为40%时,大部分金刚石呈现未涂覆时的淡黄色。相比于Cr/Al/B/Cr2O3/Diamond体系,本体系显然对金刚石的涂覆效果较差。

图7 分离的金刚石颗粒的外观Fig.7 Appearances of separated diamond particles
图8为热爆反应试样分离金刚石后得到的结合剂粉末的XRD图谱。从图8可见:结合剂粉末的主相为CrB、AlCrx和 Cr2AlB2,同时含有少量的 Al2O3、Cr2B和CrB2相。

图8 热爆试样中结合剂粉末的XRD图谱Fig.8 XRD patterns of binder powders in thermal explosion reaction samples
同时,随着金刚石含量的增加,AlCrx衍射峰强度显著增加。相比于含Cr2O3体系的结合剂粉末,本体系适合促进AlCrx相的合成,而对Cr2AlB2相合成的促进效果不明显。
图9为热爆试样中分离的金刚石颗粒的XRD图谱。从图9可见,金刚石表面主要包括Al和石墨。相比于图4b的结果,Al的衍射峰强度很弱;且Cr3C2的衍射峰也十分微弱,无法辨别。这一结果表明金刚石表面涂覆效果很差,与图7结果一致。

图9 分离的金刚石颗粒的XRD图谱Fig.9 XRD patterns of separated diamond particles
2.3 金刚石表面涂层的热爆反应形成机制
基于以上结果可知:采用Cr/Al/B/Cr2O3/Diamond粉体为原料,通过热爆反应可以制备含Cr2AlB2、CrB和AlCrx等物相,且具有良好涂覆涂层的金刚石颗粒。其反应机理是金刚石与结合剂元素间发生了如下反应:

图10显示Cr/Al/B/Diamond体系中形成的碳化物吉布斯自由能变随温度的变化。从图10可知:式(1)~式(3)反应的吉布斯自由能变△G均小于0,这表明这些化学反应可自发进行。其中Cr3C2的△G数值最大,因而其最易形成。但需要强调的是,通常在燃烧反应中,很难观察到Al4C3的存在,原因是Al4C3并不稳定,在1 200 K就会分解,会重新分解成Al和C。所以,金刚石表面的Al,一方面是加入的Al在高温下熔化、升华并“喷溅”到金刚石表面上,另一方面可能就是Al4C3分解所产生的。而石墨的存在,一方面是高温导致的金刚石石墨化,另一方面也可能是Al4C3分解所产生的。从热力学上讲,B4C也是有可能存在的,但由于其含量非常少,导致其很难在XRD图上观察到。故Cr/Al/B/ Diamond体系热爆反应后,在金刚石颗粒表面会形成Cr3C2和Al的复合涂层。

图10 Cr/Al/B/Diamond体系中形成的碳化物吉布斯自由能变随温度的变化Fig.10 Changes of Gibbs free energy of carbides formed in Cr/Al/B/Diamond system with temperatures
在Cr//Al/B/Diamond体系中加入Cr2O3或B2O3的热爆反应,其对金刚石表面的涂覆效果差异明显,这可能是Al和Cr2O3、Al和B2O3这2种铝热反应的放热量差异显著导致的。

从式(4)~式(5)2个反应的焓变值可知:Al和Cr2O3反应的放热量要大得多;同时,B2O3是低熔点(熔点为450 ℃)化合物,在热爆反应过程中会熔化而吸收一定量的反应热。这都不利于结合剂元素扩散,而与金刚石颗粒表面的C元素反应形成碳化物。因此,加入Cr2O3或B2O3的2种体系中的金刚石表面涂覆差异明显。
在Cr/Al/B/Cr2O3/Diamond体系中,金刚石的含量对热爆反应后金刚石表面的涂覆状态有决定性影响,这主要是试样严重粉末化和金刚石的高散热性所致。试样粉末化的原因,可以推测是热爆反应的绝热温度较低所致。绝热温度刚够维持热爆反应的发生,但是不足以实现试样的烧结,因此才会出现试样粉末化的情况。试样的粉末化必然导致金刚石颗粒与体系中元素接触困难,因而元素的扩散和反应困难。
另一方面,金刚石含量增加势必会降低反应体系的燃烧温度。由于金刚石的导热性好,在室温下其导热系数高达2 000 W/(m·K),添加大量金刚石必然显著降低反应体系的燃烧温度。燃烧温度下降,不利于金刚石与结合剂元素的扩散和反应。当原料中金刚石含量升高后,由于金刚石优良的导热性能,会进一步散发反应产生的热量,直接后果就是降低反应体系的绝热温度。绝热温度的降低必然导致金刚石与结合剂粉末的反应效果不理想,使涂层的均匀性变差。因此,可以观察到图2和图7中明显的规律,即随着金刚石的含量增加,金刚石表面的镀覆效果逐渐下降。
2.4 涂覆金刚石颗粒的抗氧化性能
以原始金刚石在空气中的初始氧化温度作为其抗氧化性评价标准。金刚石原料和热爆后涂覆Al-Cr3C2涂层的金刚石颗粒的热重分析结果如图11所示。图11的结果表明:原始金刚石颗粒的起始氧化温度为578 ℃,氧化终止温度为1 045 ℃。而涂覆Al-Cr3C2涂层的金刚石颗粒在722 ℃才发生氧化反应,氧化终止温度在1 200 ℃以上。显然经过涂覆处理后,金刚石颗粒的抗氧化性能显著提高。这是由于引入了致密且均匀的复合涂层,阻碍了O2与金刚石颗粒表面的接触,从而延缓了金刚石颗粒的氧化。

图11 金刚石颗粒的热重曲线Fig.11 TG curves of diamond particles
3 结论
以Cr/Al/B/Cr2O3/Diamond和 Cr/Al/B/B2O3/Diamond 2种粉体为原料,在高纯Ar保护下发生热爆反应,并在金刚石颗粒表面形成涂层。得出如下结论:
(1)经过热爆反应后,2种体系的产物粉末化严重,易于粉碎和筛分,从而容易把金刚石从产物中分离。
(2)Cr/Al/B/Cr2O3/Diamond体系经热爆反应后,添加适量金刚石,会显著促进Cr2AlB2相的合成且对产物中金刚石颗粒表面的涂覆效果影响显著。在金刚石质量分数较低为10%和20%时,金刚石颗粒的表面涂覆良好,继续增加金刚石含量会使涂覆效果略微变差。金刚石表面会形成Al-Cr3C2的复合涂层,涂层由大量不规则的细小晶粒组成,晶粒尺寸为0.5~7.0 μm。同时,金刚石表面会轻微石墨化。
(3)Cr/Al/B/B2O3/Diamond体系经热爆反应后,结合剂中的主相为CrB、AlCrx和Cr2AlB2。但金刚石颗粒表面的整体涂覆效果较差,只有半数或以下的金刚石颗粒被涂覆。
(4)经热爆反应涂覆处理后的金刚石比原料金刚石的起始氧化和终止氧化温度都明显提高,从而明显改善了金刚石的耐热性。

