紫苏叶多糖的提取工艺优化及理化特性分析
丁素芸,闫芝茜,刘会平,张晓维,陈沛,巩婷婷,司凯
(天津科技大学食品科学与工程学院,天津 300457)
紫苏叶为一年生草本植物紫苏的叶片,属被子植物亚门、双子叶植物纲、唇形科、紫苏属,紫苏的别名有很多,例如红苏、香苏等[1-2]。紫苏在我国是一种重要的经济作物,经济价值高,应用范围广,在我国北方地区主要用来榨油,兼做药用;而南方地区主要用于医药方向,兼做香料或食用[3]。2002年紫苏被国家中医药管理局列入既可食用又可作为药用的物品名单,成为首批“药食同源”植物之一,可用作天然香料、化工原料、食品和药品原料等,在工业、医药、保健等方面均有较大的研究价值[4-5]。
紫苏叶中含有蛋白质、氨基酸以及微量元素等丰富的营养物质。《中国药典》[6]中记载,紫苏叶具有解表散寒、行气和胃的功效,可以用来发汗、镇痛、镇咳等。中医认为紫苏叶能够缓解支气管痉挛、扩张皮肤血管、促进消化液的分泌等,具有解鱼蟹毒、祛暑、降血压的作用,还可以对动脉硬化、痢疾、消化不良等夏秋季节易发的疾病起到预防作用[7]。现代药理的众多研究表明,紫苏叶中含有挥发油类[8]、黄酮类[9]、花青素[10]、酚酸类[11]、多糖类[12]等多种生物活性成分,具有抗氧化[13]、抗肿瘤[14]、降血糖[15]、抗炎抗菌[16]等多种药理功能。
目前,国内外对紫苏叶的研究主要集中在种植技术[17]、化学成分分析[18-19]、营养价值及药用成分分析[20-22]等方面,而对紫苏叶多糖的提取分离、理化特性等方面的研究还有待深入。本试验以紫苏叶为原料,通过单因素试验探究料液比、提取时间以及醇沉浓度对紫苏叶多糖得率的影响,再利用响应面优化提取工艺条件,并对紫苏叶多糖的理化性质进行分析,以期为紫苏叶资源的开发利用以及深加工途径提供重要参考。
1 材料与方法
1.1 材料与试剂
紫苏叶:安徽省六安市大别山;无水乙醇、正丁醇、三氯甲烷:江天化工技术股份有限公司;100 kDa透析袋、葡萄糖标准品:北京索莱宝科技有限公司。所用试剂均为分析纯。
1.2 仪器与设备
电热恒温鼓风干燥箱(DZF-6020):上海传讯实业有限公司;高速粉碎机(SE-750):浙江永康市圣象电器有限公司;低速离心机(TDZ5-WS):长沙湘仪仪器有限公司;冷冻干燥机(FD-1C-50):北京博医康实验仪器有限公司;旋转蒸发仪(RE-52A):上海亚荣生化仪器厂;扫描电子显微镜(SU1510):日本日立公司;差示扫描量热仪(60Plus):日本岛津公司;热重分析仪(TGA-Q500):美国TA 公司;X-射线衍射仪(Ultima IV X):日本理学株式会社。
1.3 紫苏叶多糖的提取分离及纯化方法
紫苏叶片在鼓风干燥箱中干燥至恒重、粉碎机粉碎,过80目筛后得到紫苏叶粉末原料。称取适量干燥的紫苏叶粉末,向其中加入一定比例的蒸馏水,置于100℃热水中热提 3 h,离心(4 000 r/min,15 min)过滤渣滓后,将3次提取后的紫苏叶多糖上清液合并,利用旋转蒸发仪蒸发浓缩至初体积的1/3,再根据浓缩后的体积加入无水乙醇,将混合溶液在4℃条件下醇沉过夜(12 h)后,4 000 r/min离心 15 min,收集离心后的底层多糖混合物沉淀,吹干沉淀中残留的乙醇,蒸馏水复溶沉淀后于8 000 r/min离心10 min以去除混合物中的不溶性杂质,最终收集上清液用冷冻干燥机在-80℃进行冷冻干燥后得到紫苏叶粗多糖。用Sevage法去除紫苏叶粗多糖中的蛋白杂质,利用100 kDa透析袋进行透析、Sephadex G-200柱层析法对紫苏叶粗多糖进行纯化,得到均一组分的紫苏叶多糖,将其命名为PFP(Perilla frutescens var.frutescens polysaccharide)。多糖得率的计算公式如下。
多糖得率/%=M1/M2×100
式中:M1为紫苏叶粗多糖质量,g;M2为紫苏叶粉末样品质量,g。
1.4 标准曲线的绘制
采用苯酚-硫酸法[23]测定PFP中的总糖含量。准确称量葡萄糖标准品,用蒸馏水配制成0.1 mg/mL的标准溶液。取6只干净试管根据表1加入试剂,将试剂混匀后静置10 min,然后30℃水浴20 min,反应全部结束后于490 nm处测定吸光度,绘制葡萄糖标准曲线,溶液配制见表1。

表1 溶液配制Table 1 Solution preparation
1.5 样品中总糖含量的测定
用1.4中的方法进行PFP的配制,把测得的吸光度代入标准曲线,计算出PFP的总糖含量。
1.6 单因素试验
1.6.1 料液比对紫苏叶多糖得率的影响
在5个烧杯中分别加入适量的紫苏叶粉末,按照1 ∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶50(g/mL)的料液比用蒸馏水溶解,在温度为100℃条件下水提4 h,提取3次。结束后4 000 r/min离心15 min,收集上清液,加入上清液体积1.5倍的乙醇进行醇沉12 h,8 000 r/min离心5 min、冻干后称重,计算出不同料液比提取下的紫苏叶多糖得率。
1.6.2 提取时间对紫苏叶多糖得率的影响
在5个烧杯中分别加入适量的紫苏叶粉末,按料液比1∶30(g/mL)加入蒸馏水溶解,在100℃下分别提取 1、2、3、4、5 h,提取 3 次。结束后 4 000 r/min 离心15 min,收集上清液,加入上清液体积1.5倍的乙醇进行醇沉12 h,8 000 r/min离心5 min、冻干后称重,计算出不同提取时间下的紫苏叶多糖得率。
1.6.3 醇沉浓度对紫苏叶多糖得率的影响
在5个烧杯中分别加入适量的紫苏叶粉末,按料液比1∶30(g/mL)加入蒸馏水,在100℃下提取4 h,提取3次,结束后4 000 r/min离心15 min,收集浓缩3次提取后的紫苏叶多糖上清液,向其中加入乙醇使最终浓度分别为50%、60%、70%、80%、90%,8 000 r/min离心5 min、冻干后称重,计算出不同醇沉浓度下的紫苏叶多糖得率。
1.7 响应面优化提取工艺方法
根据单因素试验结果,使用Design-Expert 8.0软件根据Box-Behnken原理设计试验模型,考察各因素对紫苏叶多糖得率的影响,确定紫苏叶多糖的最佳提取条件。试验因素和水平见表2。
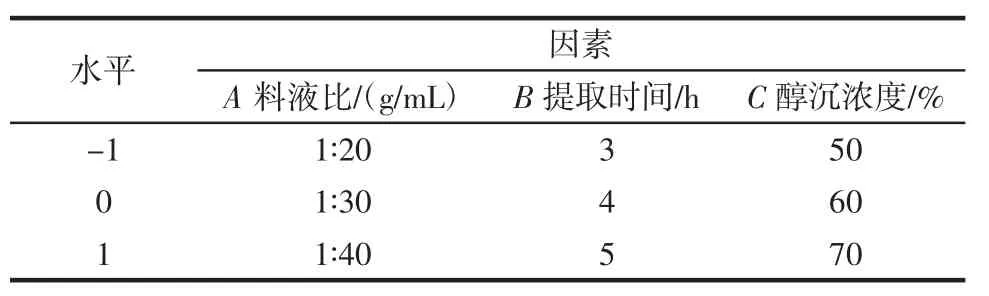
表2 响应面试验设计各因素水平编码Table 2 The factors and levels of response surface experiment design
1.8 理化特性分析
1.8.1 差示扫描量热分析
称取3 mg PFP样品放入坩埚中,用压片机压紧后置于差示扫描量热仪(differential scanning calorimetry,DSC)进行热特性检测,温度范围25℃~200℃,升温速率10℃/min。
1.8.2 热稳定性分析
称取2 mg PFP样品放入托盘中,需保证PFP全部放入样品盘中,边缘无外漏,利用热重分析仪(thermo gravimetric analyzer,TGA)对PFP的热稳定性进行检测,温度范围25℃~600℃,升温速度10℃/min,根据TGA曲线对PFP的热解进行分析。
1.8.3 X-射线衍射分析
取50 mg PFP样品,将表面压平后置于X-射线衍射仪(X-ray diffractometer,XRD)检测板上进行X射线扫描,扫描条件:2θ变化范围 5°~90°,速度 2°/min。
1.9 数据分析
利用SPSS 22.0软件进行数据的统计学处理,所有数据均以平均值±标准差表示。使用Origin 2018进行图表的制作与处理。
2 结果与分析
2.1 单因素试验结果
2.1.1 料液比对紫苏叶多糖得率的影响
图1为料液比对紫苏叶多糖得率的影响。
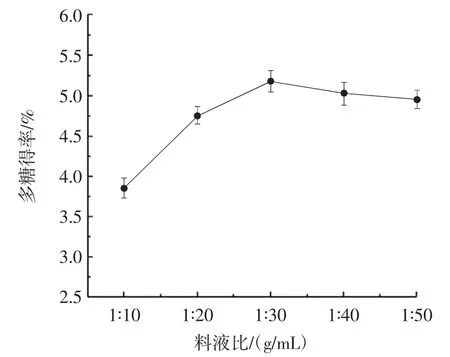
图1 料液比对紫苏叶多糖得率的影响Fig.1 Effect of solid-liquid ratio on yield of polysaccharides from Perilla frutescens var.frutescens
由图1可知,紫苏叶多糖得率随着蒸馏水体积的增加呈现先上升后下降的趋势。当料液比为1∶30(g/mL)时,紫苏叶多糖得率达到最高,为(5.18±0.13)%,继续增加蒸馏水的比例,多糖得率反而降低,这可能是因为多糖以外的其他物质溶出量变多,与多糖呈现竞争关系从而导致多糖得率降低[8]。结果表明,当料液比为1∶30(g/mL)时,紫苏叶多糖溶出的最多,因此选择1∶30(g/mL)的料液比进行后续响应面试验。
2.1.2 提取时间对紫苏叶多糖得率的影响
图2为提取时间对紫苏叶多糖得率的影响。
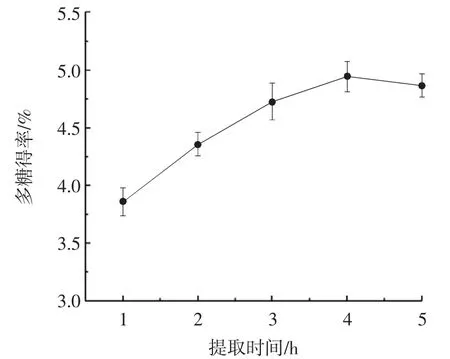
图2 提取时间对紫苏叶多糖得率的影响Fig.2 Effect of extraction time on yield of polysaccharides from Perilla frutescens var.frutescens
由图2可知,随着提取时间的不断延长,多糖不断溶出,当提取时间达到4 h时,多糖得率达到(4.95±0.13)%。继续延长提取时间,多糖得率降低至(4.87±0.10)%,提取时间的长短对紫苏叶多糖的得率也有影响,当提取时间太短,会导致提取过程不充分,因此多糖的得率较低,若时间过长,溶质会出现溶解平衡现象,得率便会维持基本不变[24]。因此选择提取4 h进行后续响应面试验。
2.1.3 醇沉浓度对紫苏叶多糖得率的影响
图3为醇沉浓度对紫苏叶多糖得率的影响。

图3 醇沉浓度对紫苏叶多糖得率的影响Fig.3 Effect of alcohol precipitation on yield of polysaccharides from Perilla frutescens var.frutescens
从图3可以看出,醇沉浓度对紫苏叶多糖得率也有一定影响。当浓度为60%时,紫苏叶多糖的得率最高,为(5.02±0.06)%,随着乙醇浓度的增大,得率有所下降,可能是乙醇增加了体系中溶液的总量,降低了体系中紫苏叶多糖溶液的浓度,从而不利于沉淀的形成,因此选择60%醇沉浓度进行后续试验。
2.2 响应面结果分析
2.2.1 响应面试验结果与分析
根据单因素试验结果,利用Design-Expert 8.0软件设计三因素三水平17组响应面试验,优化紫苏叶多糖的提取条件。试验设计及结果见表3。
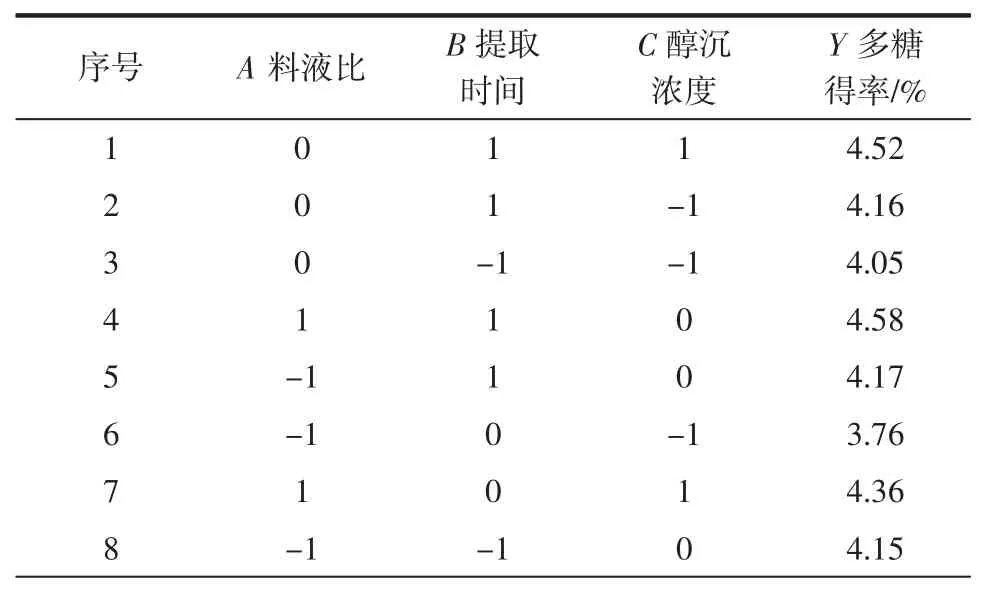
表3 响应面试验设计Table 3 Results of Box-Behnken design
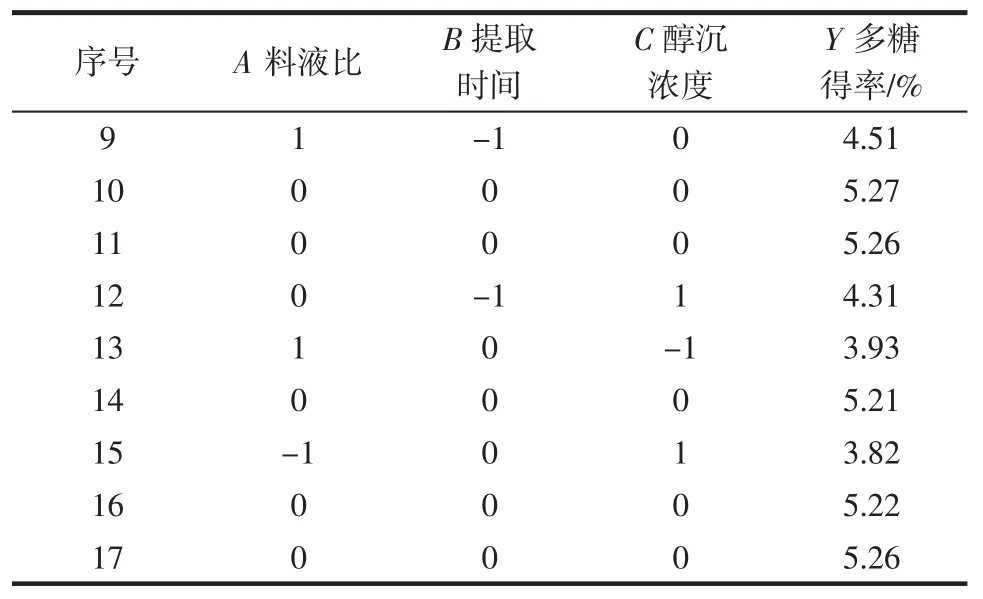
续表3 响应面试验设计Continue table 3 Results of Box-Behnken design
2.2.2 方差分析和二次多项回归方程拟合
利用Design-Expert 8.0软件对试验数据进行多元回归拟合,得到二次回归方程为Y=5.24+0.19A+0.051B+0.14C+0.012AB+0.093AC+0.025BC-0.59A2-0.30B2-0.68C2。表4为响应面试验结果方差分析。
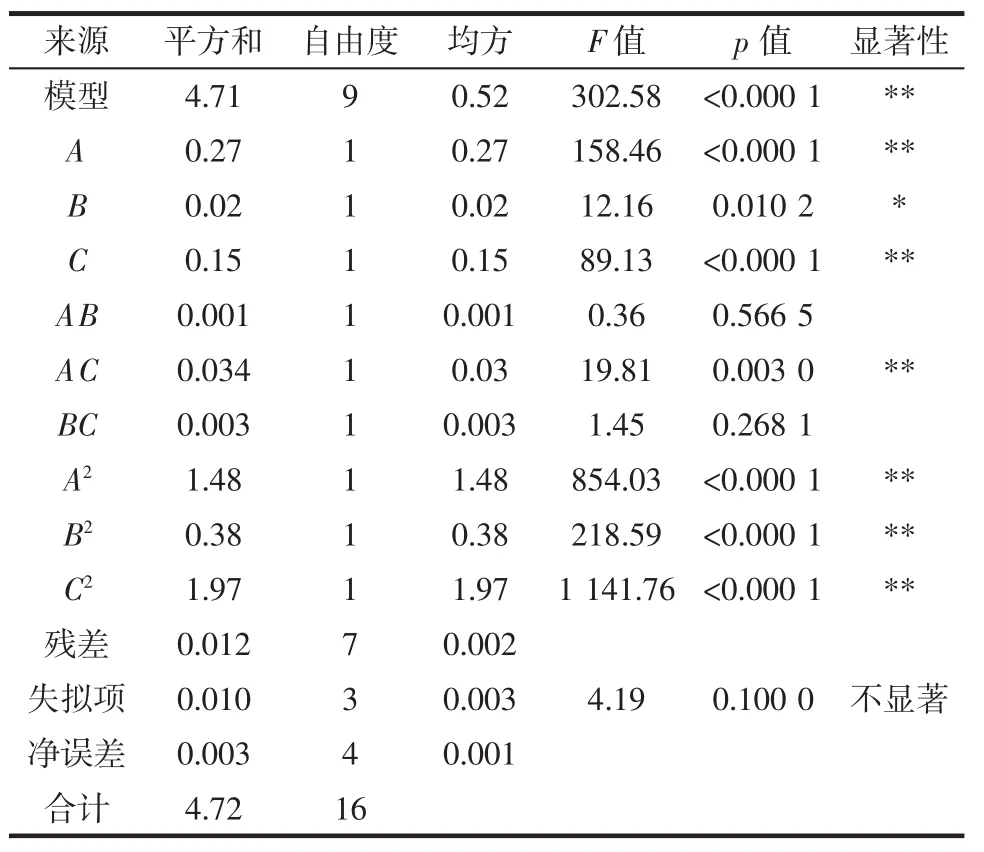
表4 方差分析Table 4 Variance analysis
由表 4可知,F值为302.58,p<0.01,表示该回归模型极显著,拟合情况较好,能够良好地反映出各因素对紫苏叶多糖得率的影响。失拟项p>0.05,表明此模型拟合度良好,非试验因素对试验结果影响不大。相关系数R2和校正决定系数R2(Adj)分别为0.997 4和0.994 1,表示此模型能较好预测紫苏叶多糖得率,试验结果与分析结果差异较小,具有较高的可信度。由F值可知,3个因素对紫苏叶多糖得率的影响程度为A>C>B,即料液比>醇沉浓度>提取时间。
2.2.3 各因素交互作用分析
各因素交互作用的响应面和等高线如图4所示。
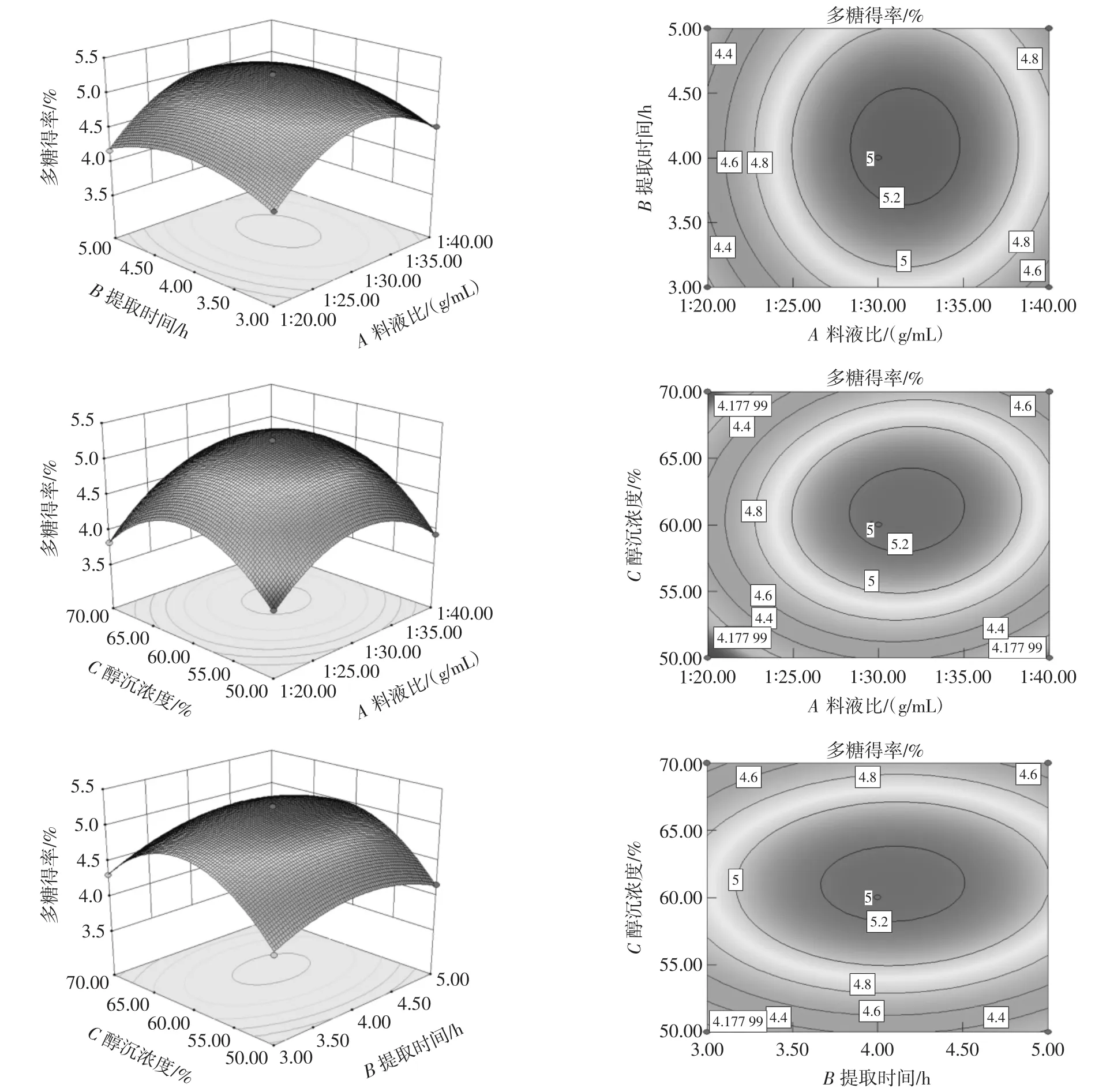
图4 各因素交互作用对多糖得率的影响Fig.4 Effects of interaction of various factors on the yield of polysaccharides
由图4可知,响应面的开口均向下,曲面呈中间凸四周凹的形状,说明曲面有最高点,即存在最优条件。响应面图可以直观反映出各因素对紫苏叶多糖得率的影响,曲面越陡,影响越大,曲面越平缓,影响越小。可以发现料液比与醇沉浓度对紫苏叶多糖得率的影响高于其他2组,且交互作用显著,与表4方差分析结果一致。
2.2.4 验证试验
根据响应面试验得出紫苏叶多糖最佳提取条件为料液比1∶31.66(g/mL)、提取时间4.09 h、醇沉浓度61.14%,此时紫苏叶多糖得率为5.27%。在实际提取过程中将提取修正条件为料液比1∶30(g/mL)、提取时间4 h、醇沉浓度60%,利用修正条件重复3次提取紫苏叶多糖,多糖得率为(5.22±0.17)%。实际得率与预测得率相差较小,说明用此模型预测紫苏叶多糖得率可行。
2.3 紫苏叶多糖的总糖含量测定
根据1.4中试验方法测定葡萄糖标准曲线,结果如图5所示。
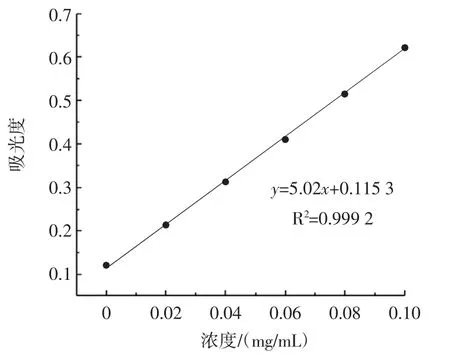
图5 葡萄糖标准曲线Fig.5 Standard curve of glucose
由图5可知,标准曲线回归方程为y=5.02x+0.1153,R2=0.9992,经计算得出PFP总糖含量为(89.73±0.23)%。
2.4 理化特性分析
2.4.1 差示扫描量热分析
差示扫描量热法常被用来检测物质的热稳定性,该方法可以分析不同温度下物质物理性质的变化[25]。图6为PFP的差示扫描量热图。
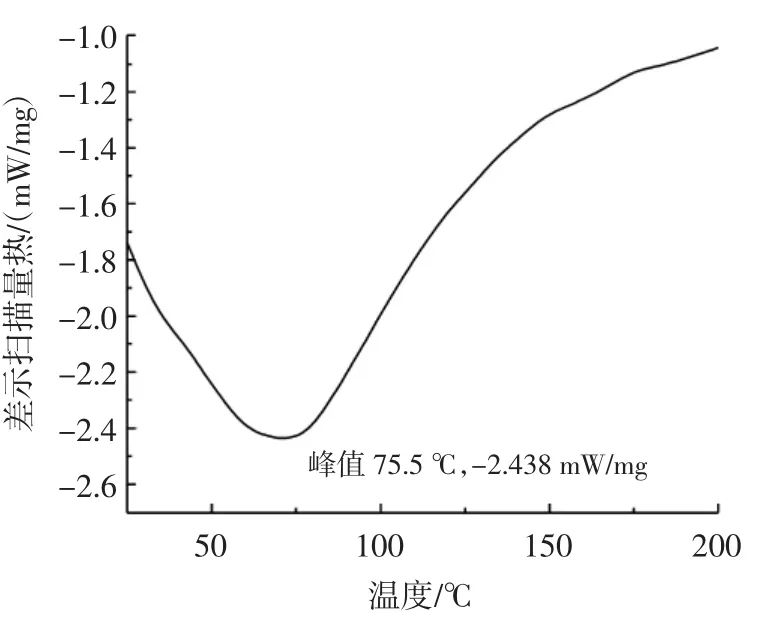
图6 PFP的差示扫描量热图Fig.6 Differential scanning calorimetry spectrum of PFP
由图6可以发现,PFP在75.5℃处出现一个吸热峰,可能是紫苏叶多糖在保存过程中吸潮,水分蒸发而产生。在整个升温过程中,多糖没有出现放热峰,说明紫苏叶多糖具有良好的热稳定性。
2.4.2 热稳定性分析
利用热重分析仪对PFP的热解过程进行检测,结果如图7所示。

图7 PFP的热重结果分析Fig.7 TGA analysis of PFP
由图7可知,PFP的热解过程主要分为2个阶段:第一阶段在44.78℃,出现1个失重峰,这个失重峰可以理解为PFP样品失去了吸附水,失重为9.394%,这可能是由于PFP在制备或者后续样品的较长保存时间中发生了吸潮。第二阶段热解过程在200℃~400℃,此阶段的失重最为明显,表明PFP在200℃~400℃范围内发生剧烈的分解,这同样说明在200℃以下PFP具有较好的热稳定性。
2.4.3 X-射线衍射分析
X-射线衍射图谱能反映样品的晶体结构,晶体结构越强,衍射峰越强。通常晶体会出现尖又窄的特征峰,非晶体的峰型多表现为宽而弥散[26]。图8为PFP的XRD图谱。
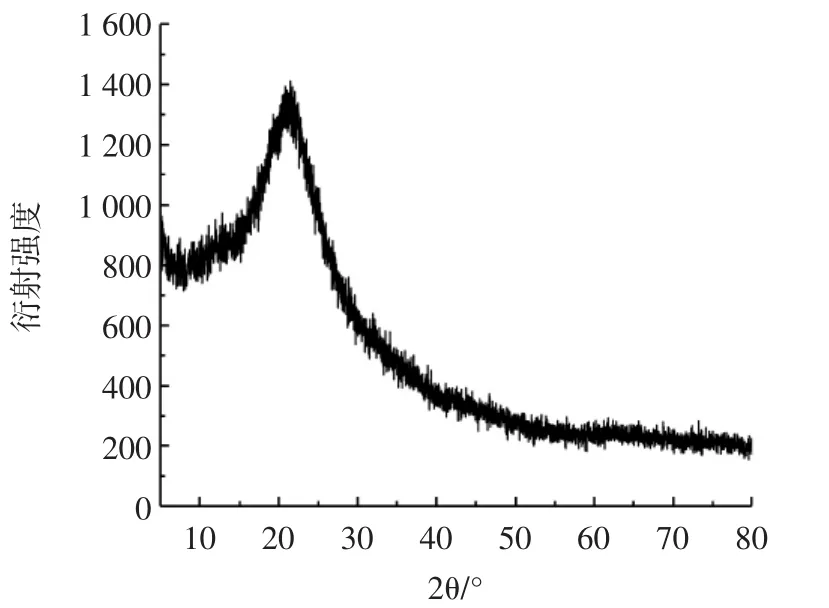
图8 PFP的X-射线衍射结果Fig.8 X-ray diffraction pattern of PFP
从图8可以看出,在21°左右出现1个较宽的衍射峰,这是PFP主要的结晶反射区,谱图中没有尖峰出现,这表明PFP无结晶现象,是一种无定型结构。
3 结论
本研究通过单因素试验和响应面优化确定了紫苏叶多糖的最佳提取工艺条件为料液比1∶30(g/mL)、提取时间4 h、醇沉浓度60%,此条件下得率最高,达到(5.22±0.17)%。经分离纯化后的均一组分多糖PFP的总糖含量为(89.73±0.23)%。理化特性试验结果表明PFP有较好的热稳定性,其热解过程主要分为2个阶段,无结晶现象,是一种无定型结构。总体而言,通过此提取条件得到的紫苏叶多糖得率较高,热稳定性较好,对紫苏叶多糖的研究有进一步探索,并为紫苏叶的应用开发提供一定参考。

