人工智能辅助的年龄相关性黄斑变性眼底像诊断分析*
胡钦瑞 王丽婷 王 斌 李 扬
1 福建省眼表与角膜病重点实验室,福建省厦门市 361000; 2 厦门大学附属厦门眼科中心
年龄相关性黄斑变性(AMD)是发达国家年龄超过50岁人群不可逆转视力丧失的主要原因[1]。 AMD疾病逐渐进展,从早期和中期,几乎没有或仅有微妙的视觉变化,最终患者会发生中心视力损伤,早诊断、早干预是防治AMD的重要手段。多种因素参与AMD的疾病进程。多项国内外研究发现,年龄、性别、种族、遗传等是AMD发生的重要影响因素[2]。目前,人工智能(Artificial Intelligence,AI)基于医疗数据的深度学习已经在眼病领域进行了一系列探索。2016年初,Google DeepMind与英国国家健康体系(NHS)开发了一款用于辅助医生快速查看血液测试结果的软件,以辅助决策并提高效率。同年 JAMA刊登了gulshan团队研究成果,通过深度学习,AI辅助的软件系统对眼底病检测准确率96%[3]。2018年我国张康团队在Cell刊文,开发出诊断眼病和肺炎的AI系统[4],主要对糖尿病性视网膜病变进行AI辅助诊断。
AI已经被应用于老年黄斑变性的检测中,其原理是能够通过观察眼底图像所呈现的玻璃膜疣及视网膜微血管病变体征等,实现对AMD玻璃膜疣的自动检测和量化系统,能够对疾病的客观记录描述,帮助识别和分类AMD患者。目前,相关研究集中在玻璃膜疣的诊断准确率和敏感度的提升方面[5]。但AMD是一个长期、慢性进展的过程,病情复杂,现实场景中的眼底照相质量并不均一,往往受限于场地环境、设备以及受培训人员的技术水平,在真实世界实际应用场景中,获得完美的照相质量相对困难[6],从而影响人工智能辅助诊断。笔者拟通过此次研究,探索图像质量的差异与AI诊断准确率的关系,寻找影响诊断的主要因素,改善医疗技术,进一步提高AI的诊疗准确性,从而提高医疗服务质量。
1 资料与方法
1.1 一般资料 选择2018年1月1日—2019年12月31日在我院筛查的100例年龄相关性黄斑变性患者。本研究经本院医学伦理委员会批准。
1.2 仪器与方法 对100例患者进行眼底照相,由AI进行解读,对诊断的正确度进行评估。按照位置、对焦、准确、曝光程度、睫毛伪影、中心暗影、周边暗影等对眼底图像进行质量评价,分析眼底图像质量与AI诊断准确性的影响。前期研究已经对社区医疗诊疗环境进行整合,保证眼底图像采集人员采集统一规范标准。对眼底图像仪器进行统一。对眼底图像进行分类,由AI进行解读,收集报告内容,对诊断的正确度进行评估。
1.3 观察指标及评价标准 所有纳入样本患者的影像资料均由高年资主治医师审核,并进行OCT图像的验证,确认黄斑病变,与眼底图像进行印证。对患者图像资料质量进行标准分类,包括位置的准确性、对焦是否准确、曝光过强、曝光过弱、镜头污渍、睫毛虚影、边缘漏光、黄斑区暗影、周边暗影、整体影像模糊。根据AI的判定结果分析图像质量与AI评价准确度的关系。
2 结果
2.1 图像效果分析 100例黄斑变性图像,其中拍摄位置不标准为最常见问题占30%,其次为边缘漏光,占27%,未发现镜头污渍表现,未发现过度曝光。
2.2 AI诊断正确度与图像质量的关系 现实场景中AI诊断阳性率86%,AI诊断正确度与眼底照相周边是否有暗影具有统计学相关性。AI诊断阳性率85%。见表1。
3 讨论
年龄相关性黄斑变性(AMD)是一种潜在进展性黄斑病变根据。临床特征可以分为早中期 AMD 和晚期 AMD,早中期主要表现为玻璃膜疣(视网膜下由脂质和蛋白质组成的黄色沉积物)和黄斑区色素改变,通常视力正常或接近正常。晚期则出现中心视力下降或丧失。晚期 AMD 又分为两型:地图样萎缩(或者称为“萎缩性”或“干性”AMD)和新生血管性 AMD(或者称为“湿性”或“渗出性”AMD)。地图样萎缩是黄斑的慢性进行性变性;变性开始于视网膜色素上皮水平,在后期随着相关的视网膜神经感觉层变薄和变性,出现视网膜色素上皮丢失。脉络膜新生血管是指从眼睛血管层(脉络膜)到视网膜神经感觉层的血管异常生长。较小的玻璃膜疣(<63μm,也称为drupelet)是正常的老化改变。中等大小的玻璃膜疣(≥63μm 至<125μm),不伴色素改变,则称为早期AMD。较大的玻璃膜疣(≥125μm)或至少中等大小玻璃膜疣伴色素改变,则为中期AMD。正常老化改变5年进展为晚期AMD 的风险为0.5%,而中期 AMD 则为 50%。此外,现在认为网状假性玻璃膜疣(在光感受器和视网膜色素上皮之间形成的小玻璃膜疣样沉着物)是两种晚期 AMD 形式的前驱病变。年龄性黄斑变性的显著诊断特征为AI辅助提供了充分条件,AI在经过足够的深度学习后,能够对这些显著特征进行区分,即能够对其进行高效识别诊断。但在实际使用中,还有更多细节优化需要注意。
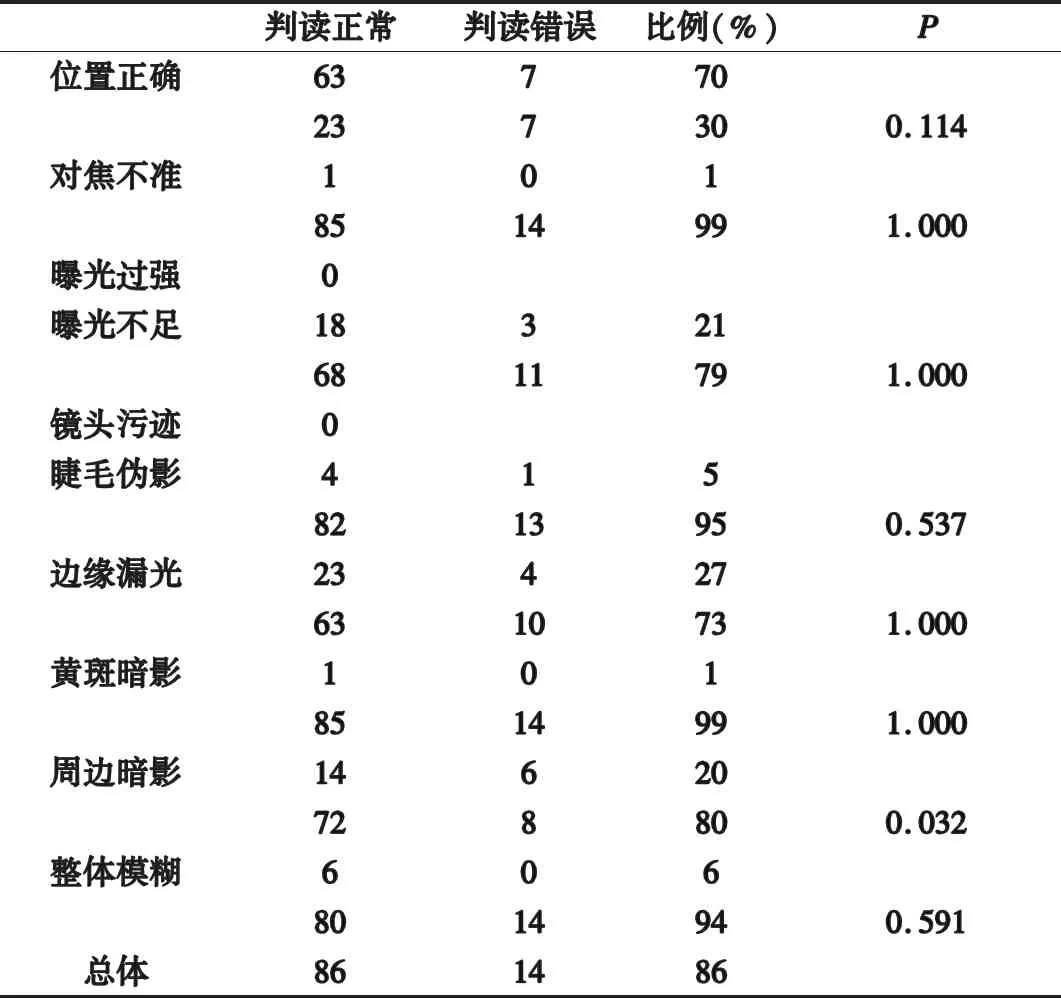
表1 AI诊断正确度与图像质量的关系
研究发现[7],在现实场景应用中,AI诊断正确性与图片的采集质量密切相关。其中周边暗影是影响诊断质量的重要指标,眼底照相采集的眼底各结构位置也可能具有一定意义。眼底图像周边暗影影响了AI的判断[8]。周边区暗影因为在拍摄过程中患者瞳孔过小或者不配合导致的,往往合并位置异常及中心区暗影,影响了细节的定位及判断,导致了机器判读困难。改善这类问题导致的眼底照片判断误差,解决方法之一是发现此类问题,这需要对该类人群进行散瞳处理,执行标准化操作,另外还需要对软件进行进一步的优化分析。
图片是否按照标准位置拍摄是影响AI现实应用的重要的指标,主要以视盘和黄斑区的纳入为主要指标[9]。院内检查多以散瞳对病情进行确认。但社区大规模筛查中,考虑到散瞳的风险及检查人员的培训限制,免散瞳眼底照相成为趋势。这也导致在常规操作中,很难获得一张完美的图像,尤其免散瞳眼底照相更难达到相应要求。现实场景的图片缺失或者缺损部分图像细节,AI以此进行解读,可能会干扰判断准确性。虽然本研究在统计学上并没有发现二者的相关性,但检验水平还是提示位置偏倚可能存在潜在的影响。通过培训来改善获取的图片质量,可能会有益于AI准确度的提升[10]。黄斑区暗影并未显示对AI判读准确率的影响,这体现了AI比人眼的优势,显然临床医生更关注黄斑中心区的结构变化,在肉眼不能分辨的情况下,而AI能够较好地判读,进一步给医生提供了诊疗信息,充分体现了AI的优势。
在眼科学中,基于视网膜图像的自动筛查(automated screening)早已成为AI靶标,为眼科视网膜病变的筛查注入了新的活力[11]。但以上诊断的基础往往以完美的眼底图像进行诊断训练,并没有完美实现对现实场景的呈现。现实场景中诊断正确率受多种因素影响,本文主要针对图像质量采集进行了研究分析。本次研究主要样本量较小,这一定程度上造成了结果的偏倚。另外患者的全身情况会对图像判读产生重要影响[12],但本文中并没有涉及。研究侧重图像质量与AI判读之间的关系。对图像进行质量的分类是一个极其重要的问题,这能促进AI在实际临床应用中的准确性。这也需要专业人员投入一定的精力对实际图片进行多维度的分类,这样能更好地训练AI的临床实际应用。
单一图片的判断可能并不准确,目前更多研究开始注重多重图像联合的AI研究[13]。除了AI在眼底照相图片中的应用以外,应用于OCT的卷积神经网络(Convolutional Neural Networks,CNN)能够成功地区分晚期AMD或糖尿病性黄斑水肿(Diabetic Macular Edema,DME),为多模式诊疗策略提供了可能[14]。
AI目前在正常的眼底图像诊断中发挥了重要的助力,但在现实场景中,存在较多非标准图像,AI诊断的准确率不可避免地下降,这需要针对不同的情况,做好眼底照相的质量控制及AI诊断技术上的改善和调整。

