GC-MS/MS 法测定注射用盐酸吉西他滨中五种甲磺酸酯类基因毒性杂质
钟振华,陈雨萍,程奇珍,夏红英
1.江西省药品检验检测研究院,国家药品监督管理局中成药质量评价重点实验室,江西省药品与医疗器械质量工程技术研究中心,江西 南昌 330029;2.江西省药品检查员中心,江西 南昌 330029
药物中甲磺酸酯类杂质主要是在原料药(API)合成过程由甲磺酸或甲磺酰氯与残留的甲醇、乙醇等醇类试剂反应而产生[1]。目前甲磺酸甲酯已被世界卫生组织明确为2A 类致癌物,甲磺酸乙酯已被明确为2B 类致癌物[2-3],其余的甲磺酸酯类化合物因存在疑似基因毒性杂质结构,在药物分析中也被重点关注。按照欧洲药物评审机构(EMEA)及国际人用药品注册技术协调会(ICH)所发布的关于基因毒性杂质指导原则的规定,甲磺酸酯类物质毒理性方面的阈值(TTC)为1.5 μg/d[4-6]。
注射用盐酸吉西他滨主要用于治疗胰腺癌及非小细胞肺癌,具有抗肿瘤谱广、药物毒性低、无交叉耐药等优点,为人工合成的新型二氟核苷类抗肿瘤药[7-9]。从国内盐酸吉西他滨原料药制备工艺流程分析,盐酸吉西他滨合成过程中所用到活化剂甲磺酰氯以及醇类溶剂容易反应产生甲磺酸酯类杂质,易造成注射用盐酸吉西他滨含有甲磺酸酯类杂质的可能[10-11]。因此,在微量水平上建立注射用吉西他滨中甲磺酸酯类基因毒性杂质的定性定量方法用于日常检验或药品质量控制是非常有必要的。
本研究通过气相色谱-串联三重四级杆质谱仪(GC-MS/MS)建立了注射用吉西他滨中甲磺酸甲酯、甲磺酸乙酯、甲磺酸异丙酯、甲磺酸丙酯及甲磺酸丁酯等五种甲磺酸酯类杂质的定性定量测定方法。本方法采用具备灵敏度高、准确性和特异性强等优势的多反应监测(MRM)模式监测,能够降低药物基体效应对待测成分的干扰,从而保证检测方法灵敏度高、专属性强,达到了在微量水平上准确检测甲磺酸酯类杂质的要求,为保障用药安全提供技术参考[12-17]。
1 实验部分
1.1 仪器、对照品及试剂
气相色谱-质谱仪(7890B-7000C,安捷伦)。二氯乙烷(1,2-二氯乙烷)(TCI Shanghai,批号:P1529190,色谱纯),乙酸乙酯(LiChrosolv,批号:10942649812,色谱纯)。甲磺酸甲酯对照品(SIGMAALORICH,批号:MKCG1346,含量:>99%),甲磺酸乙酯对照品(SIGMA-ALORICH,批号:BCBW8635,含量:>99%),甲磺酸异丙酯对照品(Thermo Fisher,批号:A031422,含量:>98.0%),甲磺酸丙酯对照品(TCI Shanghai,批号:G6G6L-OM,含量:>99%),甲磺酸丁酯对照品(J&K Scientific,批号:LS20S35,含量:>98.5%)。
1.2 样品信息
注射用吉西他滨样品涉及6 家生产企业16 批次样品,规格均为0.2 g。分别为A 企业5 批次样品,样品批号分别为181021、181123、181116、181122、181211;B 企业2 批次样品,样品批号分别为E1811012、E1 810012;C 企业3 批次样品,样品批号分别为181214、190107、181210;D 企业2 批次样品,样品批号分别为181026、181025;E 企业2 批次样品,样品批号分别为20180706、20 180705;F 企业2 批次样品,样品批号分别为AA1D8020B、AA1D8024B。
1.3 仪器条件
色谱柱:VF-624 ms 石英毛细管柱(60 m×0.25 mm×1.4 μm);测定条件:色谱柱柱温:起始温度为120 ℃,以10 ℃/min 的升温速率将柱温升温至250 ℃,保持5 min;进样口温度:250 ℃;载气柱流速:1.0 mL/min;进样模式:分流进样;分流比:10∶1;进样量:1 μL;EI 源温度:230 ℃;EI 源能量:70 eV;延迟时间:6.5 min。
离子对选择及碰撞能信息见表1。

表1 甲磺酸酯5种MRM模式参数及碰撞能
1.4 实验方法
系列质量浓度对照品溶液的配制:取甲磺酸甲酯对照品、甲磺酸乙酯对照品、甲磺酸异丙酯对照品、甲磺酸丙酯对照品及甲磺酸丁酯对照品各10 mg,精密称定,置同一10 mL 量瓶中,加入二氯乙烷5 mL 振摇使溶解,并用二氯乙烷稀释至刻度,摇匀,精密量取1 mL,置200 mL 量瓶中,用二氯乙烷稀释至刻度,摇匀,作为对照品混合贮备液(约5 μg/mL);精密量取对照品混合贮备液0.5、1、2、3、4、5、6 mL,分别置100 mL 量瓶中,用二氯乙烷稀释至刻度,摇匀,作为混合对照品溶液①~⑦;即得各待测成分浓度约为25、50、100、150、200、250、300 ng/mL 系列对照品溶液。
样品溶液的配制:取待测样品(F 企业,批号:AA1D8024B)6 瓶(约相当于盐酸吉西他滨1.2 g),用25 mL 二氯乙烷将样品内容物洗至同一50 mL 量瓶中,再加二氯乙烷15 mL,超声处理30 min,放冷至室温,用二氯乙烷稀释至刻度,摇匀,滤过,取续滤液作为样品溶液。
测定法:量取系列质量浓度对照品溶液及样品溶液,分别注入气相色谱-质谱仪分析测定,记录色谱图,按标准曲线法计算得各待测成分的含量。
2 结果与讨论
2.1 色谱及质谱条件优化
2.1.1 溶剂优化通过比较乙酸乙酯、二氯乙烷两种溶剂,进行溶剂优化。结果显示:在乙酸乙酯、二氯乙烷两种溶剂中盐酸吉西他滨均较难溶解,但各待测成分在上述2种溶剂中溶解性均较好。检测中发现:乙酸乙酯作为溶剂,甲磺酸甲酯峰容易受溶剂峰的干扰,色谱峰前后噪声较大,导致甲磺酸甲酯灵敏度较低。而用二氯乙烷作为溶剂时,甲磺酸甲酯无溶剂峰干扰,基线噪声较低,各待测成分灵敏度较高。详见图1、图2。

图1 二氯乙烷为提取溶剂时对照品溶液色谱图

图2 乙酸乙酯为提取溶剂时对照品溶液色谱图
2.1.2 色谱柱优化通过比较DB-5ms(30 m×0.25 mm×0.25 μm)、VF-624ms(60 m×0.25 mm×1.40 μm)、VF-WAXms(60 m×0.25 mm×0.25 μm)三种不同填料的毛细管色谱柱,进行色谱柱优化。结果显示:采用DB-5ms 毛细管色谱柱时,溶剂峰会干扰甲磺酸甲酯的测定,导致其灵敏度较低;采用VF-WAXms 及VF-624ms 毛细管色谱柱均能实现5 个待测成分的较好分离,且溶剂峰不会干扰待测成分的测定。从分离度评价,采用VF-624ms 毛细管色谱柱,各待测成分峰分离度更好。
2.2 线性关系、检出限、定量限
取系列质量浓度的对照溶液,按“1.4”项下测定法测定,记录离子谱图,以各对照品溶液质量浓度为横坐标,以各对照品溶液定量离子丰度为纵坐标绘制相应的标准曲线。线性关系结果详见表2。取“1.4”项下质量浓度约为25 ng/mL 的混合对照品溶液①,作为定量限溶液,注入气相色谱-质谱仪分析测定,各待测成分峰信噪比约为10∶1;精密量取“1.4”项下质量浓度约为25 ng/mL 的混合对照品溶液①适量,用二氯乙烷定量稀释至各待测成分浓度约为12.5 ng/mL 的溶液作为检出限溶液,注入气相色谱-质谱仪分析测定,各待测成分峰信噪比约为3∶1;结果详见表2。
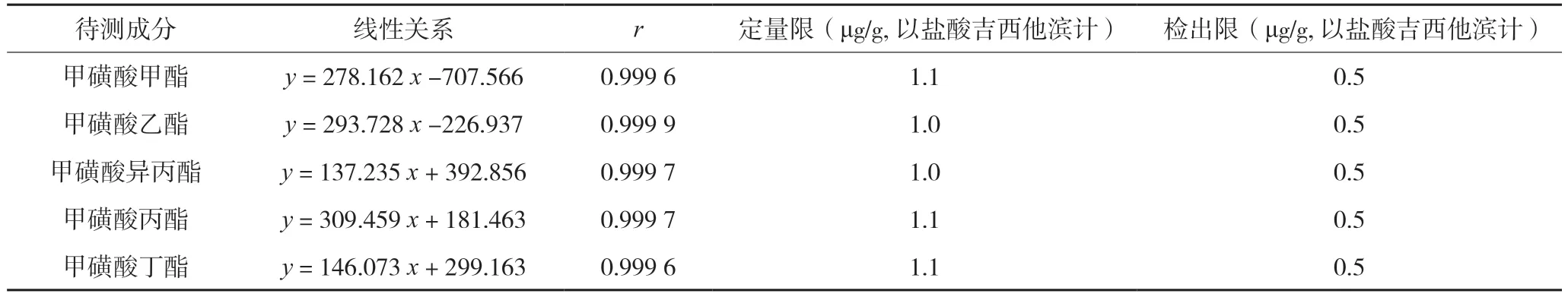
表2 待测成分线性关系结果
2.3 回收率实验
回收率实验供试品溶液:取待测样品6 瓶(约相当于盐酸吉西他滨1.2 g),用25 mL 二氯乙烷将样品内容物洗至同一50 mL 量瓶中,同法制备9 份,分别精密加入“1.4”项下各待测成分质量浓度约为5 μg/mL 的对照品混合贮备液1、1、1、1.5、1.5、1.5、2、2、2 mL,加二氯乙烷15 mL,超声处理30 min,放冷至室温,用二氯乙烷稀释至刻度,摇匀,滤过,取续滤液,作为回收率样品溶液。按“1.4”项下测定法测定,结果见表3。

表3 回收率实验结果 %
2.4 精密度试验
取“1.4”项混合对照品溶液④,按“1.4”项下测定法重复进样测定6 次,记录测定结果。结果详见表4,结果显示:各待测成分精密度RSD 在0.30%~1.87%之间,表明仪器精密度良好。

表4 精密度试验结果
2.5 重复性试验
取待测样品6 瓶(约相当于盐酸吉西他滨1.2 g),用25 mL 二氯乙烷将样品内容物洗至同一50 mL 量瓶中,同法制备6 份,精密加入“1.4”项下各待测成分质量浓度约为5 μg/mL 的对照品混合贮备液1.5 mL,加二氯乙烷15 mL,超声处理30 min,放冷至室温,用二氯乙烷稀释至刻度,摇匀,滤过,取续滤液测定。结果显示:6 份样品溶液中各待测成分重复性RSD(n=6)在0.87%~2.32%之间,表明样品测定重复性良好。结果详见表5。
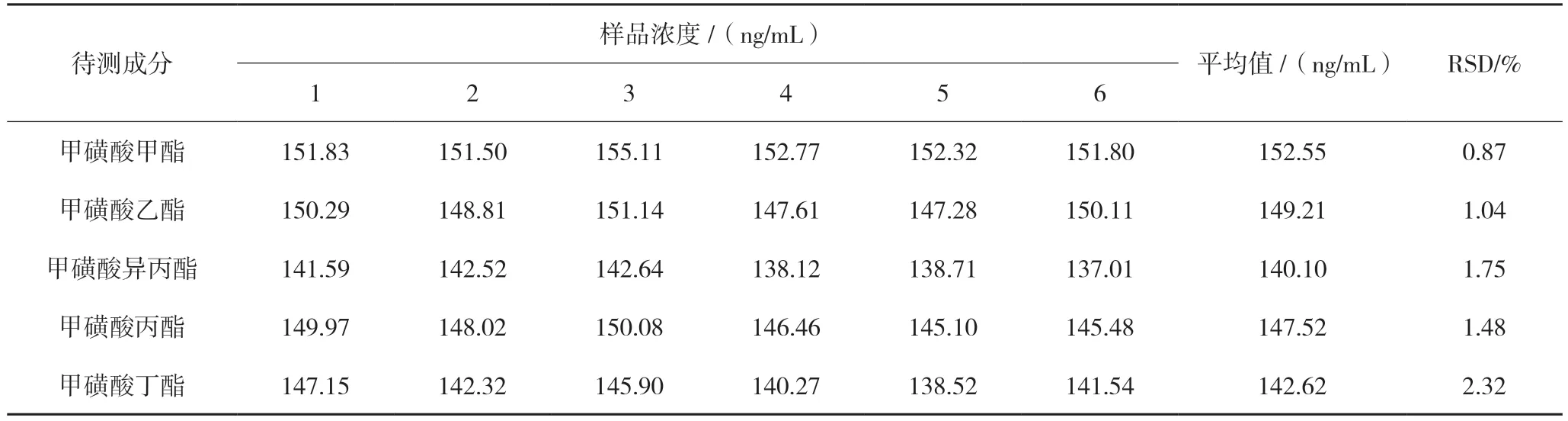
表5 重复性试验结果
2.6 稳定性试验
取待测样品6瓶(约相当于盐酸吉西他滨1.2 g),用25 mL 二氯乙烷将样品内容物洗至同一50 mL 量瓶中,精密加入“1.4”项下各待测成分质量浓度约为5 μg/ mL 的对照品混合贮备液1.5 mL,加二氯乙烷15 mL,超声处理30 min,放冷至室温,用二氯乙烷稀释至刻度,摇匀,分别在0、2、4、6、8、10、12、24 h 时取样滤过,取续滤液测定,考察样品溶液的稳定性。结果显示,24 h 内,重复性样品溶液中各待测成分稳定性RSD 在0.76%~1.77%之间,表明在24 h 内样品溶液稳定性较好。结果详见表6。

表6 稳定性试验结果
2.7 样品测定结果
16 批次注射用吉西他滨样品中五种甲磺酸酯类基因毒性杂质均未检出(或低于检出限)。
3 结论
根据EMEA 和ICH 发行的关于基因毒性杂质控制的相关指导原则要求,按药物每日最大摄入量(MDD)计算,甲磺酸酯类基因毒性杂质的TTC 为1.5 μg/d。注射用盐酸吉西他滨的最大注射用量为成人一周1 000 mg/m2,按照成年人平均人体表皮面积以1.6 m2计,单个甲磺酸酯类基因毒性杂质在注射用盐酸吉西他滨中的限度应不得过6.6 ppm。注射用盐酸吉西他滨中加入大量甘露醇等赋性剂,为保证提取充分,盐酸吉西他滨与提取溶剂的质量体积比为0.024 g/mL,以此计算五种待测成分的限度浓度为158 ng/mL,为“2.2”线性关系实验的中间浓度点。从样品测定结果得知,本次16 批次注射用盐酸吉西他滨样本中五种甲磺酸酯类基因毒性杂质均未检出。
通过方法学验证可知,五种待测成分的线性浓度均设置在25~300 ng/ mL,线性范围较宽,且线性相关性好;定量限约为1.0 μg/kg,检出限约为0.5 μg/kg,方法灵敏度较高;回收试验结果表明各待测成分平均回收率为93.04%~100.41%,RSD(n=9)均小于3.0%,方法准确度较高;各待测成分重复性RSD 为0.87%~2.32%,精密度RSD 为0.30%~1.87%,均表现良好。综上所述,本方法具有专属性强,线性相关性好,准确度及灵敏度高的优点,适用于注射用盐酸吉西他滨中五种甲磺酸酯类基因毒性杂质的检测分析。

