枸橼酸托法替尼脂质体的制备与初步评价
钱洋伟,舒 幻,方宇镱,沈奇英
(杭州师范大学药学院,浙江 杭州 311121)
0 引言
类风湿性关节炎(Rheumatoid Arthritis,RA)是一种全身性的自身免疫性疾病,具有病因不明、持续反复发作的特点[1-3],严重影响患者的运动和生活质量.RA高发于30~50岁,全球发病率为1%,我国发病率约3%~5%[4-5].目前临床上治疗RA以药物治疗为主,在降低全身及局部炎症水平、缓解症状、延缓疾病进展等方面取得了一定效果,但仍有患者无应答,或因发生不良反应而不能应用[6].
枸橼酸托法替尼(tofacitinib citrate,TOF)适用于中至重度的活动性RA患者[7].目前TOF的上市剂型为片剂,缺乏病变部位的特异性靶向作用,导致用药后往往出现胃肠道反应、上呼吸道感染等不良反应,因而有必要改变其剂型以弥补以上缺点.脂质体制备方法简单,生物相容性好.因此,我们将TOF制成脂质体,一方面解决了TOF口服带来的不良反应,另一方面提高了TOF靶向RA病变部位的能力,有利于RA的药物靶向治疗.
1 实验材料与仪器
1.1 实验材料
枸橼酸托法替尼(上海博氏医药科技有限公司),磷脂(Lipoid GMBH),胆固醇(国药集团化学试剂有限公司),DMEM高糖培养液(杭州启真湖生物科技有限公司),胎牛血清(浙江天杭生物科技有限公司),弗氏完全佐剂(Sigma),噻唑蓝溴化四唑(阿拉丁).
1.2 实验仪器
旋转蒸发仪(RE-52AA,上海亚容生化仪器厂),Anton paar litesizer 500型Zeta电位粒径分析仪(奥地利安东帕中国有限公司),全自动酶标仪(Biotek Instruments,美国伯腾仪器有限公司北京代表处),透射电子显微镜TEM (JEM2100,日本电子株式会社),高效液相色谱仪(High Performance Liquid Chromatography,HPLC).
2 TOF脂质体的工艺研究与评价
2.1 TOF脂质体的工艺研究
HPLC色谱条件:色谱柱为Technologies, Diamonsil(钻石) C18(200 mm × 4.6 mm,5μm)柱;流动相为乙腈-水(体积比为30∶70);流速为1.0 mL/min,检测波长为285 nm;柱温为25 ℃;进样量为20 μL.
选用pH梯度法制备载药脂质体.首先采用薄膜分散法制备空白脂质体,在茄形瓶中放置一定比例的卵磷脂和胆固醇,加入适量无水乙醇溶解,经旋蒸形成薄膜,加入pH3.5柠檬酸-柠檬酸盐缓冲液水化,冰浴下探头超声20 min(600 W,工作3 s/间隔3 s),得到空白脂质体.然后用Na2CO3溶液调至一定pH后加入TOF溶液,于60 ℃水浴中孵育10 min,得到TOF脂质体(TOFL).
在单因素的基础下,探究药脂比、膜材比、外水相pH对TOFL的包封率的影响,采用HPLC法测定药物峰面积,从而筛选优势处方.包封率与载药量计算公式如下:
其中A超滤前:超滤前超滤管内管液体的峰面积;A超滤后:超滤后滤下的液体的峰面积.
2.2 TOF脂质体的评价
2.2.1 粒径分布及其电位、电镜
按优势处方制备TOFL,使用电位粒径分析仪测定其粒径、多分散性指数和Zeta电位;取少量脂质体滴于覆有碳膜的铜网上,滤纸吸干后,再用醋酸双氧铀负染30 s,自然晾干后于透射电镜下观察其形貌特征.
2.2.2 体外释放
根据优势处方制备TOFL,采用透析袋法评价该脂质体的体外释药性能.释放条件:释放介质pH7.4 和pH5.5的磷酸盐缓冲液(Phosphate Buffered Saline,PBS),温度(37±0.5) ℃,速度100 r/min.在预定时间取样,取样量为1 mL,每次取样后补充等量新鲜释放介质,样品离心后取上清进样,采用HPLC法测定,并记录峰面积(A),计算实际浓度(C),计算累计释放百分率.
2.2.3 细胞活性评价
巨噬细胞(RAW264.7)培养在含有体积分数10%的胎牛血清的DMEM培养基中(含青霉素、链霉素质量浓度各为0.1 mg/mL),孵育条件为37 ℃,体积分数为5% CO2.
采用四甲基偶氮唑蓝(Methyl Thiazolyl Tetrazolium,MTT)法检测细胞活性[8].将对数生长期的RAW264.7细胞以5 000每孔的密度接种于96孔板上,孵育过夜贴壁,不同浓度空白脂质体处理48 h后,于各孔内加入质量浓度为5 mg/mL的MTT 33 μL并放置于培养箱内继续培养4 h后倒出孔内液体,每孔内分别加入200 μL 二甲亚砜(Dimethyl sulfoxide, DMSO),采用酶标仪在570 nm处测量各孔吸光度,并计算细胞存活率.
2.2.4 RA部位初步靶向性考察
为了较直观地观察脂质体在RA小鼠关节部位的分布情况,选用整体器官荧光成像方法进行评价.以ICR小鼠为实验对象,将0.1 mL弗氏完全佐剂皮下注射至小鼠右后爪中,构建类风湿关节炎小鼠模型[9].以近红外荧光染料吲哚菁绿(Indocyanine green, ICG)替代TOF制备脂质体,设立游离ICG和ICG脂质体组,经尾静脉注射6 h后处死(ICG剂量为1 mg/kg),收集其关节,比较不同制剂给药后关节处的荧光强度.
2.2.5 小鼠体内初步药效学评价
将15只RA小鼠随机分成3组,每组5只,设立PBS组、游离TOF组、TOFL组,经小鼠尾静脉注射给药(TOF剂量为1.8mg/kg),每2天给药1次,连续给药7次,并以正常组为对照.治疗结束后,采用游标卡尺测量各组后爪足掌的厚度,评估其肿胀程度,以初步评价治疗效果.
3 结果
3.1 膜材比对包封率的影响
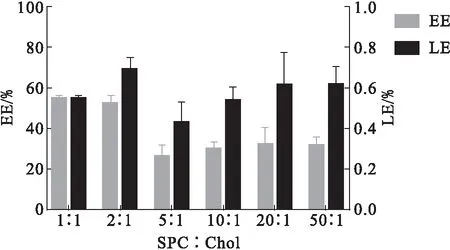
图1 膜材比对包封率的影响Fig.1 The effect of membrane material ratio on EE
膜材比(卵磷脂∶胆固醇)对包封率影响如图1所示,由图可知,当膜材比为1∶1和2∶1时包封率相对较高,达到50%以上,膜材比为2∶1时的载药量比1∶1时高,且膜材比1∶1时旋蒸成膜后极难振荡脱落,细胞粉碎机超声脂质体几乎没有乳光,且外观形态较差,所以选择卵磷脂∶胆固醇比为2∶1作为最优膜材比.
3.2 外水相pH对包封率的影响
外水相对包封率的影响结果见图2,由图可看出,在外水相pH为8时有较高包封率达到75.78%.所以选择外水相pH为8作为最优外水相pH.
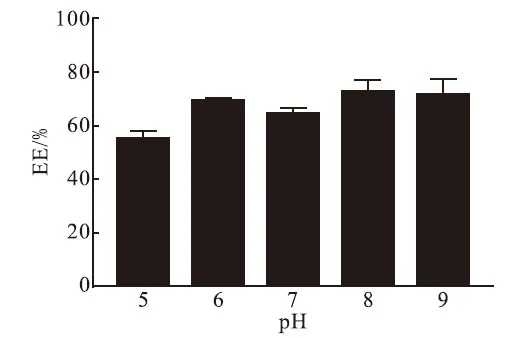
图2 外水相pH对托法替尼脂质体包封率的影响Fig.2 The effect of exterior pH on EE of TOFL
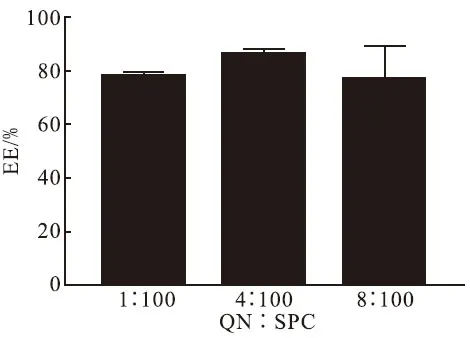
图3 药脂比对包封率的影响Fig.3 The effect of drug to lipid ratio on EE
3.3 药脂比对包封率的影响
药脂比对包封率影响结果如图3所示,可见在TOF∶SPC比例为4∶100时有较高包封率达到88.40%,所以选择药脂比为4∶100作为最优药脂比.
综上所述,我们得出的最优条件为:脂质体的内水相为柠檬酸-柠檬酸钠水溶液(pH3.5)时,药物与磷脂的质量比为4∶100,胆固醇与磷脂质量比为1∶2,外水相用Na2CO3最终调至pH8.0.
3.4 粒径分布电位、电镜
脂质体粒径分布图及透射电子显微镜下的结果见图4.由粒径分布图(图4A)可知,TOF脂质体的平均粒径56 nm,多分散指数20.1%,说明脂质体粒径分布均匀.由透射电镜图4B可见TOF脂质体粒径50 nm左右,外观接近球形,分布较为均匀,与粒径分布结果相吻合.
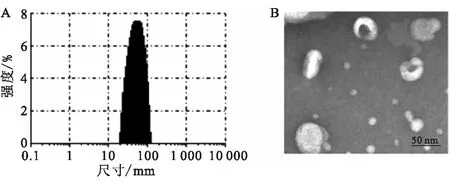
图4 托法替尼脂质体的粒径分布图(A)及电镜图(B)Fig.4 (A) The size distribution and (B) TEM of TOFL
3.5 体外释放
TOF的累积释放百分率如图5所示,由实验结果可知,托法替尼在pH5.5PBS中释放速度较快,可见TOF脂质体更倾向于在较低pH值下释药.TOF脂质体在生理条件下显示出一定的缓释效果,有利于其在体循环中保持相对稳定,靶向至弱酸性的RA部位再释药.

图5 托法替尼脂质体在pH7.4和pH5.5磷酸盐缓冲液中的累积释放百分率Fig.5 Cumulative percentage of TOFL released in PBS pH7.4 and pH5.5

图6 不同浓度空白脂质体对RAW264.7细胞作用48 h后的细胞活性Fig.6 Cell activity of RAW264.7 treated with different concentrations of blank liposomes for 48 h
3.6 细胞活性评价
MTT实验结果如图6所示,由结果可知,空白脂质体在质量浓度不超过500 μg/mL条件下,细胞活性接近90%,说明空白脂质体对细胞活性基本无影响,毒性小,有利于利用其来载药.
3.7 RA部位初步靶向性考察
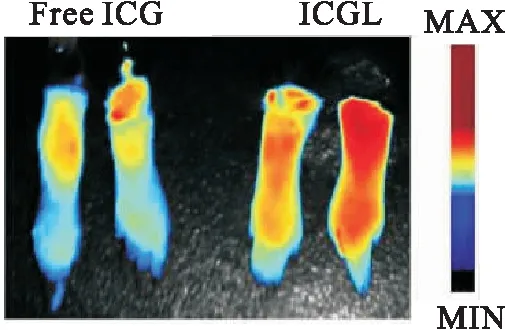
图7 RA小鼠分别注射游离吲哚菁绿、吲哚菁绿脂质体6 h离体关节荧光分布图片Fig.7 Fluorescence distribution of isolated joints of RA mice 6 h after injection of ICG or ICGL
采用整体器官荧光成像方法初步考察游离ICG(Free ICG)和ICG脂质体(ICGL)在RA部位的靶向分布,实验结果如图7所示,在给药6 h时,与Free ICG比较,ICGL组小鼠RA关节部位的荧光信号更强,说明经脂质体载药后可以增加药物在RA部位的富集,有利于RA的药物靶向治疗.
3.8 小鼠体内初步药效学评价
治疗结束后,各组小鼠足掌厚度情况如图8所示.由图8可知,与正常组相比,PBS模型组的足掌厚度显著增加;与PBS模型组相比,经Free TOF和TOFL治疗后小鼠的足掌厚度有不同程度减少,尤其是TOFL组的减少程度更明显.这可能是TOFL被动靶向至RA部位后,在炎性关节部位释放TOF实现其靶向治疗,因此显示出比Free TOF更好的缓解足掌肿胀的效果.
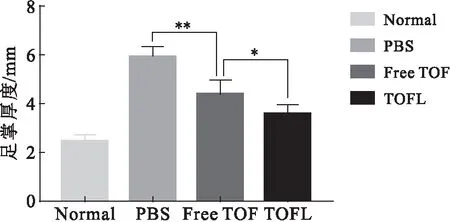
图8 治疗结束后各组小鼠的足掌厚度(**P<0.01,*P<0.05)Fig.8 Paw thickness of mice in each group after treatment
4 讨论
RA引起关节肿胀、多关节受累、关节畸形以及关节周围和全身的骨质疏松等病状,严重影响患者生活质量和运动能力.RA发病机制较为复杂,世界卫生组织将RA列为疑难症之一.目前临床上RA治疗的药物有改变病情药、糖皮质激素和非甾体抗炎药,主要用于控制RA的进展[10].与传统抗RA药物相比,TOF不仅能够缓解症状,还能缓解或直接停止RA的损害.但是,口服TOF治疗RA的患者大多出现胃肠道反应,易引起上呼吸道感染等不良反应,因而有必要改变其剂型以弥补以上缺点.基于纳米技术和医学交叉研究的纳米医学近年来迅猛发展,为重大疾病的诊疗提供了新的机遇[11].研究表明,纳米微粒在类风湿性关节炎的诊断、预防及治疗等方面具有一定优势[12].类风湿关节炎发生部位具有类似肿瘤血管的EPR效应,且血管新生伴随着RA的整个病程[12-13].这些病理特征为纳米微粒系统被动靶向RA病变部位提供了可能性.用于药物递送的纳米载体种类繁多,其中脂质体是纳米制剂中一种常用载体,自莱门等人[14]在1971年开始将脂质体用作药物载体以来,该载体系统得到了广泛的研究与应用.
实验采用pH梯度法制备TOF脂质体,并采用单因素法筛选出TOF脂质体的优势处方.体外释放实验表明,TOF脂质体在pH7.4 PBS释放介质中具有一定的缓释作用,有利于将药物递送至RA部位再释放药物.细胞活性实验可看出,空白脂质体在实验浓度范围内对细胞活性几乎没有影响,有利于作为载体进行给药.由整体器官荧光成像结果可知,ICG脂质体组小鼠RA部位的荧光信号显著强于游离ICG组,说明脂质体可以增加药物在RA部位的富集.初步药效研究表明,与Free TOF相比,TOFL减少足掌厚度的能力更强,可能是TOFL具有靶向治疗RA的作用,因此显示出更好的抗RA效果.综上所述,优势处方制得的TOFL能较好减轻RA小鼠的足掌肿胀程度.

