拟南芥花梗臂发生机制的研究进展
王 玥,顾芝瑕,杨正朝,章鹏程,吴玉环,俞志明
(杭州师范大学生命与环境科学学院,浙江 杭州 311121)
植物绝大多数在固定的地方生长,它们只能主动去适应周围环境的变化.为了克服外界的各种危害,植物进化出一套非常高效的调控网络,使之能对环境变化做出更快速的响应.植物的这些适应机制有些不易被发现:如基因表达水平的改变或代谢产物的浓度变化[1];有些是显而易见的:如质量性状或数量性状[2-3].搞清楚植物这些变化规律,将对创制智能型植物具有重要的指导意义.
截至目前,拟南芥仍然是研究最深入的模式植物.经过数十年的研究,人们对拟南芥各个器官的发育机制都有了相对清晰的认识.而随着单细胞转录组测序技术的发展,拟南芥研究又从分子水平回到细胞水平[4-7].正当人们认为拟南芥的研究已进入前所未有的深度时,最近,美国宾夕法尼亚州立大学Timothy E. Gookin等人历经10余年,对一个非常不起眼的新器官(连接主茎和花柄,使花柄与主茎之间产生物理间隔)进行了深入的研究,并给这个新器官赋予了一个新名词:Cantil[8].根据其名称含义及其生物学的功能,我们给这个新器官起名为:花梗臂.花梗臂主要位于拟南芥顶部开花区及中间直立主茎区附近(图1).本文将对花梗臂的发现历程以及调控机制进行梳理与总结.
1 模式植物拟南芥
1873年,Alexander Braun首次在柏林田野里发现拟南芥ag(AGAMOUS)突变体[9].1907年Friedrich Laibach确定了拟南芥有5对染色体[9],并于1943年首次提出可将拟南芥作为模式植物[10].1947年Erna Reinholz利用X射线诱变的方法,得到了更多的拟南芥突变体[9].但此后很长一段时间,拟南芥都不被学术界所看好,因为当时的科学家认为,拟南芥的染色体偏小,矮牵牛和烟草更适合做组织培养[9].
随着分子生物学的蓬勃发展,从20世纪80年代开始,历经多次否定的拟南芥逐渐地被科学家们广泛使用[10].1986年首次获得拟南芥转基因植株[9-10], 1991年进行的拟南芥花发育的研究,并提出了花形态发生的ABC模型[11];2000年12月在拟南芥(Col-0)中完成了植物第一个全基因组测序[12];2003年,利用转基因技术建立了T-DNA插入突变体库(Col-0背景)[13].从此奠定了拟南芥模式植物的地位.拟南芥生长周期短、培养所需空间少、种子多、易进行大规模诱变[14]、转化方法简单[15],同时在代谢工程、基因表达、生物合成等方面扮演着重要角色[16].拟南芥的种种优点,极大地推进了植物基因功能研究的发展.

红色虚线框内标识的即为花梗臂,角A为花梗臂与花柄之间的夹角.图1 拟南芥新器官———花梗臂Fig.1 Cantil, a new organ of Arabidopsis thaliana

红色虚线框内标识的即为花梗臂,角A为花梗臂与花柄之间的夹角.图2 拟南芥初生茎的横切面Fig.2 The cross section of Arabidopsis primary stem
2 拟南芥的主要器官
2.1 茎的组织结构
拟南芥的茎支撑着叶片、花朵、果实.根吸取的水分、无机盐等营养成分通过茎输送到地上部,s光合产物又通过茎转运至根、花及果实等“库”内,茎还能储存糖类等营养物质.拟南芥的初生茎主要包括表皮、皮质、韧皮部、形成层、木质部、髓等部分(图2)[17].
2.2 拟南芥其他器官
拟南芥根扎于土壤中,不仅起到支持作用,还能吸收土壤中的水分和养分来维持植物的生长和发育[18].拟南芥根包括胚胎期间产生的初生根、从初生根发育而来的侧根,起源于芽、根连接处的不定根.初生根又分为分生区、伸长区和成熟区.成熟区最典型的特征是长有根毛[19].初生根的根尖区主要包括根冠、静止中心、中柱、内皮层、皮层、表皮等[20].
拟南芥叶是枝条系统中最特殊的器官之一,它是光合作用和呼吸作用最主要的场所.叶片由表皮细胞、栅栏组织、海绵组织、保卫细胞等不同类型的细胞组成[21].
拟南芥花由萼片、花瓣、雄蕊和雌蕊4部分组成,他们排列成同心圆或者轮生.拟南芥花器官是典型的ABC模型[22].
通过双受精后,拟南芥种子开始发育,从而形成胚、胚乳、种皮[23].
3 花梗臂的结构特征及分布
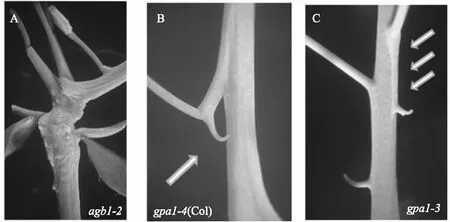
通常情况下,拟南芥侧枝直接从主茎处延伸出来,基部与主茎紧密相连.而花梗臂则是从拟南芥主茎上伸展出来的一个延长臂,支撑着花枝生长,形成于花序发育早期,主要出现在中间偏上的开花区域(图3中的b-c交接处),花柄和花梗臂之间的角度在25—90°之间(图1中的角A所示)[8].

a.拟南芥莲座叶, b.直立主茎区, c开花区.
4 花梗臂形成的环境因素
花梗臂出现频率不高,又比较隐蔽,因此直到最近才引起重视.研究发现,短日照条件下,在68株Col-0(Columbia-0)植株中发现了157个花梗臂,在68株Ws (Wassilewskija)植株中发现了14个花梗臂,而在71株Ler(Landsbergerecta)中则未发现花梗臂[8].在长日照的条件下(16 h/8 h),727棵Col-0植株中仅有2个花梗臂,而在Ws和Ler中没有发现.因此,日照长度是影响花梗臂形成的一个关键因素,短日照条件下花梗臂出现概率更高[8].
5 花梗臂调控基因
截至目前,通过对现有突变体进行表型观察,并从这些突变基因中回推其可能的调控机制,产生花梗臂的分子机制研究非常有限.现有的研究表明,AtMYB13(Myeloblastosis)[24]、ROTUNDIFOLIA4(ROT4)[25]及DEVIL9(DVL9)(ROTUNDIFOLIA4-LIKE/DEVIL)[26]过表达后均能产生花梗臂.而G蛋白复合体,ERECTA,FT等基因则抑制花梗臂的产生[8].
5.1 转录因子MYB13促进花梗臂的发生
GUS报告基因显示,转录因子MYB13(AT1G06180)在茎分生组织区、腋芽、花的基部以及花柄的分支点特异表达[24].过表达MYB13后,在转基因植株中发现了花梗臂[24],这是花梗臂表型首次展现在人们面前,当时将它描述为“钩状结构”.该研究发现,花梗臂更倾向于出现在第一个果荚处,随着分叉的增多而减少,作者猜测这个表型似乎受剂量效应的调控[24].
5.2 RTFL/DVL基因家族成员促进花梗臂的发生
RTFL(ROTUNDIFOLIALIKE)家族又叫做DVL(DEVIL)基因家族,含有21个家族成员.当DVL9(AT1G07490)过表达时,在花梗下端会出现“急转的角”[26],也就是本文命名的花梗臂.RTFL/DVL家族是植物中特有的.除DVL9外,DVL5(AT1G68825)、DVL8(AT3G55515)、DVL15(AT3G46613)、DVL16(AT2G36985)、DVL17(AT4G35783)和DVL20(AT3G53232)过表达后,都会出现茎的增生[26].
DVL16(也叫ROT4基因)过表达后,主茎处也会出现增生,即花梗臂.预示着这个基因家族很可能与植物体轴方向的增殖调控有关系[25].将花梗臂切片观察后,发现与主茎与花梗的细胞结构都保持很好的连贯性[25].
5.3 ERECTA促进花梗臂的发生
ERECTA编码富含亮氨酸的受体样激酶(Leucine-RichRepeatsReceptor-LikeKinase,LRR-RLK)[27],是最先从拟南芥中克隆的基因(AT2G26330)[28].ERECTA可以调节拟南芥顶端分生组织、叶序和花分生组织的大小[29],还可以抑制气孔发育[30],影响光合速率,蒸腾速率等[31].Ler植株是经X射线对Landsberg诱导产生的ERECTA缺失突变株[32],是除Col-0外广泛使用的拟南芥品系[33].因为Ler植株叶片为圆形,叶柄较短,角果短而钝,Ler植株花朵大多聚集在顶部,可以形成紧凑的花序,深受科学家的喜爱[27].由于ERECTA是花梗臂形成的全局调节因子,所以在Ler植株中从未发现过花梗臂及类似花梗臂的结构,并且Col-0背景的er突变体也未能产生花梗臂及其类似的表型[8].
5.4 染色体非整倍性
Henry等人(2010)研究非整倍体对拟南芥生长影响时,就发现了花梗臂的表型,并将其命名为“小结/小瘤”[34].非整倍体是指个体染色体数目与原来数量相比增加或减少一个或多个染色体,从而导致染色体组不平衡.与动物相比,植物对于非整倍体有较强的耐受性[35-36].
拟南芥是二倍体植株,通过不同倍性的植株间回交或者杂交可以获得不同的非整倍体个体[36].“小结/小瘤”主要出现在多倍体的非整倍体中,在一个多非整倍体(2n= 23)植株上有14个“小结/小瘤”,较低的非整倍体中并未出现“小结/小瘤”.除了“小结/小瘤”外,非整倍体中还出现了表皮褶皱的特征[37].
5.5 BP基因促进花梗臂的产生
欧洲油菜BREVIPEDICELLUS(BP)基因是拟南芥BP(KNAT1,a class-IKNOTTED1-like homeobox (KNOX) transcription factor [AT4G08150])的直系同源物,在欧洲油菜中过表达后植株就出现花梗臂的表型[38].拟南芥BP基因缺失会导致花序向下生长,株高变低,部分失去顶端优势[39].bp突变体还表现出相对下垂的角果、短小的果柄和紧密的花序等表型[40].
拟南芥中BP、PENNYWISE(PNY)[41]、BRAHMA(BRM)[40]相互作用来协同维持花序的正常生长发育.由此可见,BP基因是调控花梗臂生长正调控因子.
5.6 异源三聚体G蛋白复合体抑制花梗臂形成
异源三聚体鸟嘌呤核苷酸结合蛋白(Guanine nucleotide-binding proteins, G蛋白)是细胞内的分子开关,负责将信号从细胞外部传递到细胞内部.当与三磷酸鸟苷(Guanosine Triphosphate, GTP)结合时具有水解酶的活性,而与二磷酸鸟苷(Guanosine Diphosphate, GDP)结合时则失活[42].
异三聚体G蛋白复合体在真核生物中广泛分布,是信号转导的枢纽,在进化上较保守.G蛋白复合体包括Gα、Gβ和Gγ亚基.通过Gα与Gβγ二聚体结合可以实现G蛋白信号的特异性,将上游信号分子通过跨膜受体传递到下游相应的效应器.拟南芥有4个Gα基因: 1个典型的Gα(GPA1[AT2G26300])以及3个非典型超大型Gα(XLG1[AT2G23460]、XLG2[AT4G34390]和XLG3[AT1G31930]);1个Gβ基因(AGB1[AT4G34460]);3个Gγ基因:2个典型Gγ(AGG1[AT3G63420]和AGG2[AT3G22942])以及1个非典型Gγ(AGG3[AT5G20635])[43].研究表明,GPA1-AGB1-AGG3构成的G蛋白复合体亚基可以抑制花梗臂的形成,是花梗臂的负调控因子[8].
GPA1和AGB1定位在茎顶端分生组织,可调节茎尖分生组织大小[15].拟南芥中gpa1和agb1突变体主要表现为花、果荚、种子、下胚轴不同程度变短;agb1突变体缩短表型更严重,但开花数量变多[43].gpa1突变体的侧根形成减少,但agb1突变体的侧根形成增加[44].在短日照条件下,Col-0背景的gpa1-3和gpa1-4和Ws背景的gpa1-1和gpa1-2缺失突变体会产生比野生型更多的花梗臂.并且GPA1或AGB1的无义突变可以使花梗臂的发育扩大到C节点的远端(图3)[8].Ws背景的GPA1突变体(gpa1-1或gpa1-2)虽然也能产生花梗臂,但频率比Col-0背景的突变体低[8].
此外,AGB1还可以控制另一个表型——表皮褶皱(图4A),该表型在agb1突变体中出现频率较高(高达84%),而在gpa1突变体中则较少出现(仅2%).表皮褶皱主要在B和C的连接处出现(图3).
在短日照条件下,Col-0背景的gpa1突变体花梗臂出现概率增加67%,agb1突变体花梗臂出现概率增加52%,Ws背景的gpa1突变体花梗臂出现概率竟然高达612%,说明GPA1对花梗臂的产生起最关键的作用[8].AGG3属于植物所特有的C型Gγ亚基,与Gβ相互作用形成Gβγ二聚体[44].agg3突变体也可以增加花梗臂的数量,并且出现表皮褶皱和茎角(图4A).agg1和agg2突变体则与野生型没有明显差异.agg1agg2agg3三突变体出现花梗臂的频率和agb1相同,说明Gγ中AGG3是控制花梗臂的主要基因.XLG三突变(xlg1-5xlg2-1xlg3-1)和与Col-0出现花梗臂的频率及其表型相同.
因此,虽然异三聚体G蛋白复合体有12种不同的组合,由于Gα中只有GPA1对花梗臂发生起作用,因此决定花梗臂出现的组合只有3种:gpa1-AGB1-AGG1;gpa1-AGB1-AGG2;gpa1-AGB1-AGG3[8].
A.表皮褶皱; B. “马刺” ;C.茎增生.
同时G蛋白的不同亚基还控制拟南芥不同的发育性状.除花梗臂、表皮褶皱等表型外,Col-0背景的gpa1突变体花梗臂下还长有“马刺”,是位于花梗臂与花柄交界处底部的一个尖状突起.在Col-0背景的gpa1突变体中出现频率较高(95%)(图4B).有时这些“马刺”样结构还会单独地留在茎上,形成茎增生(图4C).茎增生生长的位置通常都在没有“马刺”的花梗臂处,猜测“马刺” 和茎增生是同一起源[8].
5.7 FT基因抑制花梗臂形成
FT(FloweringLocusT, AT1G65480)是调节植物开花起始的开关分子,也被认为是“开花素”基因[45].FT属于磷脂酰乙醇胺结合蛋白(phosphatidyl Ethanolamine-Binding Protein, PEBP)家族[46].拟南芥中FT可与卵磷脂(phosphatidylcholine, PC)结合调控开花[47].多个控制开花的通路(光周期途径、自主途径、春化途径、赤霉素、温度调控等途径)都汇总于FT基因[48-49].FT基因缺失突变体会导致植物开花延迟;反之,过表达FT可以促进植物提前开花[50].Col-0背景的ft-10突变体在长日照和短日照下均表现为晚花的特点,并且能产生同等频率的花梗臂.由此得知,花梗臂的产生并不取决于光周期,而取决于开花时间,开花延迟对于花梗臂的产生是有利条件.经研究统计gpa1-3,ft-10双突变体在长日照下几乎所有植株均产生花梗臂,超过一半的植株产生茎增生,一半的植株存在表皮褶皱[8].
5.8 其他抑制因素
除以上提到的影响因素外,植株自身的健康情况以及幼苗期或者成熟植株是否受到干旱、水淹、莲座叶被采摘以及虫害胁迫等因素,都将不同程度抑制花梗臂的形成[8].
6 讨论与展望
6.1 讨论
花梗臂的出现受周围环境影响比较大,这也可以解释为什么自1998年首次发现以来,后续的研究并没有进一步深入[24].花梗臂也可能是拟南芥之前就已经存在的器官,但由于不断进化逐渐消失,又因为环境的改变逐渐被人们重新发现,也可能最早出现的拟南芥没有此器官,现阶段拟南芥为适应环境或者维持自身生长,对环境做出的反应[8].目前的研究显示,拟南芥花梗臂发育受到6个基因家族的调控,还受到染色体非整倍体和光周期的影响(图5).
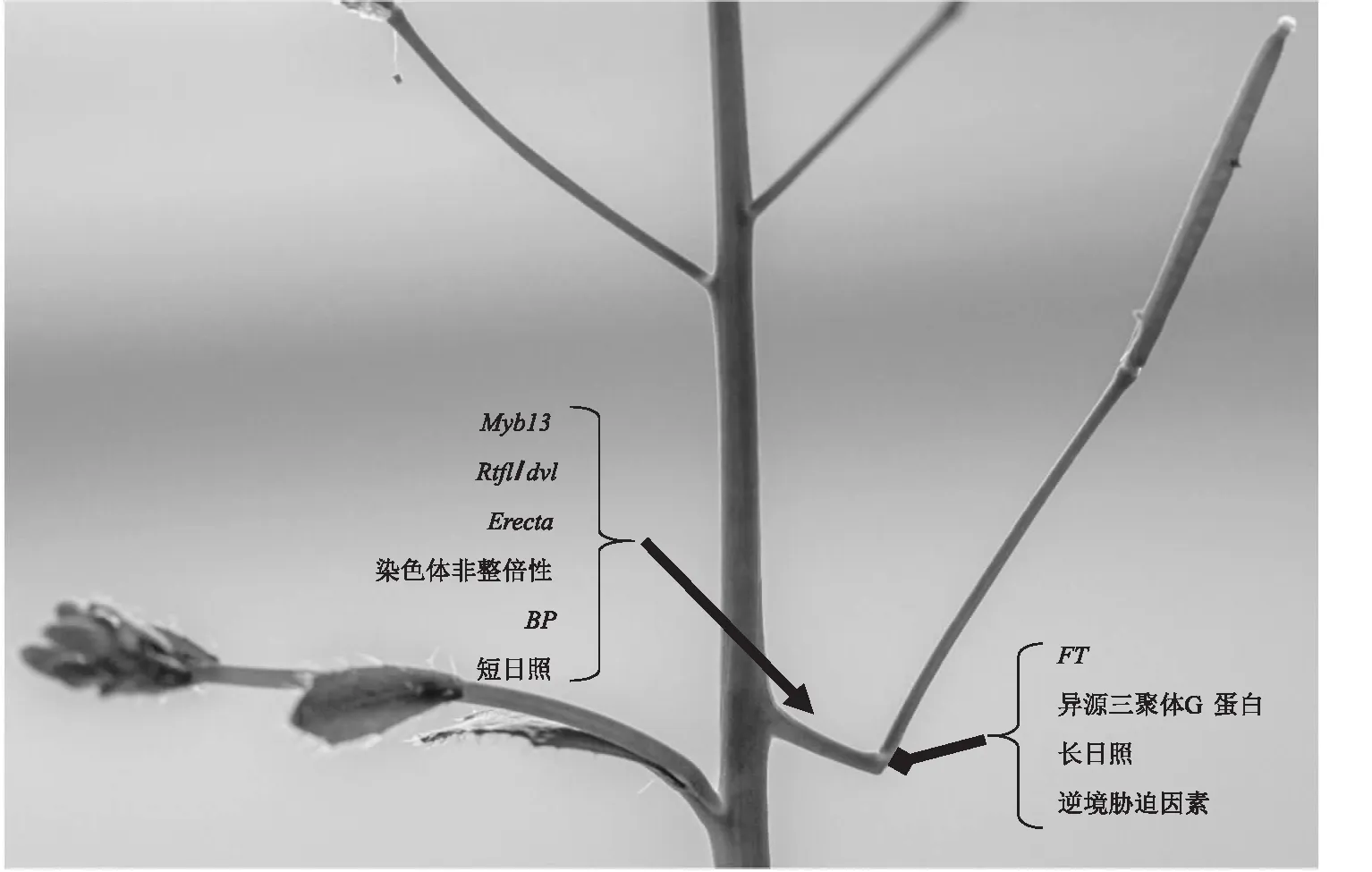
MYB13基因, RTFL/DVL基因家族成员, ERECTA基因,染色体非整倍性, BP基因及短日照等因素促进花梗臂的生成,用“→”表示;FT基因,长日照及生物胁迫相关因素抑制花梗臂的生成,用“—◆”表示.
涉及的6个基因家族,结果清晰明确,而染色体非整倍性则涉及的基因众多.拟南芥的非整倍体也可以导致花梗臂的出现,并且非整倍体的染色体越多,花梗臂出现的概率越大,有研究学者认为,1号染色体的倍增,将增加花梗臂的发生概率,推断很可能花梗臂的生成与1号染色体的基因直接相关.由于染色体倍性的改变所产生的表观遗传的改变是可以遗传给下一代的,并且变化持久.因此,有人认为花梗臂的出现主要是由于内部和外部因素的共同改变造成的发育调控紊乱的结果[34,37].
FT基因突变是导致花梗臂出现的关键因素,而FT还对侧枝发育有一定的影响,FT基因缺失突变体表现出侧枝生长发育缓慢的现象[51],花梗臂的产生是否与FT的这个功能相关还未知.
GPA1-AGB1-AGG3异源三聚体G蛋白复合物是花梗臂发育的负调控因子.但agb1,gpa1或agg3突变体都在短日照条件下才产生较高频率的花梗臂,因此除了基因调控外,环境因素对于花梗臂的形成也起着至关重要的作用.
6.2 展望
绝大多数agb1突变体会出现表皮褶皱,而在gpa1突变体中,表皮褶皱则非常罕见.GPA1基因表达量非常低的时候,表皮褶皱就消失了.已经证明染色体的非整倍性会增加花梗臂发生的频率,且往往在增加染色体的情况,才表现出花梗臂的增多.说明基因表达量与花梗臂之间具有密切的关系.根据未正式发表的结果表明,1号染色体的倍增对花梗臂的产生具有最直接的作用[8].
转录因子MYB13(AT1G06180),DVL9(AT1G07490),DVL5(AT1G68825)均位于1号染色体上.当出现染色体加倍后,这些基因的表达量增加,从而使花梗臂的发生概率更高.而抑制基因FT(AT1G65480)虽然也位于1号染色体上,但可能在调控花梗臂的信号通路处于上游的位置,或者剂量的增加没有超过正调控基因,所以最终导致的结果还是花梗臂增多的表型.而抑制基因GPA1(AT2G26300),AGB1(AT4G34460)虽然不在1号染色体上,但可能有一些基因转录调控因子是在1号染色体表达,这些调控因子抑制了这些负调控基因的表达,从而也为花梗臂的发生创造了条件.
在花梗臂研究的过程中,一些逆境胁迫的因素也会影响花梗臂发生.植物激素属于植物生长的内在调节因子,主要包括脱落酸、生长素、油菜素类固醇、细胞分裂素、乙烯、赤霉素、茉莉酮酸和独脚金内酯8种,它们协调植物各个器官的生长与发育[52].例如,脱落酸(abscisic acid, ABA)在种子休眠中起关键作用;赤霉素(gibberllins, GA)可以促进种子萌发[23];乙烯(ethylene, ET)不仅与叶片衰老、果实成熟相关,还可以通过调控蛋白从而调控花期[51-53];生长素(auxin, IAA)决定叶原基出现的位置,还调节根分生组织的大小[54-55];赤霉素(gibberllins, GA)参与茎伸长发育的调控[56].
研究表明,参与根系分生组织激素之间精细调节最终产生了不同浓度生长素的分布[55],可见生长素在植物器官发育中起着至关重要的作用.拟南芥的“花梗臂”均出现在侧枝上,而分支是由腋生分生组织(AM)分化形成,此组织位于叶和茎的连接处,即叶腋[57].植物激素对于拟南芥腋生分生组织也有一定的调控作用,其中浓度过高的生长素会抑制侧枝的生长,而细胞分裂素则是腋生分生组织起始所必须[58].因此,花梗臂的出现是否与这些激素的浓度变化有关,值得深入研究.
目前还没有发现花梗臂、“马刺”、茎增生对拟南芥生长、发育及其功能有何关联,但花梗臂作为侧枝发育研究的目标器官,易于观察,具解剖结构简单等优点,是一个不错的研究对象.
农作物拥有适量的侧枝可以提高光合作用及结实率,减少倒伏灾害[59].DA1基因可以减少拟南芥侧枝的数量,在da1-1突变体中甚至有些植株几乎没有侧枝起始的迹象[60].FC1会抑制水稻腋芽的生长[61];BRC1能够抑制拟南芥腋芽的生长[62].这些基因是否与花梗臂的形成有关,需要进一步研究.
拟南芥初生茎形成层是分化成木质部和韧皮部的主要场所(图2)[63],花梗臂极有可能是发源于此,这为花梗臂后续发生机制的研究指明了方向.
花梗臂结构的存在,是否有利于提高农作物对果实承重能力的提高,以及改变果实采摘的传统模式等,还需要在生产实践中检验.
致谢感谢立陶宛University of Tartu的博士生Kaspar Koolmeister赠予拟南芥花梗臂的原始图片,并授权在本文中使用;感谢美国The Pennsylvania State University的Dr. Timothy E. Gookin为论文提出宝贵的修改意见;感谢匿名评审专家对论文的审阅.

