响应面法优化丁酸梭菌快速增殖基础培养基
刘瑾,赵华
(天津科技大学 生物工程学院,工业发酵微生物教育部重点实验室,天津 300457)
丁酸梭菌(Clostridiumbutyricum)为典型的严格厌氧菌,是革兰氏阳性菌,在恶劣环境中可以通过形成芽孢增强自身对外界环境的适应能力[1]。其芽孢具有强抗逆性,能经受菌制剂过程中的高温、干燥、酸碱性的侵蚀,稳定性强[2]。芽孢在适当的条件下可以重新萌芽并形成细菌。与乳酸菌的抗逆性相比,在高温下容易死亡,菌制剂的活菌数较少。丁酸梭菌的这种特性可以更好地胜任微生物饲料的任务。
丁酸梭菌具有产生较高浓度和纯度的丁酸、较好的生长稳定性以及较低的营养需求等优点,因此被认为是最有开发潜力且具有商业性的丁酸发酵菌株[3]。丁酸梭菌具有极强的肠道整理作用,不但可以抑制肠道中大肠杆菌、沙门氏杆菌等致病菌,对肠道中有益菌群的生长有益处;同时有产生蛋白酶、淀粉酶、纤维素酶等多种酶类的能力,也可以促进动物的肠道发育和抗炎抑菌能力,起到部分抗生素的作用[4-6]。丁酸梭菌发酵生产的丁酸还被认为是一种抗癌剂,这主要是因为丁酸通过改变组蛋白脱乙酰基达到肿瘤细胞凋亡[7],丁酸盐可以用于预防和治疗结肠癌,抑制乳腺癌,并且在治疗恶性胶质瘤中也可以起到作用[8-9]。这些特性使丁酸梭菌及其产物丁酸在食品、发酵工业、饲料、医学医药等多个重要领域中有着得天独厚的巨大优势[10]。
目前微生物发酵法产丁酸存在丁酸产量较低、底物成本高、生成副产物导致丁酸得率低等问题,致使其无法满足工业化和单一市场对丁酸梭菌制剂的需求[11-12]。采用目前传统的发酵工艺生产丁酸通常会存在丁酸生产速率、产品纯度、终浓度较低等问题,不仅会导致发酵底物利用率低,而且会增加丁酸后续分离成本,从而使发酵法产丁酸无法与化学合成法竞争[13]。因此,优化丁酸梭菌的简易规模化生产和高产量的发酵工艺在市场应用上具有良好的研究前景[14-15]。
本课题采用单因素实验的方法以达到使丁酸梭菌快速、大量培养的目的。选择碳源、氮源以及除氧剂等进行全面优化,在此基础上进行响应面分析[16-17],以提高一定体积内丁酸梭菌的存活数量,缩短丁酸梭菌的生长周期,提供实验依据,可使丁酸梭菌制剂和丁酸大量生产产业化。
1 材料与方法
1.1 菌株
丁酸梭菌(Clostridiumbutyricum):由天津科技大学工业发酵微生物重点实验室提供。
1.2 培养基
强化梭菌培养基(reinforcedClostridialmedium,RCM):10.0 g蛋白胨、3.0 g酵母膏、5.0 g葡萄糖、10.0 g牛肉膏、1.0 g可溶性淀粉、0.5 g盐酸半胱氨酸、5.0 g氯化钠、3.0 g乙酸钠,溶于1 000 mL去离子水内,在121 ℃高压灭菌20 min。固体培养基则要添加2%琼脂。
优化后快速增殖培养基:14.0 g葡萄糖、16.0 g酵母膏、0.9 g半胱氨酸盐酸盐、5.0 g氯化钠、3.0 g乙酸钠,溶于1 000 mL蒸馏水内,在121 ℃灭菌20 min。
1.3 单因素实验
1.3.1 碳源的优化
以RCM培养基为基础,选取葡萄糖、果糖、可溶性淀粉、麦芽糖、蔗糖作为碳源,设置8.0 g/L为单一碳源的起始添加量,其他成分保持不变,培养基分装于容量250 mL的螺口试剂瓶内,接种量为10%,每组设置3个平行,置于厌氧箱内,37 ℃培养4 d,间隔12 h取样,检测期间最高OD600,确定最佳碳源的种类。
确定最佳碳源种类后,设置单一变量,最佳碳源的添加量分别设置为8.0,10.0,12.0,14.0,16.0 g/L,接种量和培养条件如上所述保持不变,检测期间最高OD600,确定优化碳源的最佳添加量。
1.3.2 氮源的优化
以优化碳源种类和添加量后的培养基为基础,选取牛肉膏、大豆蛋白胨、蛋白胨、酵母膏、胰蛋白胨作为氮源,设置8.0 g/L为单一氮源的起始添加量,其他成分保持不变,接种量和培养条件如1.3.1所述,检测期间最高OD600,确定最佳氮源的种类。
确定最佳氮源种类后,设置单一变量,最佳氮源的添加量分别设置为8.0,10.0,12.0,14.0,16.0 g/L,接种量和培养条件如1.3.1所述,检测期间最高OD600,确定优化氮源的最佳添加量。
1.3.3 除氧剂的优化
以优化碳源、氮源后的培养基为基础,选取抗坏血酸、半胱氨酸盐酸盐、亚硫酸钠、硫代乙醇酸钠4种除氧剂,设置0.5 g/L为单一除氧剂起始添加量,其他成分均保持不变,接种量和培养条件如1.3.1所述,检测期间最高OD600,确定最佳除氧剂的种类。
确定最佳除氧剂种类后,设置单一变量,最佳除氧剂的添加量设置为0.3,0.5,0.7,0.9,1.1,1.3 g/L,接种量和培养条件如1.3.1所述,检测期间最高OD600,确定优化除氧剂的最佳添加量。
1.3.4 培养温度优化
以各项指标综合优化后的培养基为基础,设置温度梯度为30,34,37,40 ℃,于恒温厌氧培养箱内培养,每组3个平行,对应温度下培养4 d,间隔12 h取样,检测期间最高OD600,确定最佳培养温度。
1.4 响应面法分析
在之前实验的基础上,利用响应面法研究各个因素对丁酸梭菌OD值的影响,并进一步确定培养基成分的最佳组合和最优值。
1.5 优化培养基生长曲线的测定
使用优化后的培养基,分装于250 mL螺口瓶内,取10%丁酸梭菌培养液,放入37 ℃恒温培养箱内培养5 d,每隔12 h取样检测生物量OD600并记录数值,绘制丁酸梭菌的生长曲线。
2 结果与讨论
2.1 碳源优化
对选取的5种碳源进行单一种类优化,结果见图1中A;对最优碳源的添加量进行优化,结果见图1中B。


图1 不同碳源(A)和最优碳源添加量(B)对丁酸梭菌生长的影响Fig.1 Effects of different carbon sources (A) and optimal carbon source addition amount (B) on the growth of Clostridium butyricum
由图1中A可知,葡萄糖、果糖、可溶性淀粉、麦芽糖、蔗糖都可以为丁酸梭菌的生长提供营养物质,但其中葡萄糖的效果最为显著,在培养4 d的过程中,生物量OD600最高,为0.74,因此确定丁酸梭菌可利用的最佳碳源为葡萄糖。在丁酸梭菌的生长过程中,葡萄糖提供基本的营养物质,葡萄糖浓度过低时提供的营养物质不足,丁酸梭菌生长受到限制,葡萄糖浓度过高导致培养基渗透压升高,丁酸梭菌水分渗出导致生长受到限制甚至死亡[18]。
由图1中B可知,葡萄糖浓度为14.0 g/L时生物量OD600达到最大值,为2.880 1,结果表明适合丁酸梭菌生长的最优碳源为葡萄糖,且最适添加量为14.0 g/L。
2.2 氮源优化
对选取的5种氮源进行单一种类优化,结果见图2中A;对最优氮源的添加量进行优化,结果见图2中B。


图2 不同氮源(A)和最优氮源添加量(B)对丁酸梭菌生长的影响Fig.2 Effects of different nitrogen sources (A) and optimal nitrogen source addition amount (B) on the growth of Clostridium butyricum
由图2中A可知,牛肉膏、大豆蛋白胨、蛋白胨、酵母膏、胰蛋白胨都对丁酸梭菌的生长有一定的作用,其中大豆蛋白胨和酵母膏的作用尤为显著,但酵母膏的效果最显著,在培养4 d的过程中,其生物量OD600最高,为2.359 2,因此确定丁酸梭菌可利用的最佳氮源为酵母膏。
由图2中B可知,最终确定酵母膏浓度为16.0 g/L时最优。在培养的4 d内,生物量OD600达到最大值,为2.349 9。结果表明,适合丁酸梭菌生长的最优氮源为酵母膏,最佳添加量为16 g/L。
2.3 除氧剂优化
对选取的4种除氧剂进行单一种类优化,结果见图3中A;对最优除氧剂的添加量进行优化,结果见图3中B。


图3 不同除氧剂(A)和最优除氧剂添加量(B)对丁酸梭菌生长的影响Fig.3 Effects of different deoxidizers (A) and optimaldeoxidizer addition amount (B) on the growth of Clostridium butyricum
由图3中A可知,抗坏血酸、半胱氨酸盐酸盐、硫代乙醇酸钠都对丁酸梭菌的生长有一定作用,而亚硫酸钠对丁酸梭菌的生长几乎没有作用。其中半胱氨酸盐酸盐和硫代乙醇酸钠的效果较好,效果最显著的为半胱氨酸盐酸盐,在培养的4 d内,其OD600生物量最大,为1.846 6。因此,确定丁酸梭菌可利用的最佳除氧剂为半胱氨酸盐酸盐。
由图3中B可知,半胱氨酸盐酸盐添加量过低时,在培养过程中培养基内达不到无氧状态[19],半胱氨酸盐酸盐浓度为0.9 g/L时生物量OD600达到最大值,为1.103 6。结果表明,适合丁酸梭菌生长的最优除氧剂为半胱氨酸盐酸盐,其最适添加量为0.9 g/L。
2.4 温度优化
对设置的4个最优培养温度进行单一优化,结果见图4。

图4 不同培养温度对丁酸梭菌生长的影响Fig.4 Effects of different culture temperatures on the growth of Clostridium butyricum
由图4可知,在培养4 d的过程中,30 ℃和40 ℃对丁酸梭菌的生长提供的环境并不是最优,而在37 ℃的培养环境下,丁酸梭菌生长最快,且OD600生物量最高,可达2.940 9。因此,可以确定丁酸梭菌的最适培养温度为37 ℃。
2.5 最陡爬坡实验
根据上述实验,通过梯度增加葡萄糖、酵母膏和半胱氨酸盐酸盐的浓度,采用最陡爬坡实验的上升实验确定3个因素的最佳水平范围,实验设计和响应值见表1。

表1 最陡爬坡实验设计和结果Table 1 Design and results of steepest climbing experiment g/L
由表1可知,丁酸梭菌的OD值随着梯度的增加而增加,第2梯度时,丁酸梭菌的OD值达到最大,梯度再提高,OD值下降。因此,选择第2梯度的浓度做进一步的响应面优化实验。
2.6 响应面法优化培养基条件
在最陡爬坡实验的基础上,利用Design Expert 10.0软件,针对葡萄糖(X1)、酵母膏(X2)和半胱氨酸盐酸盐(X3)对丁酸梭菌OD值(Y)的影响进行响应面实验,进一步确定培养基的最佳条件,并对结果进行方差分析,所得实验设计与结果见表2,方差分析见表3。

表2 响应面实验的设计与结果Table 2 Design and results of Box-Behnken experiment
通过Design Expert 10.0软件对表2中数据进行多元线性回归分析,得到拟合实验因素的回归方程:
Y=3.66+0.049X1+0.068X2+0.095X3+0.14X1X2-0.027X1X3+0.057X2X3-1.31X12-0.76X22-0.12X32。
通过Design Expert 10.0软件对响应面实验进行方差分析,结果见表3。
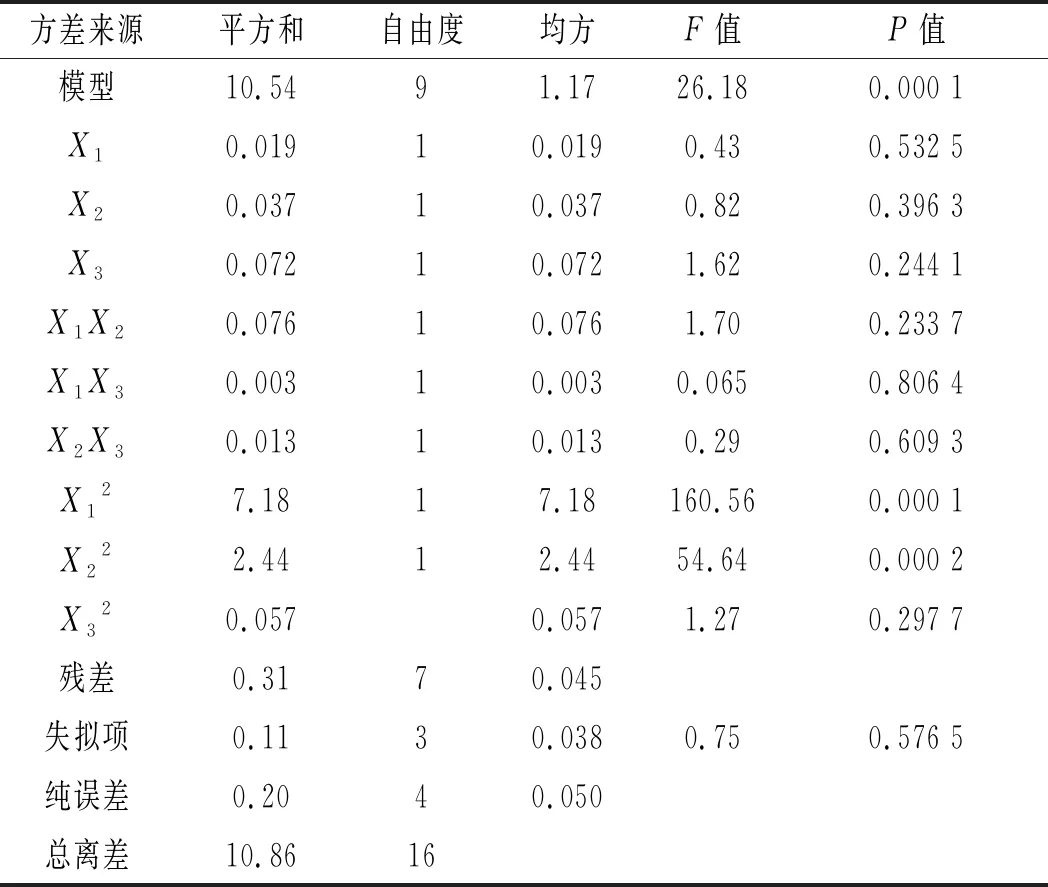
表3 回归方程方差分析Table 3 Variance analysis of regression equation
由表3可知,该模型的P值为0.000 1,极显著(P<0.01),失拟项不显著,且失拟项的P值为0.576 5>0.05,该模型和实验拟合度较好。模型的决定系数R2为0.971 2,校正后的决定系数RAdj2为0.934 1,变异系数(coefficient of variation, C.V.)为8.03%,表示8.03%的变异不能由该模型解释,说明实验操作和模型均可信。
2.7 响应面分析
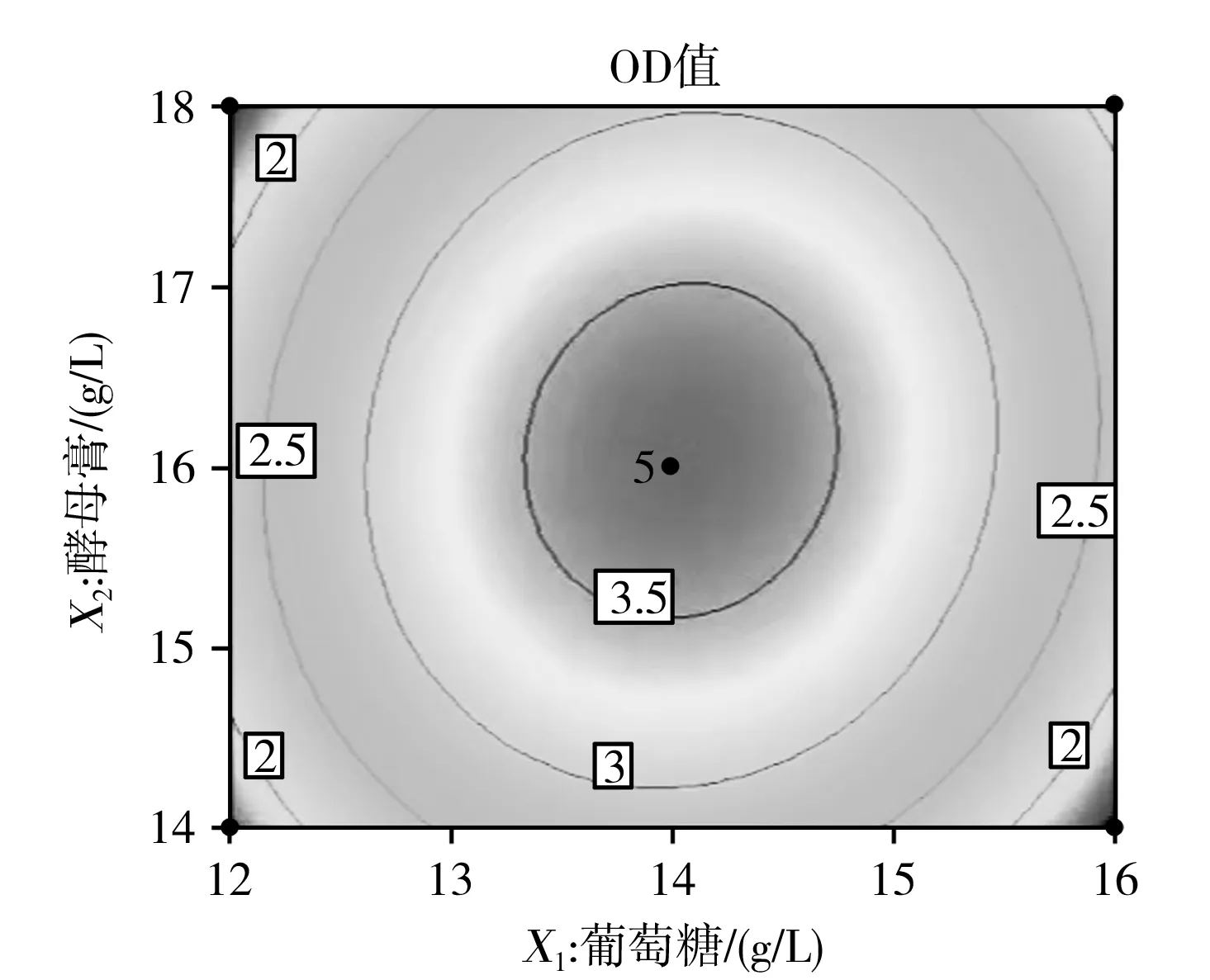
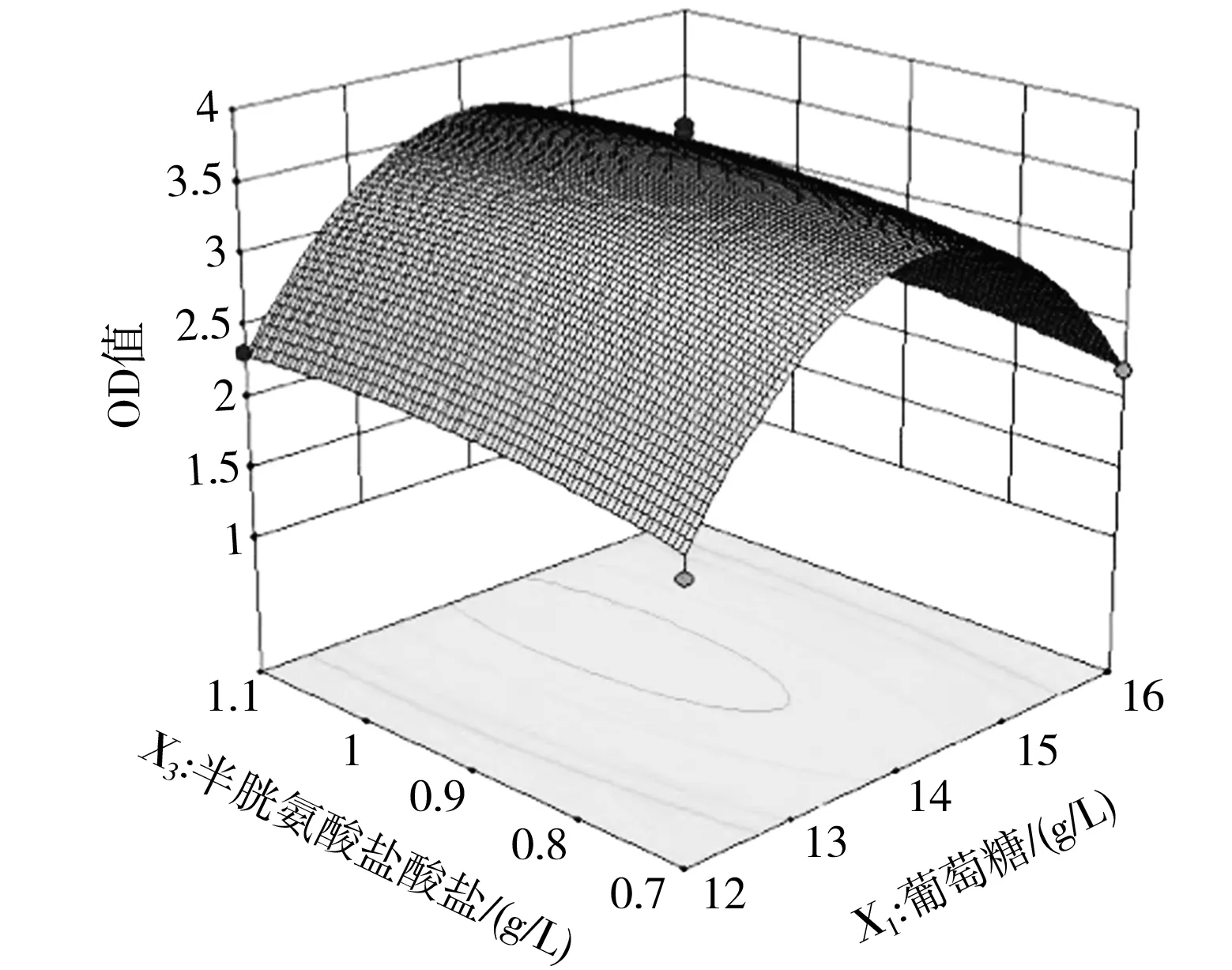
根据上述分析,该模型可用于解释和预测实验结果,根据回归分析和回归方程的拟合,利用Design Expert 10.0软件得到各因素相互作用的响应面和等高线的分析结果,见图5。
a

b

c
d

e

f
每个因素对丁酸梭菌OD值的综合影响见图5,当半胱氨酸盐酸盐的浓度为0.9 g/L时,葡萄糖和酵母膏的交互作用对丁酸梭菌OD值的影响见图5中 a和b,葡萄糖和酵母膏的浓度范围分别为13.5~14.5 g/L和15.5~16.5 g/L;当酵母膏浓度为16 g/L时,葡萄糖和半胱氨酸盐酸盐的交互作用对丁酸梭菌OD值的影响见图5中c和d,葡萄糖和半胱氨酸盐酸盐的浓度范围分别为13.5~14.5 g/L和0.7~1 g/L;当葡萄糖浓度为14 g/L时,酵母膏和半胱氨酸盐酸盐的交互作用对丁酸梭菌OD值的影响见图5中e和f,酵母膏和半胱氨酸盐酸盐的浓度范围分别为15.5~16.5 g/L和0.8~1 g/L。通过Design Expert 10.0分析,酵母膏浓度为16.372 g/L,葡萄糖浓度为14.324 g/L和半胱氨酸盐酸盐浓度为0.905 g/L时,有最大丁酸梭菌OD值3.350 4,与以上分析一致。
为了验证Design Expert 10.0软件所预测的最佳实验条件,在所提供的最佳发酵条件下,并考虑现实操作条件,调整最佳发酵条件为酵母膏 16 g/L、葡萄糖14 g/L、氯化钠5.0 g/L、乙酸钠3.0 g/L和培养温度37 ℃,在此条件下进行3次平行实验,得到发酵液丁酸梭菌OD值为3.675 3,较模型预测值3.563 7高约3.134%,此差值在可接受范围内。在未优化的培养条件下,丁酸梭菌OD为1.579 3,提高了约132.72%。
2.8 优化培养基生长曲线测定
使用优化后的培养基分装于250 mL螺口瓶内,取10%丁酸梭菌培养液,于37 ℃恒温培养箱中培养5 d,每隔12 h取样检测生物量OD600并记录数值,绘制丁酸梭菌的生长曲线,见图6。
由图6可知,菌体在最优培养基以及最适培养温度的条件下,仅在2.5 d达到对数生长期,3 d时菌体生物量OD600最高,为3.350 4。虽然菌体生物量OD600最后稳定在1左右,这主要是培养基过少、菌体浓度过高、营养物质消耗过快导致的[20-23]。

图6 最优培养基和最适培养温度的丁酸梭菌生长曲线Fig.6 Growth curve of Clostridium butyricum with optimal culture medium at optimal culture temperature
在本课题中,采取单因素实验的方法对本实验室提供的丁酸梭菌的RCM初始培养基进行成分的筛选和添加量的优化,最终结果表明培养该丁酸梭菌的培养基最佳组分为葡萄糖、酵母膏、半胱氨酸盐酸盐,最优培养温度为37 ℃[24-26]。
3 结论
培养基成分及其含量对丁酸梭菌浓度起着至关重要的作用,碳源与氮源为丁酸梭菌生长提供了最基础的营养,半胱氨酸盐酸盐作为除氧剂确保了丁酸梭菌生长条件为无氧条件,碳源、氮源的选择与配比对丁酸梭菌的生长很重要。
响应面分析比普通的线性模型和正交实验更加立体全面,可以找到最优的组合和响应值。本实验通过响应面分析确定了培养基最优值,结果表明,优化后培养基中最佳碳源为葡萄糖(14.0 g/L),最佳氮源为酵母膏(16.0 g/L),最佳除氧剂为半胱氨酸盐酸盐(0.9 g/L),最适培养温度为37 ℃。此时丁酸梭菌生长最快速,且最大OD600值达到3.350 4,比优化前提高约132.72%。

