液相色谱法对动物源性食品中磺胺类药物残留量的测定
招钰娟 何国成 林庆昶 周秀莹 贾晓菲 林小贞 黎小鹏
(中山市农产品质量安全检验所,广东 中山 528437)
磺胺类药物(sulphonamides,SAs)是人工合成的抗菌药,早在1935年开始用于临床,与其他抗菌药相比其应用的时间较长,具有性质稳定、使用简便、抗菌谱广等特点,至今在养殖生产和临床中仍广泛使用,是重要的化学治疗药物。我国的养殖生产还处于散户养殖较多的阶段,部分养殖户由于对抗菌药缺乏了解而未合理使用或过度使用,引起细菌对于磺胺类药物的耐药性,药物残留从而污染下游产品,进而危害人体健康。近年的研究表明,长期对动物使用SAs,特别是磺胺甲噁唑、磺胺喹噁啉等,残留物有可能引起人体过敏、中毒、造血功能障碍、急性溶血性贫血、粒细胞缺乏症等,也有致畸、致癌、致突变的“三致”作用,并可能导致耐药性菌株产生,造成生态环境污染[1]。因此,为了保障动物用药的安全性和有效性,国际食品法典委员会(CAC)以及许多的国家都对动物源性食品中的SAs含量都作了非常严格的规定[2],我国在《食品安全国家标准 食品中兽药最大残留限量》GB 31650-2019中明确要求,所有动物产品中SAs的最高残留限量为0.1mg·kg-1,同时磺胺二甲基嘧啶在牛奶中的残留限量为0.025mg·kg-1。
SAs是以对氨基苯磺酰胺结构为主体的药物总称,一般为白色或微黄色结晶性粉末,遇光易变质,颜色逐渐变深,有共同的对-氨基苯磺酰胺母核结构,大多数SAs具有酸碱两性,可溶于酸或碱溶液中,也较易溶于乙醇、乙腈或丙酮中;大多数SAs在水中溶解度极低[3]。根据SAs的理化特点,研究人员开发了多种检测方法,主要有荧光光谱法[4]、化学发光法[5]、表面增强拉曼光谱法[6]、电化学法[7]、免疫分析法[8]、微生物抑制法[9]、毛细管电泳法[10]、高效液相色谱法[11]、液相色谱-串联质谱法[12,13]。我国有关部门已发布多个磺胺类药物残留量的检测标准,主要使用液相色谱法和液质联用技术。液质联用是目前SAs定性定量检测灵敏度高、准确性好的方法,但由于仪器昂贵,对使用人员要求高,在基层实验室尚未普及。而液相色谱-紫外检测器,是多数实验室配置的仪器,绝大部分基层实验室已配置,具有选择性高,定量准确、稳定,灵敏度适用等优点。针对我国畜禽养殖目前还处于散户养殖阶段的特点,基层实验室使用液相色谱法开展SAs残留量检测,及时发现养殖生产中滥用抗菌素的问题,可预防超标产品进入市场危害人们健康。目前现行有效的SAs液相色谱检测标准,多发布于十多年前,前处理操作比较复杂,随着检测技术理论的发展,并针对各自实验室的仪器、人员配置等实际情况开展研究,选择出结果稳定、操作简易的前处理和仪器方法,具有重要意义。
1 材料与方法
1.1 仪器与试剂
高效液相色谱-紫外检测器HPLC1260-VWD(安捷伦科技有限公司);振荡摇床KS-501(德国IKA集团);涡漩振荡器(德国IKA公司);离心机Sigma 3-30KS(德国Sigma离心机有限公司)。
5种磺胺标准品,磺胺二甲基嘧啶、磺胺间甲氧嘧啶、磺胺甲噁唑、磺胺二甲氧嘧啶、磺胺喹噁啉,购自德国DrEhrenstorferGmbH公司。
乙腈、甲酸(色谱纯,Fisher公司);无水硫酸钠(分析纯,广州化学试剂厂);碱性氧化铝固相萃取柱(6mL,2g SUPELCO)、0.2μm PTFE针式过滤器(安捷伦科技有限公司);实验室用水为Milli-Q超纯水。
洗脱液:25mL乙腈加0.3mL甲酸加75mL水混合,摇匀。
1.2 提取
取畜禽肌肉、肝脏样品,搅拌成匀浆状。称取5.00g(±0.05g)试样于50mL离心管中,加入约5mL水、2颗陶瓷均质子、20.00mL甲酸乙腈(甲酸0.3%),摇床震荡30min,300rpm。加入8~10g无水硫酸钠,涡旋震荡1min,8000rpm离心5min,全部上清液转至另一50mL离心管,加入约15mL正己烷,涡旋震荡1min,弃去上层,再加入约15mL正己烷,涡旋震荡1min,8000rpm离心5min,下层(乙腈层)备用。
1.3 净化
准确吸取上述备用液(下层)16.00mL注入已活化的碱性氧化铝固相萃取柱,上样前用10mL乙腈活化,在自然重力下流出,弃去滤液,挤干,2mL洗脱液洗脱,重复1次,收集全部洗脱液,定容至总体积4mL,过0.2μm PTFE针式过滤器后上机检测。
1.4 标准溶液配制
分别准确称取5种磺胺类药物10mg (精确至0.01 mg),用甲醇溶解并定容至10mL,配制成1mg·mL-1的标准储备液。
分别准确移取上述单一标准溶液0.10mL于同一10mL容量瓶中,甲醇稀释至刻度,摇匀,得到10μg·mL-1的混合标准储备液,于-18℃以下保存。
准确吸取混合标准储备液0.10mL于样品瓶中,加入0.90mL洗脱液,得到1000μg·L-1的混合标准溶液;精确吸取一定量的混合标准溶液,用洗脱液稀释成质量浓度为20μg·L-1、50μg·L-1、100μg·L-1、200μg·L-1、500μg·L-1、1000μg·L-1的标准工作溶液。
1.5 色谱条件
色谱柱,Agilent Pursuit 5 C18(150mm×4.6mm,5.0μm),柱温为35℃;检测波长270nm;进样量20.0μL,流量1.000mL·min-1,流动相洗脱程序如表1所示,后运行时间1min。
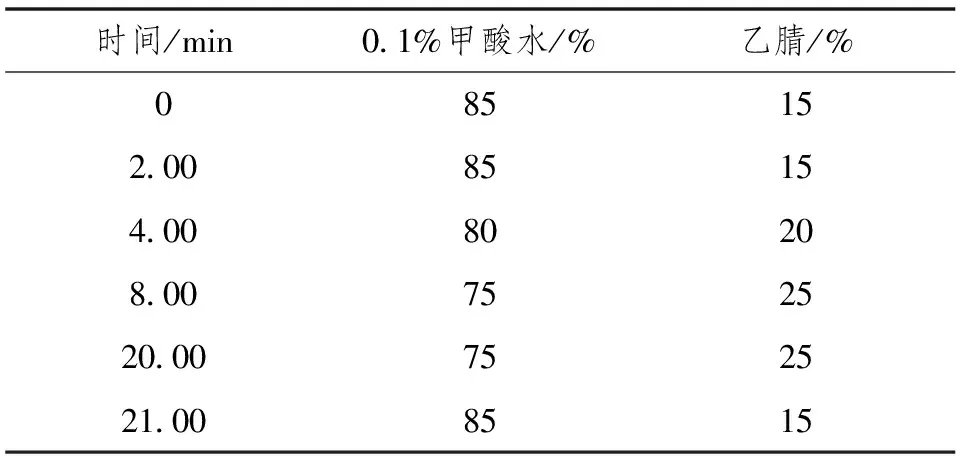
表1 液相色谱梯度洗脱程序
2 结果与分析
2.1 提取剂的选择
乙腈[14]和乙酸乙酯[15]是SAs常用的提取溶剂,而SAs容易在酸性溶液中离子化[16],提高提取效率。同时考虑到畜禽产品含有较高的蛋白质,容易对检测造成干扰,含有乙腈的提取溶剂具有沉淀蛋白、减少共提物的作用[17],结果则为色谱图的杂峰较少。本研究比较了乙腈、甲酸乙腈和乙酸乙酯3种提取溶剂,考察添加浓度0.040mg·kg-1的回收率和相对标准偏差值,观察加标样品的色谱图,比较不同提取溶剂对后续净化步骤操作便利性的影响等多种因素,优选出甲酸乙腈作为本试验的提取溶剂。
2.2 净化方法的选择
本试验使用液相色谱-紫外检测器,检测波长270nm,与液质联用法相比选择性较弱,只是以保留时间作为定性条件,净化效果低的方法容易产生干扰。比较QuEChERS[18]净化管(内含50mg PSA、150mg C18EC 和900mg Na2SO4,15mL)、阳离子交换(MCX)固相萃取柱[19]、碱性氧化铝固相萃取柱[14,20]3种净化方法,3种方法的加标回收率均在70%~110%,但QuEChERS净化管的色谱图有比较多杂峰,容易产生干扰;MCX柱容易发生堵塞现象[21],选择碱性氧化铝SPE柱作为本研究的净化方法。使用甲酸乙腈作提取溶剂,结合碱性氧化铝柱净化,经优化后整个前处理不需要使用旋转蒸发仪、氮吹仪浓缩或置换有机溶剂,大大减少前处理时间,简化操作,也能减少SAs的挥发,提高提取净化效率,提高结果的准确性。与赵敏儿[22]的实验结论一致。
2.3 方法学考察
2.3.1 定量方法的线性检测范围
以混合标准溶液的浓度为横坐标,各目标化合物色谱峰的峰面积为纵坐标,绘制标准曲线,其线性关系相关系数、回归方程见表2。5种磺胺在0.02~1000mg·L-1范围内线性关系良好,r2值均大于0.9999。
2.3.2 方法检出限
方法检出限按低浓度点0.05mg·kg-1的响应值与基线噪声响应的3倍计算,检出限结果见表2。5种磺胺的方法检出限为0.003~0.005mg·kg-1,能满足动物源性食物中磺胺类抗生素的检测。5种磺胺类药物标准溶液色谱图见图1。

表2 动物源性食物中5种磺胺的回归方程、相关系数、检出限
2.3.3 方法回收率和精密度
在相同的试验条件下,分别对6个空白鸡肉、猪肝、脂肪样品添加浓度为0.020mg·kg-1、0.040mg·kg-1、0.200mg·kg-1的5种磺胺混合标样,进行加标回收和精密度测试,同时进行空白试验,测试结果见表3。5种磺胺的加标回收率为80.1%~108%,相对标准偏差2.48%~10.0%。方法具有很好的回收率和精密度。
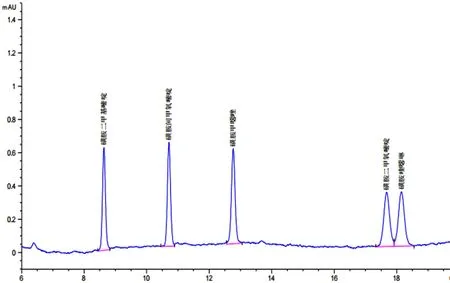
图1 5种磺胺类药物标准溶液色谱图(0.05μg·mL-1)

表3 动物源性食物中5种磺胺的加标浓度、加标回收率和相对标准偏差
3 结论
本研究通过优化提取溶剂,有效提高提取效率,简化提取步骤;使用正己烷前处理,并优选出固相萃取小柱同时富集和净化,简化整个前处理的步骤,无需旋转蒸发仪浓缩、氮吹仪置换溶剂,大大提高工作效率,前处理操作比较简便。结合高效液相色谱和紫外检测器,建立了操作简便、回收率高、准确稳定的动物性食品中5种常用磺胺类药物残留的分析方法,易于在基层实验室开展测定,及时发现养殖生产中的磺胺类药物滥用情况,为农业行政主管部门制定政策和加强管理提供参考。

