浓香型大曲生产过程中微生物及温度变化规律的研究分析
李 涛,万自然,刘 宇,焦祥启,房 玲,李瑶瑶
(山东兰陵美酒股份有限公司,山东临沂 277731)
大曲富含多种微生物和酶,在白酒生产中具有极其重要的作用[1]。大曲按其培养温度可分为高温大曲,中温大曲,低温大曲。大曲的培养季节性强,气温对其培养至关重要,因此前人总结出“制伏曲”的说法[2]。综合大曲各项指标的变化情况,北方生产大曲在每年的6 月到9 月,更适合微生物的生长[3]。大曲中的微生物种类非常复杂,生栖方式各不相同,根据形态和生理形状,大体可分为霉菌、细菌、酵母菌三大类[4]。大曲的生产实质是微生物富集的过程,作为酿酒的糖化发酵剂,在发酵过程中具有糖化、发酵、生香的作用,影响酒体的品质和风格[5]。本文探究了浓香型大曲培养过程中可培养微生物及曲温、品温和室温的变化规律,以期为制曲生产过程中翻曲和排潮等提供一定的参考。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 样品
浓香型大曲发酵期0 d、1 d、2 d、3 d、4 d、6 d、8 d、10 d、12 d、17 d、22 d、25 d,根据软硬程度,粉碎过筛放置在-20 ℃冰箱。
1.1.2 仪器设备
高压蒸汽灭菌锅、超净操作工作台、移液枪、恒温培养箱、菌落计数仪、干燥箱、分析天平、培养皿、温度计、粉碎机等。
1.1.3 培养基制备
细菌培养基。称取3.0~5.0 g牛肉膏、10.0 g蛋白胨、5.0 g 氯化钠、20.0 g 琼脂,加入1000 mL 去离子水,加热溶解,用1 mol/L NaOH 溶液调节pH 值为7.2~7.4,分装于三角瓶中,121 ℃灭菌20 min,备用。
霉菌培养基。称取5.0 g 蛋白胨、10.0 g 葡萄糖、1.0 g 磷酸二氢钾、0.5 g七水硫酸镁、0.03 g孟加拉红、15.0 g 琼脂粉,加入1000 mL 去离子水,加热溶解,校正pH 值为7.2,分装后121 ℃高压灭菌20 min。为抑制细菌的生长,按照万分之一的比例加入氯霉素。
1.2 实验方法
1.2.1 取样在曲房内,随机抽取两个曲块,每一块按照四分之一分法,粉碎混合,用取样袋封存备用。
1.2.2 温度记录
温度测量,把温度探头校准完毕,从实验曲房随机挑选曲块(靠门口的不选)。入房完成后,把温度探头插在曲块中心位置,深度10 cm 左右测量曲温;温度探头放在两曲块中间中心位置夹紧,测量品温;室温测量则把探头放在曲房中间悬挂离曲块50 cm左右。每天上午10点记录室温、品温、曲温。
1.2.3 菌悬液制备
称取10.00 g 大曲,加入90 g 灭菌后的0.9%生理盐水,放入灭过菌的玻璃珠,30 ℃培养箱中振荡培养30 min。吸取100 μ L 菌悬液,转移至装有900 μ L 无菌水的三角瓶中,制备10-2菌液,按照上述方法依次制备10-3、10-4、10-5、10-6、10-7、10-8菌液。
1.2.4 培养
将酵母菌涂布后的平板,置于30 ℃培养箱培养4 d,根据不同菌落形态对酵母进行归类编号及计数。将霉菌涂布后的平板,置于30 ℃培养箱培养5 d,根据不同菌落形态对霉菌进行归类编号及计数。将细菌涂布后的平板,置于30 ℃培养箱培养36 h,根据不同菌落形态对细菌进行归类编号及计数。
1.2.5 大曲其他检测方法
目前,1路和6路公交路线上共安装了71个电子公交站牌,2路、3路、5路和7路公交线路计划新增92个电子公交站牌。通过电子公交站牌,为需乘坐公交车的广大吉首市民提供极大的便捷,并于2018年3月荣获央视新闻“两会”特别报道点赞。
大曲糖化力和水分按照QB/T 4257—2011《酿酒大曲通用分析方法》检测[6]。
2 结果与分析
2.1 中温曲入房发酵后室温、品温、曲温的变化规律
如图1 所示,曲块入房时品温、曲温与室温基本持平在30 ℃左右,经过1 d 发酵后曲温、品温迅速上升到43 ℃,此时室温34.2 ℃,挂衣良好。倒浆后温度继续上升,前4 d温度迅速上升,这一阶段曲温和品温差距较小,室温缓缓上升缩小差距;4~9 d 曲温和品温达到顶温并且较稳定,室温开始缓慢下降,此阶段曲温、品温和室温差值达到最大;9~12 d 三者温度都呈下降趋势。并房时,曲温46 ℃与品温相差6 ℃,此时室温为35 ℃。12 d 并房后,曲温、品温、室温再次回升,温度达到55 ℃左右,此阶段温度保持时间短。13 d 后曲温、品温、室温开始缓慢下降,品温和室温接近并且低于曲温。整个发酵过程曲温>品温>室温,在温度上升期三者温度差距较小,在高温稳定期三者温度差距最大,在后缓落期曲温较高于品温和室温,温度缓慢下降。

图1 室温、品温、曲温变化规律图
2.2 浓香型大曲生产过程微生物变化结果与分析
如图2 所示,入房后,0~4 d 霉菌数量稀少,酵母菌和细菌生长迅速;翻曲后酵母增长趋势减缓,细菌增长趋势上升,4~8 d 酵母菌和细菌数量迅速减少,霉菌数量有所上升;8~12 d 细菌和酵母数量又有缓慢增长;12 d 并房后酵母菌、细菌、霉菌数量减少,后期酵母菌数量稀少或者没有,出房前霉菌和细菌数量波动。

图2 微生物变化规律图
2.3 浓香型大曲生产过程温度和微生物演变结果与分析
为更形象直观的表达曲温、品温和室温和微生物消长的关系,如图3 所示,0~4 d 水分和温度适宜,细菌和酵母菌生长迅速,但霉菌较少。曲温、品温和室温也迅速上升,此时开门窗排潮通风较少,微生物增长产热使“三温”上升迅速,差距较小。4~8 d 细菌和酵母菌数量增长到一定程度,曲温达到58 ℃左右,曲温和品温达到最大并且维持温度,不耐热细菌和酵母菌死亡率高,数量迅速减少,霉菌数量虽有增长,但较为缓慢。此阶段因为微生物数量减少,缺少生长作用的放热源,加上每次开门窗放潮导致室温下降,曲温、品温和室温的温差最大。8~12 d 经过高温的筛选大多数不耐热微生物死亡,酵母菌死亡变得稀少,部分耐热芽孢杆菌存活,耐高温霉菌孢子进行生长繁殖,曲温、品温和室温下降。12 d 并房后,曲温、品温和室温再次达到最高温度,但没有持续便缓慢下降,直至出房。此阶段细菌数量没有大幅下降或上升,由于含水量的降低和酸的增加,细菌生长受到抑制,细菌数量在9.9×106CFU/g。霉菌在顶火和后火期稍微增长,主要因为霉菌的生长周期较长,耐高温霉菌孢子的生长繁殖,出房时水分下降,霉菌数量也有降低。酵母菌经过高温筛选后数量稀少或没有。
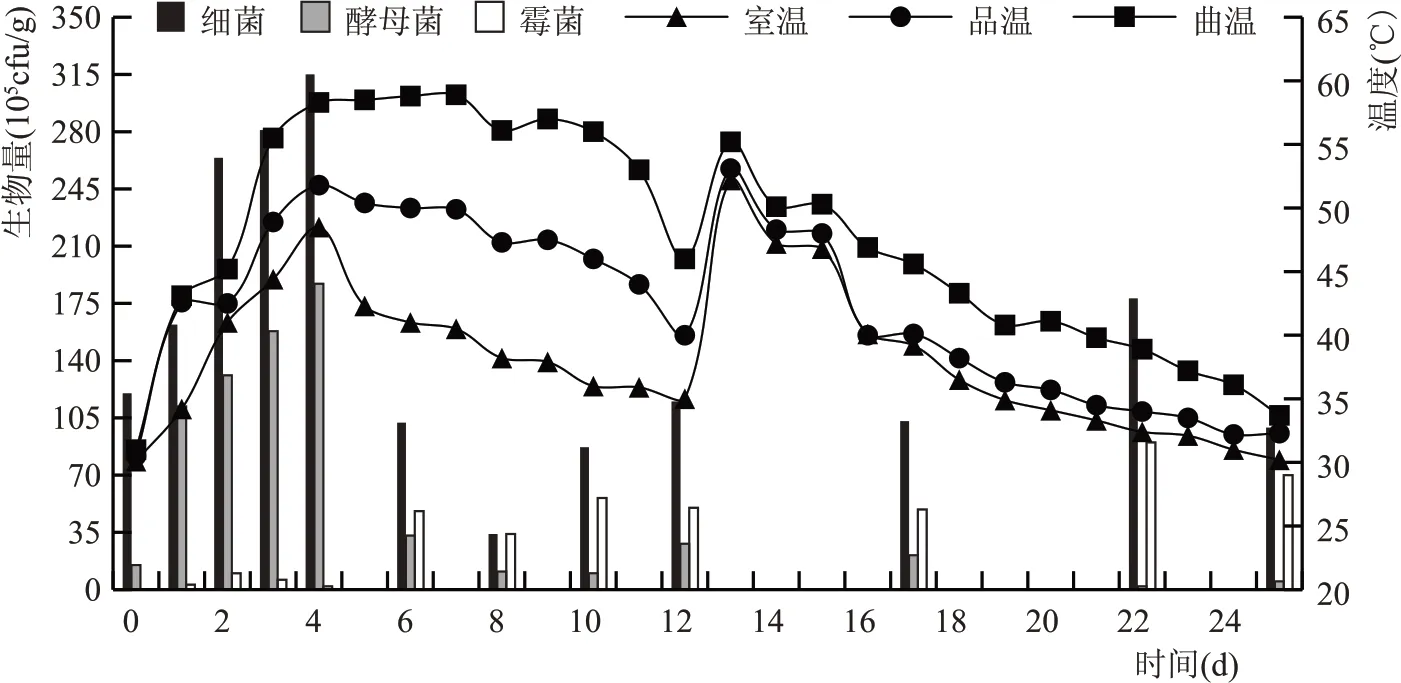
图3 温度和微生物演变规律图
2.4 浓香型大曲生产过程中水分和糖化力变化结果与分析
结合图4 制曲过程中水分与糖化力变化曲线,入房时曲块初始水分为35.1%、糖化力996 U,此时的糖化力为小麦原始糖化力。在入房1 d 倒浆后,糖化力迅速下降至500 U左右,曲温高达45 ℃。倒浆期之后,水分逐渐降低,糖化力也降低。入房10 d时,水分降至20%左右,糖化力逐渐升高,此阶段温度由顶温逐渐下降,曲温56 ℃左右,品温大概46 ℃,霉菌数量稍有增加。12 d 并房时,糖化力升至900~1000 U,曲温46 ℃、品温40 ℃呈下降趋势。并房后,曲温、品温、室温迅速回升至55 ℃左右然后缓慢下降,糖化力下降150 U。根据表1 数据结果,入房7 d和成品曲的曲皮糖化力基本相同,7 d 曲芯糖化力比成品曲的低,糖化力上升可能是曲芯糖化力的升高,曲皮糖化力在前期已成型,后期糖化力稍降可能是曲芯糖化力降低引起。
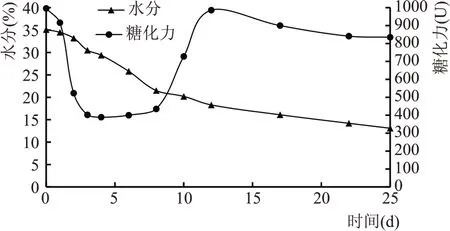
图4 制曲过程中水分与糖化力变化曲线

表1 曲皮和曲芯糖化力变化
3 结论
浓香型大曲入房后由于水分、温度等条件比较适宜,微生物快速增殖导致产热增多,水分消耗,曲温和品温迅速升高,室温逐渐上升,不耐热的微生物死亡,此阶段曲温和室温相差不大且上升趋势明显,室温也有较明显上升。在微生物迅速凋亡期,曲温持续高温,微生物大量死亡,曲温、品温、室温差距较大,由于大曲水分较低微生物生长受到抑制,室温开始下降。并房后,大曲水分低不适合微生物的生长,曲温迅速升高后逐渐缓落。由此可见,微生物大量繁殖期,曲温、品温和室温差距较小且保持上升趋势;微生物凋亡期,曲温和品温仍保持高温,但室温开始下降;后缓落期,曲温、品温、室温都开始下降,曲温下降缓慢,品温和室温下降较快且二者接近。根据温度的变化可以快速判断微生物的生长凋亡,这对浓香型大曲的生产具有一定的参考意义。
曲块初始糖化力较高,但无酿酒所需糖化、发酵、产酒和提香等功能,在微生物快速增长期下降,又随着霉菌数量的增长而升高。曲皮和曲芯处糖化力的形成时间不同,在酿酒中糖化力不是越高越好,俗话说“曲是酒之骨”,细菌是生香动力,霉菌是糖化动力,酵母菌是发酵动力,这些微生物彼此协同才能酿造出美酒佳酿。

