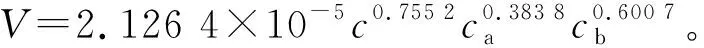三乙胺废水的芬顿实验研究
邓泽宇,张利华,王翼潇,周珉,张海涛,钱炜鑫
(1.华东理工大学 化工学院,上海 200237;2.上海化学工业区中法水务发展有限公司,上海 201507)
三乙胺广泛运用于农药、医药等工业领域[1],生产过程中产生含有三乙胺的大量废水,若直接排入,会对环境造成污染,危害人类健康。现阶段有关三乙胺废水处理的相关研究较少,且其中多数是探究特种菌株对三乙胺降解研究[2-3]。部分研究者采用化学氧化法处理三乙胺[4-5],目前还未有Fenton氧化三乙胺的研究报道。为了优化三乙胺处理工艺,探究工艺盲点,本文考察Fenton氧化法对三乙胺废水的处理效果及反应动力学。
1 实验部分
1.1 试剂与仪器
三乙胺、浓硫酸、氢氧化钠、硫酸亚铁、30%过氧化氢、异丙醇、氯化钙、氯化铁、硫酸镁等均为分析纯。
ZR4-6混凝试验搅拌机;MS204S电子天平;PHs-3c pH计;DL-4C离心机;PF-8000活性污泥呼吸仪。
1.2 实验用水
工业生产含三乙胺的废水,排放水量无明显规律,三乙胺浓度波动较大,不能稳定,不能满足日常实验水样要求,故实验用废水为三乙胺试剂配制的三乙胺模拟废水,三乙胺107 mg/L,pH 10.6。
1.3 分析方法
三乙胺含量测定采用顶空-气相色谱法测定[6];pH采用GB/T 6920—1986《水质pH值的测定 玻璃电极法》测定。
1.4 实验方法
取500 mL模拟废水置于烧杯中,用稀硫酸调节溶液pH 2.5,加入0.5 g/L硫酸亚铁固体,待固体溶解后,加入过氧化氢6.6 g/L,室温下以250 r/min搅拌反应120 min。反应结束后,加入氢氧化钠溶液,调节pH至8~8.5,静置30 min,取清液进行分析测定。
2 结果与讨论
2.1 自由基消除实验
为探究Fenton氧化法是否具有氧化三乙胺的能力,在pH=2.5,Fe2+=100 mg/L,H2O2=6.6 g/L的条件下进行反应,出水三乙胺去除率达49%,结果表明Fenton氧化对三乙胺废水具有较好的处理效果。目前广泛认可的是Fenton试剂生成具有强氧化性的羟基自由基·OH,进而降解有机污染物[7-8]。本次实验为分析Fenton法氧化三乙胺与·OH 的联系,添加异丙醇作为·OH猝灭剂[9],分析Fenton氧化三乙胺实验中主要起氧化作用的活性物质。实验条件:在Fe2+=100 mg/L,500 mL的三乙胺模拟废水中加入5 mL/L的异丙醇,进行Fenton氧化实验,结果见图1。

图1 Fenton氧化加与不加异丙醇的处理效果对比Fig.1 Fenton oxidation with and without the addition of isopropanol
由图1可知,在添加异丙醇作为·OH抑制剂后,Fenton氧化三乙胺去除率最高只有3%,可以认为三乙胺并没有被氧化,这说明Fenton氧化反应中,·OH是氧化去除三乙胺的主要活性物质。
2.2 初始pH值的影响
根据研究,Fenton氧化只能在酸性条件下进行,在中性及碱性环境中,Fe2+不能催化H2O2生成·OH,同时当pH过高时,Fe2+会形成氢氧化物形式的沉淀,使溶液中的催化剂浓度下降,抑制·OH的生成。在室温条件,调节溶液pH值,依次加入 100 mg/L 的硫酸亚铁及6.6 g/L的H2O2,三乙胺在不同pH值条件下的去除率见图2。

图2 初始pH值对三乙胺去除率的影响Fig.2 Effect of starting pH on the removal rate of triethylamine
由图2可知,pH值为2.5时,三乙胺去除率最大,当pH值<2.5时,三乙胺去除率有所下降,这是因为在pH过低时,溶液中过量的H+会影响式(1)的进行,抑制Fe3+转换为Fe2+,不利于催化氧化反应的进行。当pH值>2.5,三乙胺去除率会随着pH值的升高而迅速下降,当pH>7时,三乙胺基本没被去除,过高的氢氧根离子与Fe2+生成氢氧化合物絮状沉淀,从而降低Fenton反应的氧化效果。
Fe3++HO2·→ Fe2++H++O2
(1)
2.3 Fe2+投加量的影响
在室温条件下,500 mL三乙胺模拟废水pH调至2.5后,加入H2O26.6 g/L,探究Fe2+浓度对氧化去除三乙胺效果的影响,结果见图3。

图3 FeSO4投加浓度对三乙胺去除率的影响Fig.3 Effect of FeSO4 dosing concentration on the removal rate of triethylamine
由图3可知,当溶液中不投加Fe2+时,H2O2氧化速率缓慢,效果不明显。随着Fe2+浓度的增大,Fenton氧化三乙胺的去除率逐渐升高,在Fe2+投加量500 mg/L时,三乙胺去除率达到74%,此后再增大Fe2+投加量,三乙胺去除率并未有明显升高。这是因为Fe2+作为Fenton氧化反应过程中的催化剂,在浓度过低时,催化效果不佳,使得过氧化氢分解产生·OH的速度与数量都很小,Fenton氧化反应速度慢;当Fe2+浓度过量时,Fe2+与过氧化氢快速产生大量的·OH,过量的·OH会与铁离子发生氧化还原反应,还会与其它自由基发生链反应[10-11],如式(2)、式(3)所示,造成了药剂的浪费。综合考虑到成本等因素,Fe2+浓度最佳投加量为500 mg/L。
Fe2++HO·→ Fe3++HO-
(2)
HO·+H2O2→ HO2·+H2O
(3)
2.4 H2O2投加量的影响
在室温条件下,500 mL三乙胺模拟废水pH调至2.5后加入硫酸亚铁500 mg/L,H2O2投加浓度对三乙胺的去除效果见图4。
由图4可知,Fenton氧化三乙胺去除效果随着过氧化氢投加量的增加而升高,在低H2O2投加浓度情况下,三乙胺去除率接近于0,根据Lewis理论[12],三乙胺上的氮原子可以提供孤电子对,而使得三乙胺水溶液呈碱性,氮原子上的电子云密度大,反应活性强,三乙胺更易发生氧化还原反应。但Fenton反应需要在酸性条件下进行,当废水中加入酸溶液后,三乙胺上的氮原子通过配位键获得一个氢离子,发生质子化反应,使得氮原子附近的电子云密度降低,难以被氧化[13],同时,在强酸性条件下,三乙胺不会发生氧化反应。故Fenton氧化处理三乙胺,需要投加足量的过氧化氢,才能氧化三乙胺,在H2O2投加量达到13.2 g/L时,三乙胺去除率达到98%,三乙胺易被去除完全。因此,确定H2O2最佳投加量为13.2 g/L。Fenton反应随着H2O2浓度的增加使分解产生的·OH增多,大大增加了反应速率。但当过氧化氢浓度过高时,会将Fe2+氧化成铁离子,H2O2会与铁离子发生副反应,这样既消耗了过氧化氢,还抑制了·OH的产生。

图4 过氧化氢投加浓度对三乙胺去除率的影响Fig.4 Effect of hydrogen peroxide dosing concentration on the removal rate of triethylamine
2.5 反应时间的影响
在室温条件下,500 mL三乙胺模拟废水pH调至2.5后,加入硫酸亚铁500 mg/L,H2O213.2 g/L,探究不同反应时间对三乙胺的去除效果,结果见图5。

图5 反应时间对三乙胺去除率的影响Fig.5 Effect of reaction time on the removal rate of triethylamine
由图5可知,反应体系的三乙胺去除率随反应时间增加而增加,在前30 min反应时间内,Fenton试剂产生大量的·OH,与废水中的三乙胺迅速进行氧化反应,三乙胺浓度被大幅度去除,随着反应的继续进行,三乙胺的去除率上升幅度在逐渐减缓,反应时间达到90 min之后,三乙胺去除率就趋于平缓。考虑到实际操作时需要严格控制处理费用以及避免过氧化氢在体系的副反应,芬顿氧化三乙胺实验反应时间90 min为宜。
2.6 反应动力学
研究Fenton氧化三乙胺动力学,有利于获得反应优化条件,并有效解释了芬顿氧化三乙胺的降解规律,对Fenton试剂在污水厂实际操作中具有指导作用。在最佳pH下,Fenton氧化三乙胺废水的动力学研究主要以三乙胺质量浓度(c)、亚铁离子浓度(ca)、过氧化氢浓度(cb)对反应速率的影响。芬顿氧化过程可用以下反应动力学模型表示[14-15]。
(4)
其中,K是总反应速率常数,m、n、j分别是三乙胺、亚铁离子、过氧化氢的反应级数。对式(4)取对数,得。
(5)
在Fenton试剂投加量一定时,设lnK+nlnca+jlncb=lnK′,由图5可知,三乙胺浓度与反应时间(t)的关系,经拟合后的多项式如下。
c=0.009 9t2-1.975t+99.157
R2=0.990 9
(6)
对式(6)求导,代入反应时间,即可求得不同时刻的反应速率。
(7)

R2=0.959 8
(8)
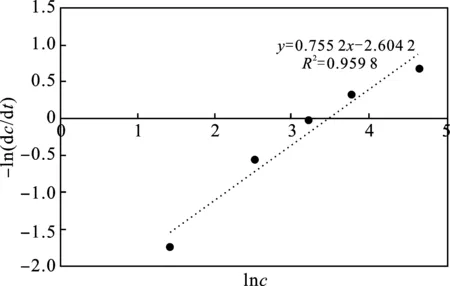
图6 lnc-ln(dc/dt)关系图Fig.6 lnc-ln(dc/dt) relationship diagram
由此推出,三乙胺反应级数m=0.755 2,lnK′=-2.604 2。
同理,由实验数据进行多项式拟合,分别见图7和图8。

图7 不同H2O2浓度下c-t图Fig.7 c-t Plots for different H2O2 concentrations

图8 不同Fe2+浓度下c-t图Fig.8 c-t Plots for different Fe2+ concentrations
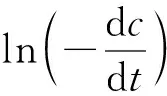

图9 lnca0与-ln(dc/dt)的关系Fig.9 lnca0 versus -ln(dc/dt)
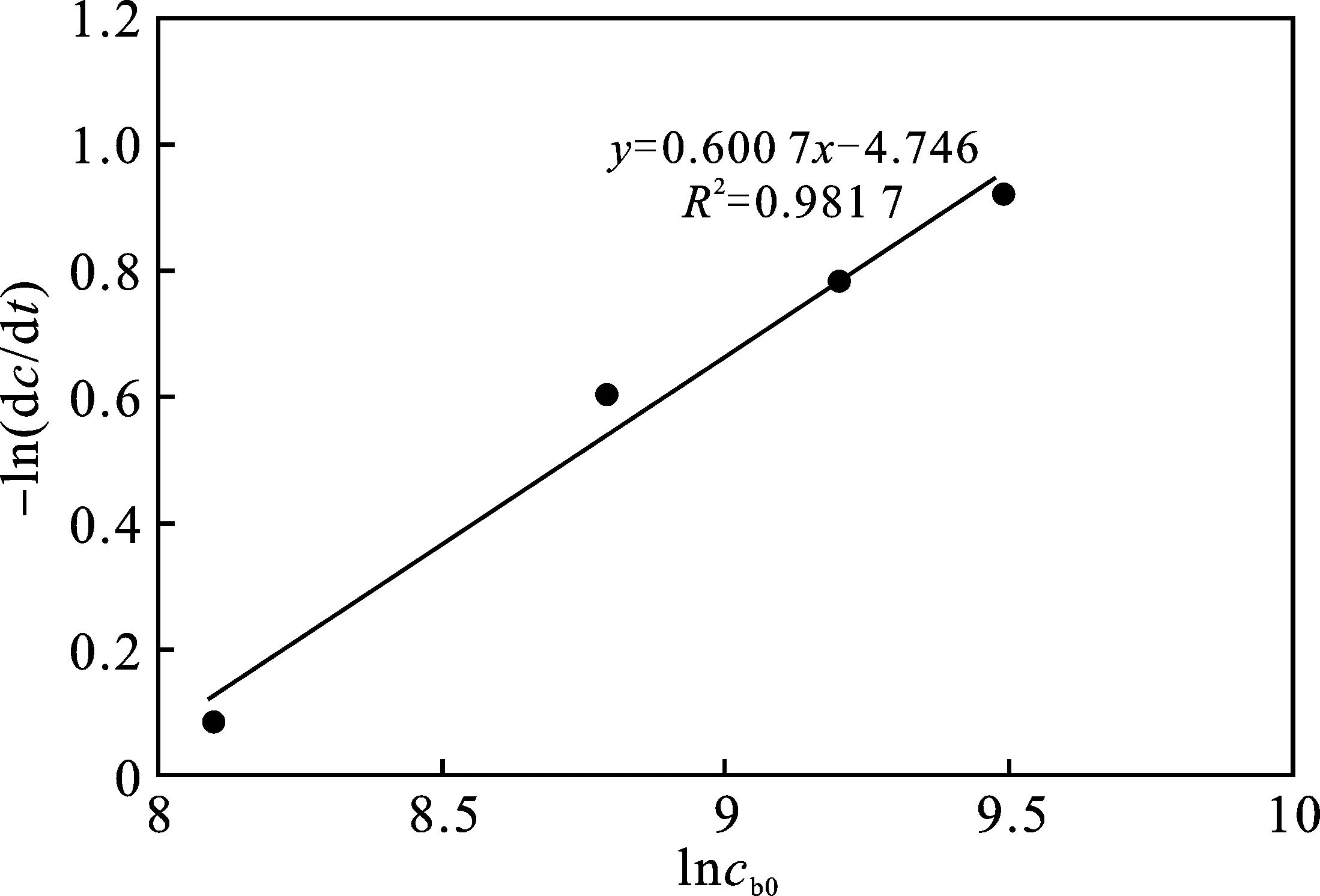
图10 lncb0与-ln(dc/dt)的关系Fig.10 lncb0 versus -ln(dc/dt)
由图9和图10可知,各直线相关性很高,由此可确定j=0.600 7,lnK″=-4.746,n=0.383 8,lnK″′=-1.770 6。
在c=102 mg/L,ca=500 mg/L,cb=13.2 g/L条件下,通过计算可得速率常数K=2.126 4×10-5,再将计算结果代人式(4),得到芬顿氧化处理三乙胺废水的动力学方程。
(9)
3 结论