葛根素抑制内质网应激减轻压力负荷引起小鼠心肌肥厚实验研究
刘艳丽,董文婷,尚福军,冯海涛,郭 锦,王 锦
(1.西安国际医学中心医院,陕西 西安 710100;2.西安市临潼区妇幼保健院,陕西 西安710600)
心肌肥厚是心脏受到各种刺激时,为了维持心输出量,出现的一种适应性和代偿性反应[1]。由于成熟心肌细胞已经成为一种终末分化细胞,几乎丧失分裂和增殖能力,只能通过肥厚性重塑改变其体积和重量以增加心肌收缩力[2]。然而,长期的慢性刺激如高血压会导致心脏失代偿而进展为病理性心肌肥厚,并最终导致心脏功能障碍和心力衰竭。临床研究[3-4]表明,心肌肥厚是触发心力衰竭发生不良后果和心血管死亡事件增加的一个独立危险因素,会导致扩张型心肌病、缺血性心脏病甚至猝死。心肌肥厚是一个非常复杂的病理重塑过程,伴有心肌纤维化、细胞凋亡和心脏功能障碍[5-6]。然而,临床上缺乏防治病理性心肌肥厚的药物。葛根素(Puerarin,Pue)是黄酮类化合物,化学名为7,4’-二羟基异黄酮-8β-吡喃葡萄糖苷,是从中药葛根中提取的主要活性成分[7]。葛根素的药理作用包括改善微循环、降低炎性反应和细胞凋亡、清除氧自由基和改善胰岛素抵抗,使其成为治疗高血压、脑缺血、心肌缺血、糖尿病和动脉硬化的潜在药物[8-9]。但是Pue能否通过内质网应激调节心肌肥厚尚不清楚。本实验将通过腹主动脉缩窄(Abdominal aortic constriction,AAC)方法建立心肌肥厚动物模型,观察Pue灌胃给药4周后对压力负荷引起的心肌肥大及对内质网应激的调控作用。
1 材料与方法
1.1 实验动物与试剂 在西安交通大学实验动物中心购买60只8周龄成年雄性C57/bl小鼠;Pue(P5555)购买于Sigma公司;RNA提取试剂盒和反转录试剂盒(FP209)购于天根生化科技(北京)有限公司;PERK(3192S)、CHOP(2895S)和GRP78(3183S)抗体均购自Cell Siginal Technology公司;GAPDH(60004-1-Ig)、辣根过氧化物酶标记的山羊抗鼠(PR30012)和山羊抗兔(PR30011)二抗购自武汉三鹰生物技术有限公司。
1.2 心肌肥厚模型的制备 待雄性C57/bl小鼠麻醉后,将小鼠固定于小动物手术操作台上,行气管插管并连接呼吸机,采用AAC引起心肌肥厚。方法如下:无菌条件下通过腹部中线切口暴露腹主动脉,并沿腹主动脉放置一根18号针。在腹主动脉和肾动脉上方的针头周围紧密地绑着一条结扎线(7-0丝线)。随后取下针头,形成缩窄区。假手术组小鼠手术操作与模型组相同,但不结扎腹主动脉。手术完成后,逐层缝合,并将小鼠放在暖垫上,待到它们从麻醉中恢复。
1.3 实验分组 60只小鼠随机分成四组(n=15):假手术组(Sham组);Pue对照组(Pue组);腹主动脉缩窄术组(AAC组);Pue干预AAC组(Pue+AAC组)。根据以往文献[10]报道,Pue组和Pue+AAC组术后腹腔注射50 mg/(kg·d) Pue,持续4周,Sham组和AAC组腹腔注射等量的0.9%氯化钠溶液,持续4周,所有小鼠均采用正常饮食,可自由摄取水和食物。
1.4 小动物超声检测心脏功能 采用小动物超声仪检测心脏功能,AAC术后4周,小鼠麻醉后采用脱毛膏去除胸前区被毛,用VEVO 770小动物超声仪检测左室后壁厚度(Left ventricular posterior wall thickness,LVPWd)、左室内径(Left ventricular diameter,LVId)和室间隔厚度(Interventricular septal depth,IVSd)。
1.5 RT-PCR检测ANP和Myh7 mRNA水平 根据RNA提取试剂盒步骤提取心脏组织总RNA,采用分光光度仪检测RNA浓度,并用反转录试剂盒生成cDNA;配制总体积为20 μl的反应体系,其中包括:cDNA 2 μl、超纯水7.4 μl、引物0.8 μl和SYBR Green Mix 9 μl。扩增程序设为:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火15 s,72 ℃延伸10 s,共38个循环。计算Ct值、2-ΔΔCt值。以GAPDH作为内参,引物序列见表1。

表1 PCR扩增引物序列
1.6 心脏重量与体重比值 实验结束后,将小鼠麻醉称重并记录每只小鼠体重(Body weight,BW),然后通过颈动脉放血将小鼠处死,快速开胸取下心脏并称重,记录心脏重量(Heart weight,HW),计算心脏重量/体重比值(HW/BW)。
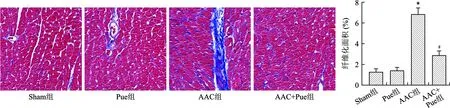
1.7 Masson染色 实验结束后,将小鼠麻醉,快速开胸取出心脏,在预冷的PBS中冲洗,然后放入4%多聚甲醛中固定,行常规二甲苯和梯度乙醇脱水,石蜡包埋,并切成3 μm厚的薄片。行常规Masson染色方法步骤,染好后用中性树脂封片,在普通光学显微镜下拍照,Image J软件计算纤维化面积比例。
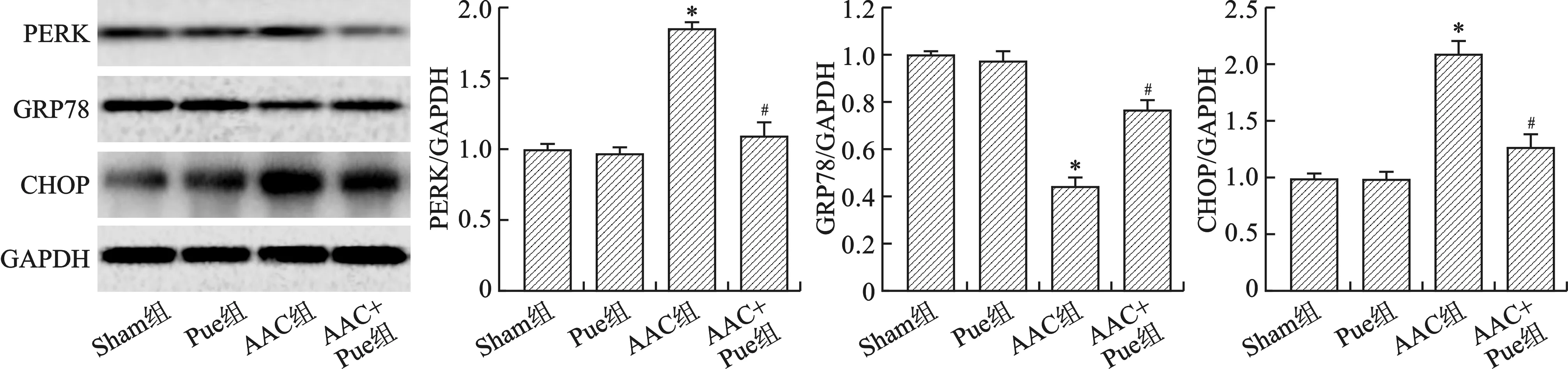
1.8 Western blot检测PERK、GRP78和CHOP蛋白的表达 常规方法提取心脏组织蛋白,BCA法定量蛋白浓度;配制SDS-PAGE凝胶,每孔蛋白样品上样量相同,恒压90 V电泳100 min,湿转法恒流200 mA转膜90 min;将转好的PVDF膜用5%脱脂奶粉室温封闭90 min;根据分子量大小将目的条带切下分别放入PERK(1∶1000)、GRP78(1∶1000)、CHOP(1∶1000)和GAPDH(1∶5000)抗体管4 ℃摇床孵育12 h;TBST洗膜3次,10 min/次,用辣根过氧化物酶标记的山羊抗兔(1∶5000)和山羊抗鼠二抗(1∶5000)室温摇床孵育120 min,TBST洗膜3次,10 min/次,ECL显色,Image J软件进行灰度值分析。
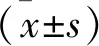
2 结 果
2.1 Pue改善AAC引起的心脏室壁厚度增加 见图1。和Sham组比较,Pue组LVPWd、IVSd和LVId值无统计学差异(均P>0.05);和Sham组比较,AAC组LVPWd和IVSd值增加,LVId降低(均P<0.01);和AAC组比较,AAC+Pue组LVPWd和IVSd值降低,LVId增加(均P<0.01)。
注:与Sham组比较,*P<0.01;与AAC组比较,#P<0.01
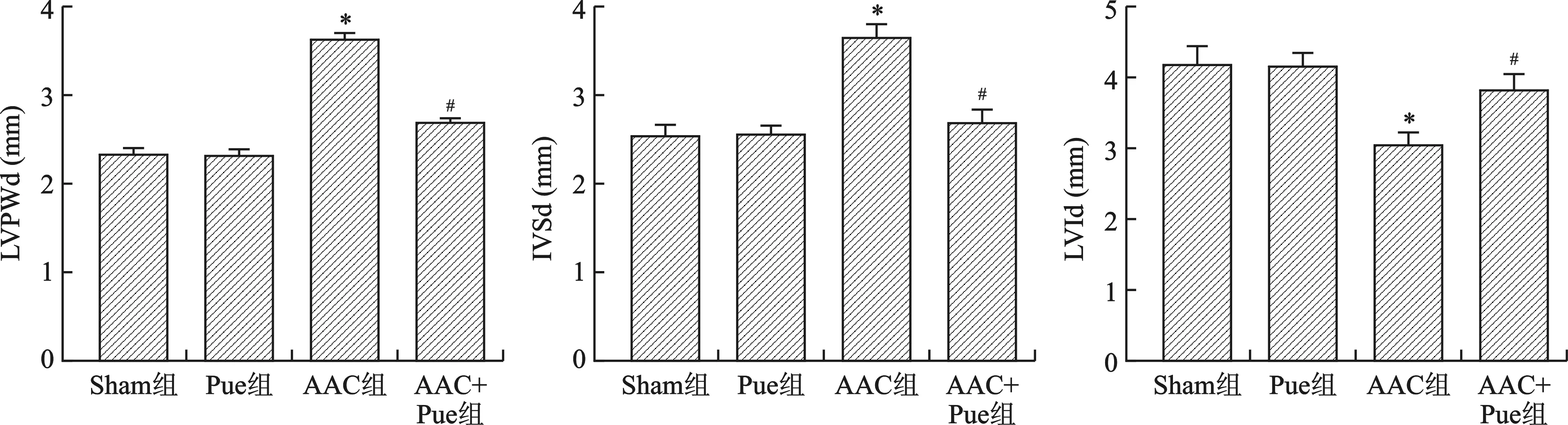
2.2 Pue抑制AAC引起的HW/BW值、ANP和Myh7 mRNA水平增加 见图2。和Sham组比较,Pue组HW/BW值、ANP和Myh7 mRNA水平均无统计学差异(均P>0.05);和Sham组比较,AAC组HW/BW值、ANP和Myh7 mRNA水平增加(均P<0.01);和AAC组比较,AAC+Pue组HW/BW值、ANP和Myh7 mRNA水平降低(均P<0.01)。
注:与Sham组比较,*P<0.01;与AAC组比较,#P<0.01
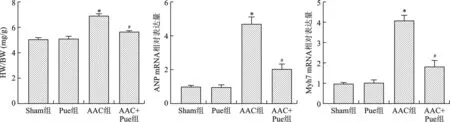
2.3 Pue抑制AAC引起的心肌细胞增大 见图3。WGA染色结果显示Sham组和Pue组心肌细胞横截面积比较无统计学差异(均P>0.05);和Sham组比较,AAC组心肌细胞横截面积明显增加,和AAC组比较,AAC+Pue组心肌细胞横截面积减小(均P<0.01)。
2.4 Pue抑制AAC引起的心肌纤维化 见图4。Masson染色结果显示Sham组和Pue组心肌纤维化程度比较无统计学差异(均P<0.01);和Sham组比较,AAC组心肌纤维化程度明显增加(P<0.01);和AAC组比较,AAC+Pue组心肌纤维化程度降低(P<0.01)。
2.5 Pue抑制AAC引起的内质网应激 见图5。和Sham组比较,Pue组内质网应激相关蛋白PERK、GRP78和CHOP蛋白表达均无统计学差异(均P>0.05);和Sham组比较,AAC组PERK和CHOP蛋白表达明显增加,GRP78表达降低(均P<0.01);和AAC组比较,AAC+Pue组AAC组PERK和CHOP蛋白表达明显减少,GRP78表达增加(均P<0.01)。
注:与Sham组比较,*P<0.01;与AAC组比较,#P<0.01
注:与Sham组比较,*P<0.01;与AAC组比较,#P<0.01
注:与Sham组比较,*P<0.01;与AAC组比较,#P<0.01
3 讨 论
心肌肥厚是心脏对生理或病理性刺激的一种代偿性反应机制,成年心肌细胞没有增殖能力,只能通过单个细胞面积和体积增大,增加心室肌壁厚度和质量,进而维持心肌收缩力、心输出量和全身循环血量的需求[10]。心肌肥厚涉及多种复杂的机制,包括血流动力学、神经体液激素激活、生长因子/细胞因子、缺氧、衰老和糖尿病等一系列的变化,表现为心肌细胞质量增加、肌节重排和心肌间质细胞外基质沉积。流行病学研究表明,心肌肥厚是心血管病发病和死亡的独立危险因素[11]。阐明心肌肥厚的病理机制并寻找潜在的防治方法成为研究的重要方向。
Pue作为传统中药葛根中提取的主要生物活性成分,在心血管疾病如缺血再灌注、心肌梗死、糖尿病心肌病和动脉粥样硬化等方面均具有较好的治疗效果,在临床上得到了广泛应用,其作用机制与抑制细胞凋亡、降低氧化应激、减轻炎性反应有关[12-14]。Pue在心肌肥厚中的作用也得到了广泛关注,有研究报道,在血管紧张素Ⅱ诱导的小鼠心肌肥厚模型中,Pue可通过上调miR-15b/195抑制TGF-β信号通路减轻心肌肥厚[15];Pue还能激活Nrf2并调控ROS含量,抑制氧化应激损伤和心肌肥厚[16];此外Pue还可以通过激活Sirt1信号改善心肌缺血再灌注损伤[8],但Pue在AAC引起的心肌肥厚中的作用和机制还未见报道。本实验发现,Pue干预AAC能明显减小LVPWd和IVSd值,增加LVId,Pue可以降低AAC引起的HW/BW值、ANP和Myh7 mRNA水平增加;心肌肥厚会导致心肌细胞横截面积增大、细胞外基质重塑引起心肌纤维化加重。本实验发现,AAC引起的心肌肥厚中心肌细胞横截面积和纤维化明显增加,而Pue干预AAC可明显降低心肌细胞横截面积和纤维化,这些结果表明,Pue能够改善AAC引起的心肌肥厚。
内质网是细胞内一种重要的细胞器,在蛋白质合成、折叠和转运,钙稳态的调控以及脂质合成中均发挥关键作用[17-19]。在某些病理因素的刺激下,内质网功能稳态被破坏,导致错误折叠和未折叠蛋白质的积累,进而触发内质网应激[20]。内质网应激通过影响转录和翻译,激活未折叠蛋白反应以恢复内质网功能的稳态。然而,过度的内质网应激会导致细胞功能障碍并诱发细胞凋亡。研究表明,内质网应激参与各种心脏病的发展和进展,如心肌肥大、缺血性心脏病和心力衰竭[21]。本实验发现,AAC明显增加内质网应激蛋白PERK和CHOP的表达,降低GRP78表达;而Pue干预AAC后抑制PERK和CHOP的表达,增加GRP78的表达。
综上所述,本实验结果说明,Pue能通过抑制心肌纤维化改善AAC引起的心肌肥厚,其作用机制与减轻内质网应激有关。这些结果为临床上进一步探讨Pue治疗心肌肥厚提供了实验依据。然而,这项研究仍存在一定的不足,由于只观察了心肌肥厚时Pue对内质网应激的作用,而没有探讨Pue如何调控内质网应激,因此,应当进一步阐明Pue调控内质网应激的信号通路。
——疾病防治的新靶标

