东海陆架海水和沉积物中藻类生物标志物的分布特征与比较
王婷男,贺娟,贾佳源,贾国东,陈岭娣,李丽
同济大学海洋与地球科学学院,海洋地质国家重点实验室,上海 200092
海洋浮游植物个体虽小,但分布广泛,数量众多,生长周期快,是全球重要的初级生产力贡献者。它们对环境变化敏感,是良好的环境气候变化研究材料[1]。边缘海虽然占全球海域面积较小,但却是重要的海洋和陆地来源有机碳的埋藏中心,对海洋生物泵、全球海洋储碳、海洋在地球系统气候调节中的作用都有重要影响[2-3]。
东海是北太平洋西部最大的边缘海之一,陆架宽阔,是有大河淡水输入的典型河海混合区域。水文和物理条件多样,浮游藻类分布广泛,海洋初级生产力高[4-6]。受陆架和开阔海洋相互作用的影响,东海区域浮游植物生物量和群落结构在季节和空间上都有很大的变化,为定性定量研究不同浮游植物类群与环境因子的关联和响应提供了理想环境[4-5,7-12]。东海陆架区域受河流和上升流输入的高营养物质影响,浮游植物生产力高且季节性变化明显,夏季生产力较高[5,8,11-13]。如1997—1998 年夏季平均初级生产力约为其他季节的3 倍[8],夏季表层叶绿素a 浓度最高[13]。大陆架外受台湾暖流和黑潮的影响大,营养盐浓度虽然随季节变化,但初级生产力较低,且季节变化相对不显著[8,14]。浮游植物分布整体呈现以水团为主,在陆架和海洋水域分别有高丰度的硅藻、甲藻和定鞭藻[15-17]。高生物量和高初级生产力主要分布在远离河口的冲淡水和外海海流交汇的水域[4-5,8,11,14-15]。在长江口及其邻近海域,已应用多种手段定性定量地探讨浮游植物群落的组成和分布,显示其变化的复杂性,包括拖网和显微镜镜下鉴定[4,18-21]、叶绿素a[5,8,11,22]、遥感[5,10-12]、色素[7,9]、分子微生物分析[23-25]和模拟[14,21,26]。
脂质生物标志物由于其来源特异性、分布广泛性和保存稳定性,为研究过去和现在地球生态系统提供了强有力的方法[27-28]。现代海洋环境中的生物标志物研究不仅为古环境重建应用提供数据支持,而且为阐明海源有机质在边缘海的生成、空间分布、埋藏过程及驱动机制提供不同视角的见解。东海区域已开展多项水体悬浮颗粒物(后简称颗粒物)和表层沉积物中的生物标志物研究[15,29-36],证明将脂质生物标志物作为半定量方法反映浮游植物的生产力(或生物量)和群落组成的适用性[15,35-36]。区域内表层沉积物和颗粒物中的藻类生物标志物(后简称藻类生标)主要为菜籽甾醇、甲藻甾醇和烯酮,且藻类生标含量也具有明显的时空变化[30-32,34,36]。与烯酮相比,菜籽甾醇和甲藻甾醇在近岸的含量优势明显。陆架区域整体由近岸向海方向含量增加[30,32,34,36],且夏季生物标志物含量高。与色素、遥感等其他观测资料相符[15]。还有研究应用藻类生标重建地质历史上东海浮游植物生产力和群落结构变化[37-38]。
但颗粒物和表层沉积物中脂质生物标志物的对比研究较少,已有研究显示它们的生物标志物相对含量有较大变化[29,32]。如Jeng 和Huh[29]在东海中陆架的工作显示颗粒物中菜籽甾醇含量最高,其次是胆甾醇,而沉积物中则相反。姜一晴等[32]对长江口及陆架区的样品分析显示,颗粒物中菜籽甾醇含量高,而沉积物中甲藻甾醇更有优势。沉积物中生物标志物的含量和相对比例变化是重建海洋古生产力和群落结构的基础,因此现代水柱和表层沉积物中生物标志物的组成变化对分析沉积物数据以重建古海洋的研究有重要意义。在前人研究基础上,本文选取杭州湾外东海内陆架(28.5°~32.5°N、122°~125°E)的季节性表层水体颗粒物和表层沉积物中的主要藻类生标进行分析,对比颗粒物及沉积物中生物标志物的分布特点,进一步了解东海浮游植物的时空变化规律和控制机制,探讨颗粒物和沉积物中生物标志物含量差异的原因。
1 区域概况
东海是亚热带边缘海,面积约为7.7×105km2。陆架宽广,占东海总面积的2/3,水深大部分在200 m以内,在冲绳海槽水深可达2 719 m。东海水文条件复杂,具有高度的多样性和季节性变化。主要有三大流系—沿岸流、黑潮以及位于两者之间的陆架混合流(图1a)。东海沿岸流主要包括长江口北部的 黄 海 沿 岸 流( the Yellow Sea Coastal Current,YSCC)、长江冲淡水(Changjiang Diluted Water, CDW)和长江口南的浙闽沿岸流(Zhejiang-Fujian Coastal Current, ZFCC)。黑潮从源地流经台湾以东,一部分进入台湾海峡成为台湾暖流(Taiwan Warm Current,TWC)的一部分,其余的沿台湾东海岸进入东海,沿东海大陆架外缘向东北方向流动[39]。
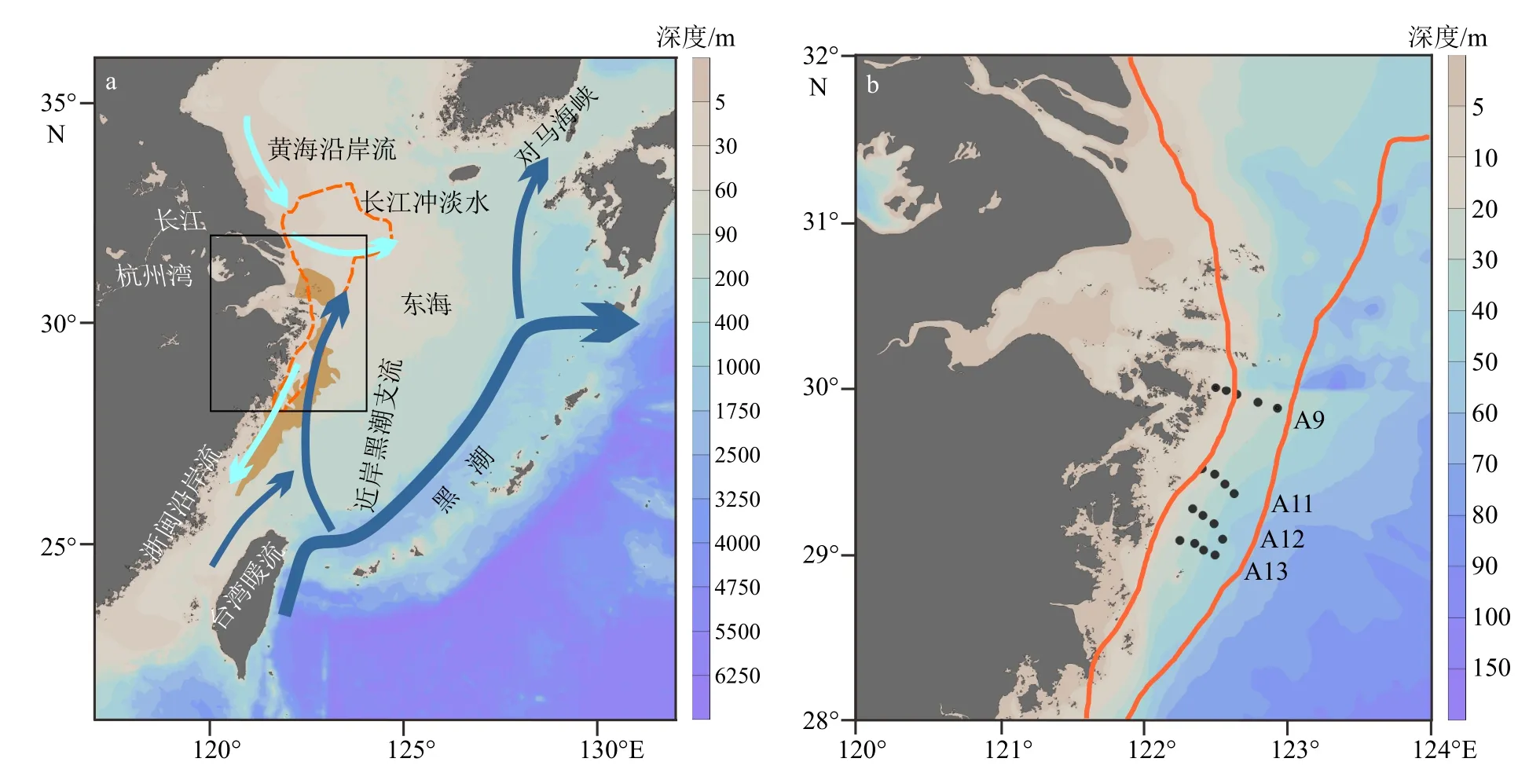
图1 研究区域(a)和取样站位图(b)黑点为取样站位,棕色轮廓区域为报道的长江口外缺氧区(据Zhang 等[40])。实心蓝色箭头指示区域海流,包括黄海沿岸流(the Yellow Sea Coastal Current, YSCC)、长江冲淡水(Changjiang Diluted Water, CDW)、浙闽沿岸流(Zhe-Min Coastal Current, ZFCC)、黑潮(Kuroshio Current,KC)、台湾暖流(Taiwan Warm Current, TWC)和近岸黑潮支流(Nearshore Kuroshio Branch Current, NKBC)。Fig.1 Study area (a) and sampling station (b)The black spots are sampling stations, and the brown line confines the reported bottom hypoxia area near the Changjiang River estuary (according to Zhang et al [40]).Solid blue arrows indicate regional currents, including: the Yellow Sea Coastal Current (YSCC), Changjiang Diluted Water (CDW), Zhe-Min Coastal Current (ZFCC), Kuroshio Current (KC), Taiwan Warm Current (TWC), and the Nearshore Kuroshio Branch Current (NKBC).
由于河流径流、季风、海流和地形的相互作用,东海的沉积系统非常复杂。按照表层沉积物粒度划分,长江口及其邻近海域表层沉积物组成以黏土质粉砂、粉砂质砂和砂为主。长江口附近及南北沿岸,粒径组成呈现明显的“南细、北粗,近岸细、离岸粗”的分布特征,长江口以北出现大片的粗颗粒沉积,长江口以南浙江近岸泥质区的表层沉积物粒度细。长江冲淡水携带的大部分陆源颗粒被季节性沿海海流输送到东海内陆架。复杂的水文动力学限制了跨陆架泥沙的输送,河流沉积物主要沉积在包括长江口泥区、浙闽沿海泥区和济州岛西南泥区[41-42]。
2 样品与分析
2.1 样品采集
选取杭州湾外东海内陆架泥质区(28.5°~32.5°N、122°~125°E)之间的海域作为研究区域,搭载国家基金委共享航次“润江1 号”或“浙渔科2 号”科考船,于2019 年3 月、7 月、10 月、2020 年7 月 和10 月,在浙闽沿岸泥质带区域采集季节性表层颗粒物和表层沉积物样品。站位水深范围为16~53 m,由北到南包括A9、A11、A12、A13 四条梯度采样断面,5 个航次采样点位置基本保持一致(图1b,表1)。避开长江河口和高浊度区,减少可能的陆源和再悬浮颗粒物的影响。表层沉积物使用箱式或抓斗采样器采集。取上层0~5 cm 沉积物,将样品装入干净的自封袋中保存在-20℃冰箱中。表层颗粒物与表层沉积物采集的位置相对应,使用有机玻璃过滤器从大体积水中过滤富集颗粒物。利用蠕动泵采集表层(0~5 m)约200 L 水体,用预先灼烧(450℃,4 h)过 和 称 重 的 玻 璃 纤 维 滤 膜(Whatman GF/F,0.7 μm 孔径,142 mm 直径)收集颗粒物。过滤后的滤膜用铝箔纸包好放入冰箱冷冻保存(-20℃)。所有采集样品带回实验室进行处理和相关指标的分析测定。共采集表层沉积物样品84 个,颗粒物样品81 个。
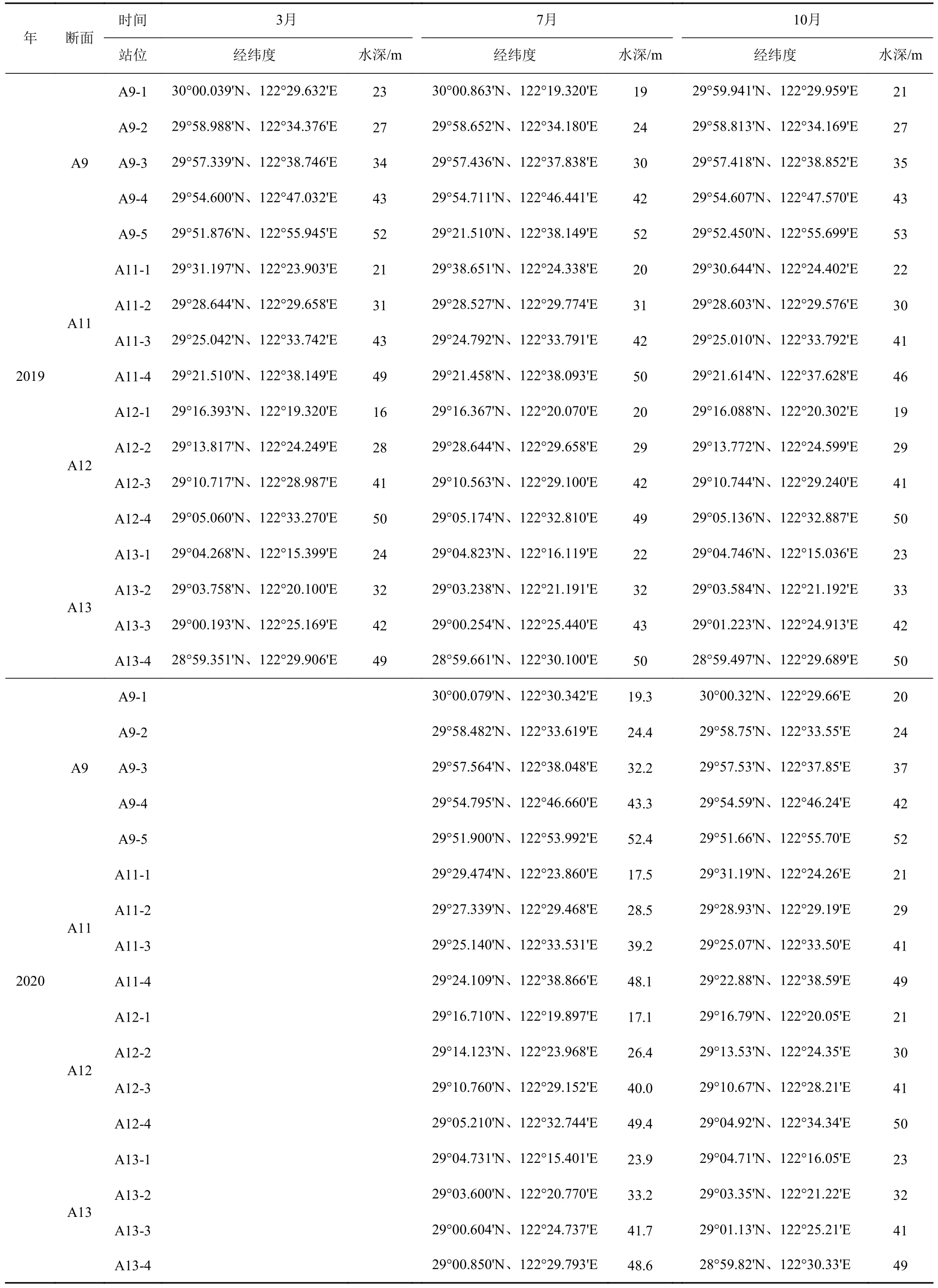
表1 采样站位信息Table 1 Information of the sampling stations
2.2 分析测试
样品前处理以及有机化合物的分析均在同济大学海洋地质国家重点实验室进行。简述如下:将采集到的表层沉积物样品以及滤膜样品冷冻干燥。沉积物样品经研磨成粉末状,海水滤膜样品剪碎后,取适量置于聚四氟乙烯塑料(Teflon)瓶中,加入适量甲醇/二氯甲烷(1∶1,v/v)溶液和内标,加盖旋紧之后涡旋震荡、超声,取上清液倒入梨型瓶,重复萃取将总抽提液蒸发浓缩得到总有机脂类。加入6%的氢氧化钾甲醇溶液进行碱水解,70℃水浴2 h 后,用正己烷萃取中性组分,过硅胶柱。分别用正己烷、二氯甲烷/甲醇(95∶5,v/v)溶液洗脱,得到含烷烃类非极性组分和包含醇、酮等极性组分。醇类组分BSTFA 衍生化后上机测试分析。
检测使用Thermo TSQ 8000 Evo 三重四级杆气质联用仪。色谱条件:配备有TG-5MS 毛细色谱柱(60 m×0.32 mm×0.25 μm),采用无分流方式进样,载气为氦气,流速为1.2 mL/min。进样口温度为270℃,检测器温度为300℃。升温程序为初始温度50℃并保持2 min,先以20℃/min 升温至200℃,再以3℃/min 升温至235℃并保持5 min,再以3℃/min升温至260℃保持3 min,以2℃/min 升温至280℃保持3 min,以2℃/min 升温至290℃保持3 min,最后以2℃/min 升温至315℃并保持5 min。通过将目标化合物与内标的出峰面积对比,对全部样品进行定量分析。质谱条件:扫描模式为全扫描(Full Scan),离子源为EI 源,离子源温度为300℃,扫描范围:m/z 50~600 amu。
3 结果
研究区域内,表层沉积物和颗粒物中检测出的醇类包括植醇、直链醇和甾醇。检测到的甾醇包括胆甾醇、胆甾烷醇、菜籽甾醇、菜籽甾烷醇、菜油甾醇、谷甾醇和甲藻甾醇等(图2)。本次研究结合生物标志物含量和研究目的以样品中相对含量较高,且来源相对单一的菜籽甾醇、甲藻甾醇和长链烯酮作为主要研究的生物标志物,分别作为硅藻、甲藻和定鞭藻的替代性指标,胆甾醇作为浮游动物的总指标[36,38,43]。
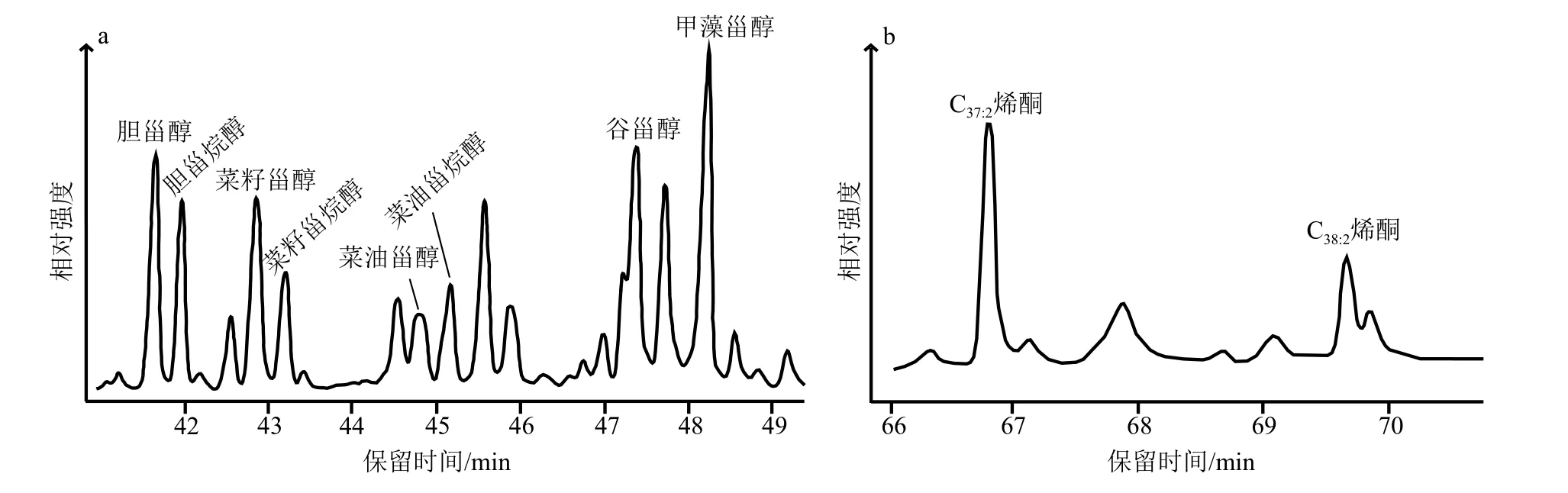
图2 样品中甾醇(a)和烯酮(b)的色谱图Fig.2 Chromatogram of sterols (a) and alkenones (b) in the samples
3.1 表层沉积物中藻类生标甾醇的含量及分布
3.1.1 季节性变化
样品中三类海洋藻类生标的含量变化范围大且有明显的季节变化。其中长链烯酮虽然在多数站位的表层沉积物中检测出来,但含量较低,总含量的平均值范围为12.7~22.2 ng/g。2019 年沉积物样品中长链烯酮在春季含量最高(22.2 ng/g),其次是秋季(14.1 ng/g)、夏季(13.0 ng/g);2020 年秋季含量为18.7 ng/g,夏季12.7 ng/g。而菜籽甾醇和甲藻甾醇都是夏季含量最高(表2)。2019 年样品中,菜籽甾醇夏、春和秋季样品含量依次降低,均值分别为575、429 和278 ng/g;甲藻甾醇依次为828、708和322 ng/g。2020 年样品中菜籽甾醇夏、秋季含量均值分别为488 和420 ng/g,甲藻 甾 醇 为1 016 和980 ng/g。浮游动物整体指标的胆甾醇也是夏季含量最高,2019 年夏、春和秋季分别为942、581 和363 ng/g;2020 年夏、秋分别为819 和704 ng/g。

表2 表层沉积物和悬浮颗粒物中不同季节主要生物标志化合物的含量变化范围及平均值Table 2 Range and average abundances of biomarkers in surface sediments and suspended particles of different seasons
3.1.2 空间分布变化
表层沉积物中的藻类生标含量在区域空间尺度上分布较一致,总体上呈现西低东高,杭州湾附近的近岸低,向外海方向高。以长链烯酮最为显著,含量最高值出现在A12 和A13 断面的东南端(图3)。菜籽甾醇和甲藻甾醇的含量在A9 断面上最低,A11、A12 和A13 断面上含量相对较高,且由岸向海随海水深度增加,藻类生标含量增加。

图3 表层沉积物中生物标志物的平面分布分别为2019 年3 月、7 月和10 月,2020 年7 月和10 月5 个时间的4 种生物标志物含量。A-E:菜籽甾醇,F-J:甲藻甾醇,K-O:烯酮,P-T:胆甾醇。Fig.3 Distribution of biomarkers in the surface sediments Abundances of four biomarkers in March, July, and October in 2019, and July and October in 2020, separately.A-E:brassicasterol, F-J:dinosterol, K-O:alkenone, and P-T:cholesterol.
3.2 水体颗粒物中藻类生标甾醇的含量及分布
3.2.1 季节性变化
颗粒物样品中大部分没有检测出长链烯酮,菜籽甾醇和甲藻甾醇含量较高且变化范围大。藻类生标含量季节变化明显,夏季含量最高,秋季次之,春季最低(表2)。2019 年菜籽甾醇在夏、秋和春季样品中的含量均值分别为134、47 和12 ng/L;甲藻甾醇为41、9 和1 ng/L。2020 年样品中菜籽甾醇夏、秋季含量分别为247 和228 ng/L;甲藻甾醇为10 和7 ng/L。胆甾醇2019 年夏、秋和春季含量均值分别为156、64 和24 ng/L;2020 年夏、秋分别为181 和180 ng/L。
3.2.2 空间分布变化
颗粒物中藻类生标的空间分布特征不明显。不同藻类生标的空间分布不同,同一藻类生标在不同季节的空间分布也有差异。但夏季样品中菜籽甾醇和甲藻甾醇含量有明显的由岸向海,随海水深度变深而增加的特征,且A12、A13 断面含量高。但秋季和春季颗粒物样品的规律性降低。相对于沉积物,出现不规律的含量高值站点。如2019 年秋季样品中,菜籽甾醇在A11-3、A13-3 站点含量高,甲藻甾醇在A11-3 站点含量高。春季样品中,菜籽甾醇在A9-3、A11-4 和A12-3 站点含量高,甲藻甾醇在A12-3 站点含量高。2020 年秋季样品中,甲藻甾醇在A9-1 站点含量高,菜籽甾醇在A11-3 站点含量高(图4)。
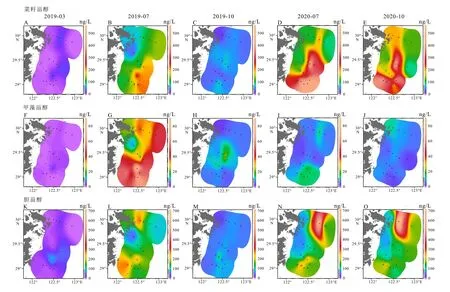
图4 表层颗粒物中生物标志物的平面分布分别为2019 年3 月、7 月和10 月,2020 年7 月和10 月5 个时间的3 种生物标志物含量。A-E:菜籽甾醇,F-J:甲藻甾醇,K-O:胆甾醇。Fig.4 Distribution of biomarkers in surface particles Abundances of three biomarkers in March, July and October in 2019, and July and October in 2020, separately.A-E: brassicasterol, F-J: dinosterol, and K-O:cholesterol.
4 讨论
生物标志物在长江口和东海陆架已有较深入的研究和应用[15,29-32,34-36,38],认识相对成熟。之前的研究已证明生物标志物的含量可以反映其对应浮游植物生物量的变化,它们的相对百分含量也可以衡量各浮游植物对总生产力贡献的大小,从而反映浮游植物及其群落结构的变化[15,35-36]。多项研究表明东海浮游植物生物量和群落结构在季节和空间上都有很大的变化[5,7-8,10,15,20]。我们的分析结果基本与前人结果一致,同时也有新的认识,以下展开讨论。
4.1 生物标志物指示的海洋藻类分布的时、空变化
2019 和2020 年样品的分析结果都显示,颗粒物和沉积物样品中菜籽甾醇和甲藻甾醇的含量占优势。烯酮与两种甾醇的差异明显,含量最低。烯酮在很多站位的颗粒物中甚至检测不到,在表层沉积物中三类藻类生标之和的占比<3%。整体来看,表层沉积物中藻类生标含量的空间分布特征明显,A9 断面上含量低,A11、A12 和A13 断面上含量相对较高,且由岸向海随海水深度增加,藻类生标含量增加。沉积物中菜籽甾醇和甲藻甾醇含量的空间分布特征更为相似,烯酮在外海更占优势。颗粒物中藻类生标含量的季节变化明显,菜籽甾醇和甲藻甾醇的含量都是夏季最高(表2,图3、4)。
研究区域内表层沉积物和颗粒物中藻类生标含量的时空变化与前人的结果一致,如菜籽甾醇和甲藻甾醇的含量优势与区域内已有的颗粒物和表层沉积物中的分析结果一致[15,29-32,34-36,44]。与硅藻、甲藻相比,定鞭藻在高盐度、低营养盐的环境下有竞争优势,对应呈现由海岸到陆架,烯酮含量随盐度增大而增加[36]。在低盐度、高营养盐的长江口附近海域硅藻和甲藻生长占优势,这与现代浮游植物的种属鉴定分析、水体色素、卫星资料和测量数据资料均相符[4-5,9,16-21]。如细胞计数显示硅藻和甲藻分别占总浮游植物种属的59.1%和35.0%[18],多年平均数据显示硅藻约占表层总叶绿素a 的52%(25°~32°N、122°~123.5°E)[5],而且我们的研究区域离岸较近,产烯酮的定鞭藻种属(Emiliania huxleyi和Gephyrocapsa oceanica) 很 低 ,Phaeocystis和Chrysochromulina等定鞭藻种属占比高[23],因此研究区域内烯酮含量很低。
藻类分布与海水温度、盐度、浊度、水动力和营养盐等密切相关,其中营养盐浓度和结构对东海表层水体中浮游植物生物量的时空变化起着重要的调节作用[4-6,14-15,21-22,26]。研究区域不仅可能受长江冲淡水输入影响,而且沿岸上升流还会将由南向北流动的黑潮次表层水和台湾暖流营养盐带到表层补给,充足的营养盐有利于浮游植物生长,且泥沙相对少,透光性较好,因而颗粒悬浮物中生物标志物含量高[15,21,36,45-47]。较高的原位海洋有机质生成、浅水和高沉积速率,再加上内陆架沉积物粒径较小,比表面积大,沉降过程中易吸附较多的有机物,且细粒泥质更有利于有机质的存储,这些因素的共同作用,使得长江口上升流区和浙闽沿海细粒沉积带表层沉积物中脂质生物标志物含量较高[15,32,34,36,42,47-50],形成整体上沉积物中生物标志物含量由近岸向海,随海水深度而增加的空间分布模式。
多项研究都表明东海浮游植物生产力在夏季高[4-5,8-9,15],如3 种脂类生物标志物在夏季的平均浓度是春季的3~61 倍[15]。夏季的高生产力通常用长江冲淡水输入大量的营养盐来解释。夏季长江流量增大,长江冲淡水的影响甚至延伸到中大陆架和外大陆架[10,20-21,51]。相较于黑潮水,长江水体相对更富集NO3-,具有较高的N/P 值[4,21,26]。夏季颗粒物样品中菜籽甾醇的比例比春、秋季低(表3),也可能说明虽然总营养盐的增加刺激了初级生产,但区域内长江冲淡水的影响大,较高的N/P 使硅藻的优势相对受到抑制。
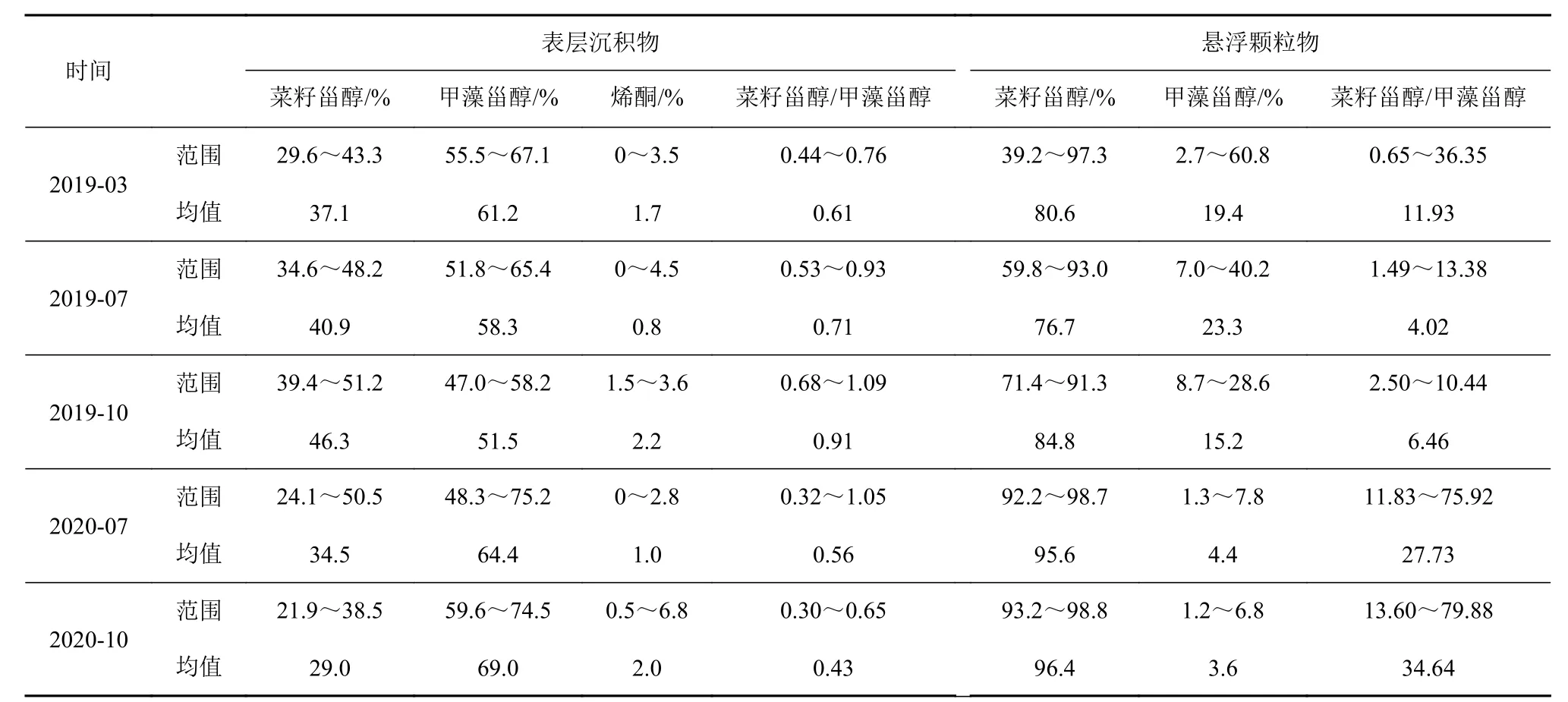
表3 表层沉积物和颗粒物中生物标志物的相对含量和比值Table 3 Percentages and ratios of biomarker abundances in surface sediments and particles
4.2 颗粒物和沉积物中生物标志物相对含量的差异
表层沉积物中的甾醇空间分布模式总体一致,近岸含量低,含量高值区主要在研究区东南部。颗粒物中除夏季样品外甾醇含量高值区分布不规律,部分高值站点与沉积物中的高值区并不完全重合。如颗粒物2019 年秋季甲藻甾醇在A11-3 站点和2020 年秋季菜籽甾醇在A9-1 站点的含量高值,并未反映在沉积物中(图3、4)。已有研究显示东海颗粒物与沉积物中藻类生标分布特征并不完全一致[29,32,36,44,52]。如颗粒物中河口区的海洋脂类生物标志物含量较高,表层沉积物中泥质区的海洋脂类生物标志物含量较高[36]。杭州湾以南,菜籽甾醇和甲藻甾醇在颗粒物和沉积物中的高值区均位于闽浙近岸,只是高值区中心不重合。在杭州湾以北,两种甾醇的分布趋势几乎无法对应[32]。藻类生标从表层产生到埋藏在沉积物这一过程中受到侧向搬运、有机质降解等诸如因素影响(见下文4.2.2 中讨论)[29,32,36]。这里我们特别关注颗粒物和沉积物中藻类生标的相对含量,即单类藻类生标含量的百分比,或生物标志物的相对比例差异。为消除生物标志物的细胞产量、侧向搬运、降解和早期成岩作用等因素的复杂作用,生物标志物重建海洋藻类生产力和群落结构方面的应用时通常基于一个假设:生物标志物的生产比率(如生物标志物/生物细胞比值)保持相对恒定,即忽略不同温度、养分、光照等环境条件对生物标志物生产率的影响;其次,生产和沉积后的降解成岩等作用对各类生物标志物的影响基本相同,不会显著改变生物标志物之间的比值。但颗粒物和表层沉积物中生物标志物含量的相对差异无疑将会影响这一重建假设(表3,图5)。以下主要通过藻类生标相对比值菜籽甾醇/甲藻甾醇进行分析讨论。
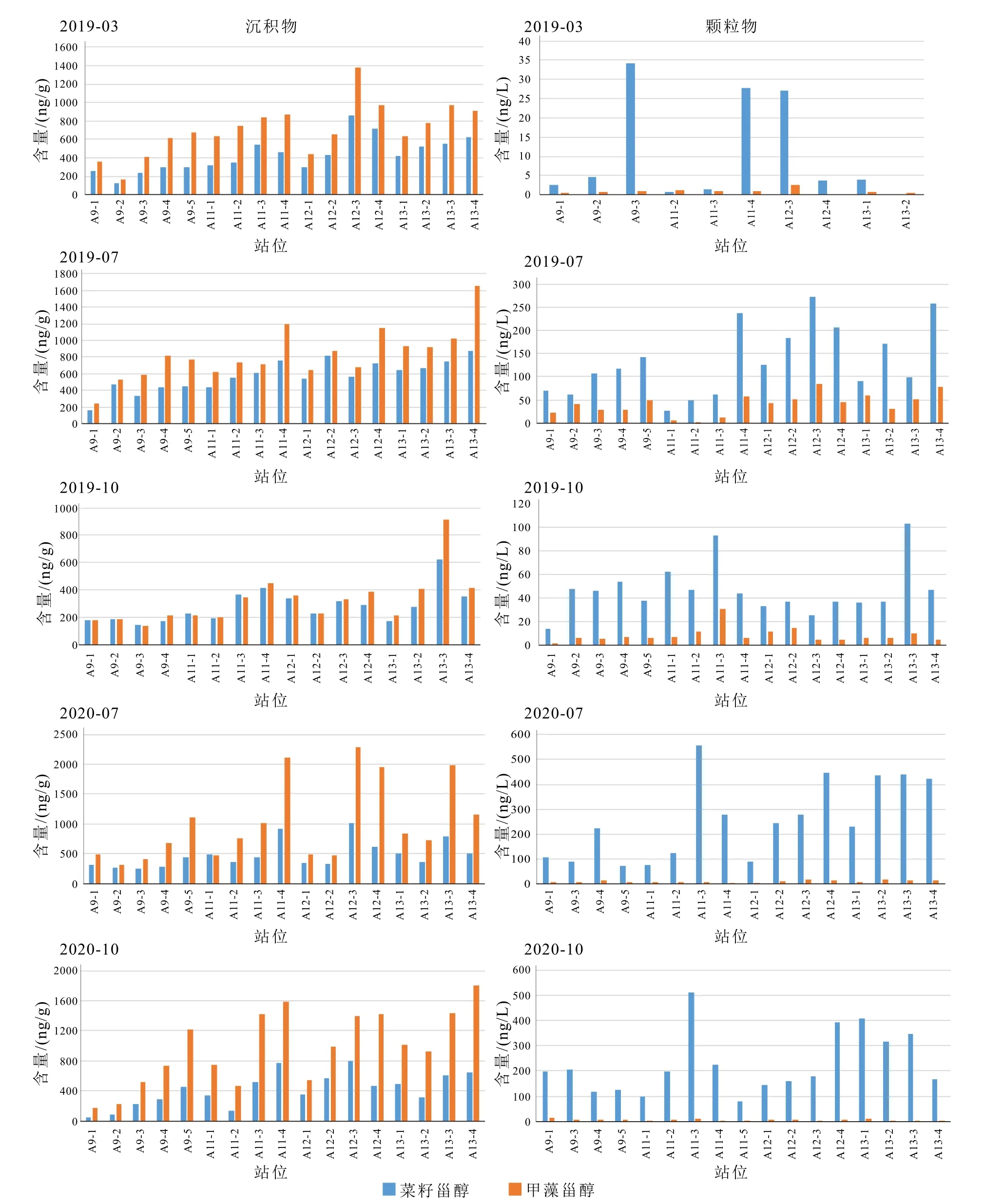
图5 表层沉积物和悬浮颗粒物中菜籽甾醇和甲藻甾醇的含量Fig.5 Abundances of brassicasterol and dinosterol in surface sediments and suspended particles
4.2.1 菜籽甾醇和甲藻甾醇在颗粒物和沉积物中的变化
本次研究颗粒物样品中菜籽甾醇丰度占绝对优势,相对含量大于75%,菜籽甾醇/甲藻甾醇比值为0.65~79.88,各季节均值为4.02~34.64。只有个别站点比值<1,如春季A11-2 站点菜籽甾醇/甲藻甾醇的值为0.65。而表层沉积物中甲藻甾醇含量显著高于菜籽甾醇,甲藻甾醇相对比例超过50%。菜籽甾醇/甲藻甾醇比值虽然相对稳定,但与颗粒物中的比值有较大差异。除少数站位外,如2019 年秋A11-1菜籽甾醇/甲藻甾醇为1.09,A11-3 为1.05,2020 年夏A11-1 为1.05,其余站位均<1(表3,图5)。
菜籽甾醇和甲藻甾醇分别被广泛用作硅藻和甲藻的生物标志物,虽然一些甲藻和定鞭藻也可以产生菜籽甾醇,一些硅藻也可以合成甲藻甾醇[43],但大量工作已证实东海海域内菜籽甾醇、甲藻甾醇与硅藻和甲藻生产力存在很好的线性关系,可以有效地指示藻类生产力的变化,较成功地半定量重建了硅藻和甲藻的生产[15,30-31,44]。在颗粒物样品中,菜籽甾醇和甲藻甾醇的相关性并不高(R2=0.03),因此认为它们主要来源于不同藻类,排除了生物源的干扰。
本次结果显示的颗粒物中菜籽甾醇相较甲藻甾醇的含量优势与前人工作一致[15,29,32,34-36,44]。如Jeng 和Hub[29]发现东海陆架区颗粒物中的菜籽甾醇/甲藻甾醇值为2~13.7。丁玲等[44]发现陆架区颗粒物菜籽甾醇/甲藻甾醇比例为1.1~36,大部分样品为1.1~5.2。姜一晴等[32]指出长江口及东海陆架区(27.5°~32°N、122°~125°E)夏季颗粒物中,菜籽甾醇/甲藻甾醇都>2,高值集中在东海北部31°N 断面上,外海比值最高达到62。Wu 等[15]发现长江口附近夏季颗粒物中菜籽甾醇/甲藻甾醇值可高达51。我们的颗粒物样品中菜籽甾醇/甲藻甾醇变化范围为4.0~34.6,与Jeng 和Hub[29]及姜一晴等[32]的研究结果类似,高比值的地理位置也相近。
颗粒物中菜籽甾醇的相对优势和东海浮游植物资料一致,显示东海浮游植物群落主要由硅藻和甲藻组成,硅藻常年占主导地位,甲藻只偶尔在春夏季占主导地位[5-6,18]。但菜籽甾醇含量优势在表层沉积物中消失,表层沉积物中菜籽甾醇/甲藻甾醇为0.4~0.9(表3)。表层沉积物中菜籽甾醇/甲藻甾醇最高值在长江口近岸处,长江口南外海沉积物中菜籽甾醇/甲藻甾醇大部分都小于1(平均为0.8),且有沿离岸方向菜籽甾醇/甲藻甾醇逐渐升高的趋势[30,32]。
4.2.2 颗粒物和沉积物中菜籽甾醇/甲藻甾醇差异的可能受控因素
表层沉积物中的甾醇分布受生物来源输入和上覆水柱中、沉积物-水界面的微生物或化学反应控制,悬浮颗粒中大多数的甾醇在沉降过程中沉积物-水界面被异养消耗从水中去除。关于表层沉积物与颗粒物中海洋藻类生标的不同分布模式,学者们提出的解释主要有:① 颗粒物和表层沉积物所对应的时间尺度不同。颗粒物仅代表很短的一个时间,而表层沉积物为几年、十几年甚至几十年的平均;② 颗粒物和表层沉积物中所对应的有机质来源的空间尺度不同。颗粒物仅代表局部情况,表层沉积物则范围更广,至少对应整个水柱的输出,往往还有水流水平输运的物质;③ 表层海洋藻类生标从产生输出直至保存到沉积物的复杂过程。除垂直运移过程中的降解和矿化作用外,还受到水平运移的海流、潮汐等影响。沉积在海底的海洋有机碳也会经历再悬浮、降解和变质转化等过程[53-54]。因此,通常将颗粒物和表层沉积物之间脂质生物标志物的不同分布模式笼统地归因于不同的时空信息,以及海洋有机质从生成到埋藏的复杂过程,如有机质在水柱中的横向运输和降解,不同粒径沉积物的保存[29,32,36]。
东海陆架区域受长江冲淡水、潮汐与各种外来流系影响,表层悬浮物质不能立即沉积,混有非“即时”生物标志物。但与悬浮颗粒相比,东海表层沉积物中的脂质生物标志物反映了几十年时间尺度上的浮游植物生产力和群落结构[36]。因此经历一年四季或几年的平均以后,脂类生物标志物在表层沉积物中的分布就可能与季节的颗粒物的分布趋势不同,特别是东海浮游藻类有显著的时空变化。虽然东海内陆架表层沉积物的总有机质混有较老(pre-aged)有机质(Δ14C=-305‰±102‰),但“老”有机质主要来自陆源,而海洋藻类生标主要为原位产生[36,55-56]。本文研究区域内表层沉积物中的有机质不仅以海洋有机质为主,而且由于较高的海洋生产力和高沉积速率(0.05~4.2 cm/a),区域有机碳的埋藏效率较高,海源生物标志物的埋藏效率可达16%~19%[36,42,48],即海洋藻类生标可以在相对较短的时间内从表层到达海底。如前所述,在研究区域及其周边,硅藻都是浮游植物群落的主要贡献者。即使受侧向搬运影响,沉积物接受相对更大范围区域的生物标志物沉降,沉积物中菜籽甾醇的优势消失难以解释。因此,颗粒物和沉积物中生物标志物含量的时空信息差异并不能很好地解释藻类生标菜籽甾醇/甲藻甾醇比值发生如此大的变化。
沉降过程中,海洋颗粒有机质不仅总量降解很大(>98%),不同有机化合物由于不同的生物地球化学特性,在水柱中或在沉积物-水界面分解速率不同,有机质组成在沉降过程中也发生改变[53-54,57-58]。有研究显示东海不同水层菜籽甾醇/甲藻甾醇的比值变化不大,说明水柱中的氧化降解对其比例的影响不明显[44]。而沉积物-水界面是一个活跃的成岩带(diagenetic zone),有丰富的微生物群落降解、转化有机物[57]。因此我们推测在沉积物-水界面上,可能发生有机质降解或转化作用,导致沉积物中菜籽甾醇/甲藻甾醇比值相较颗粒物有很大差异。
4.3 沉积物-水界面中可能发生的甾醇转化
颗粒物和表层沉积物中除了主要优势藻类生标发生改变外,我们还注意到,在颗粒物中仅少量出现的菜籽甾烷醇,在沉积物样品中的含量大量增加。颗粒物样品中菜籽甾烷醇/菜籽甾醇(brassicastanol/brassicasterol)比值一般<0.1,而沉积物中菜籽甾烷醇/菜籽甾醇比值一般>0.5(表4,图6)。

表4 表层沉积物与颗粒物中主要的甾烷醇、甾醇含量及它们的比值变化Table 4 Ranges and average of stanol and stenol, and their ratios in surface sediments and particles
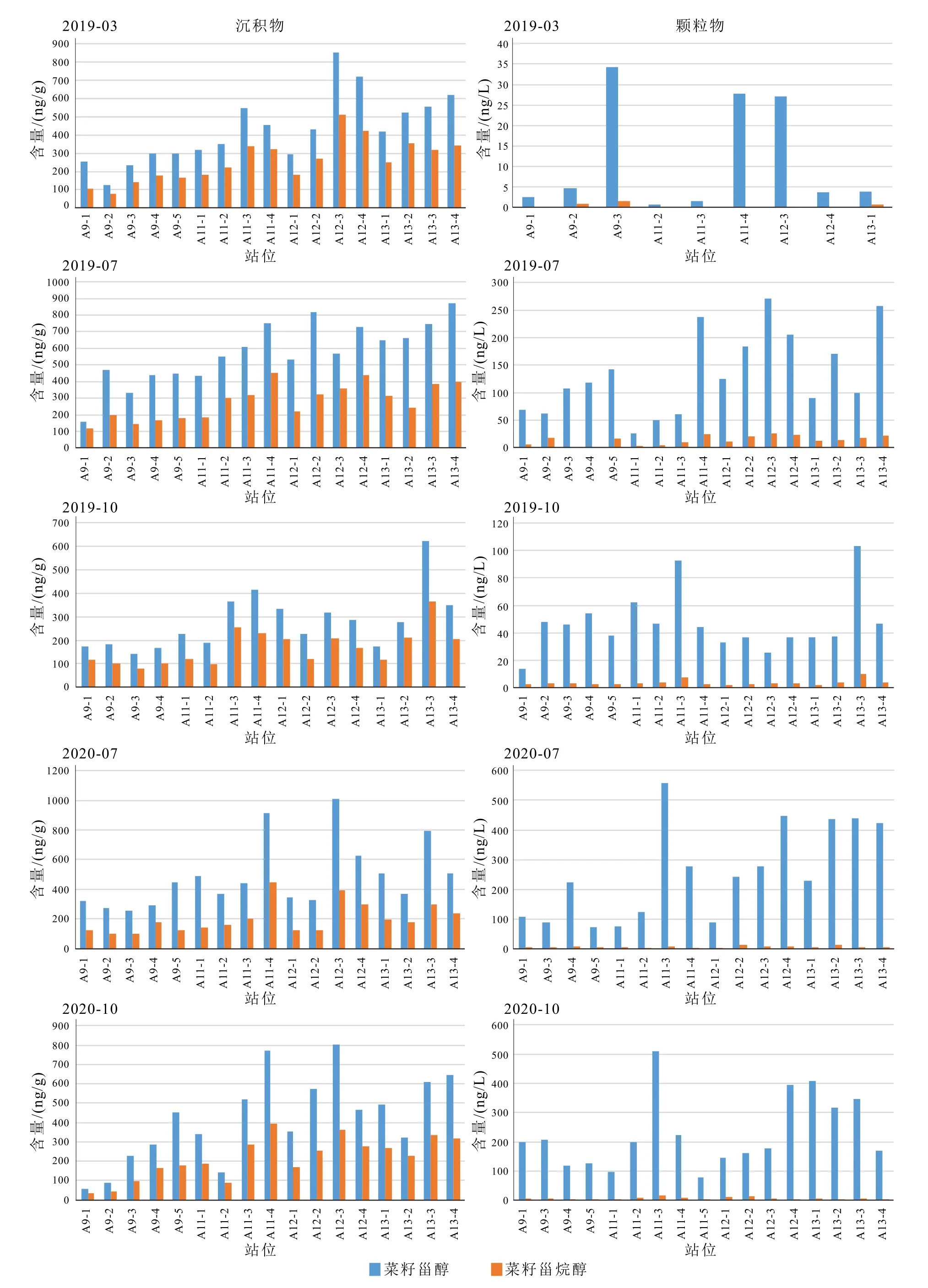
图6 表层沉积物和悬浮颗粒物中菜籽甾醇和菜籽甾烷醇的含量Fig.6 Abundances of brassicasterol and brassicastanol in surface sediments and suspended particles
早期在英格兰Rostherne 湖、黑海和非洲西南Walvis 湾等地观察到悬浮物质中的甾烷醇/甾醇(stanol/stenol)比值比沉积物中低[59-60],在海洋水柱颗粒物[61-65]和沉积物-水界面[66-69]也有类似的stanol/stenol 比例发生变化。一些学者如Gagosian 等[60]指出可能的原因有:① 在颗粒从表层到海底的过程中,发生stenol 到stanol 的转换。虽然浮游生物可以产生stanols,但它们在生物体中的比重非常低,stanols 含量通常不超过stenols 的10%。捕食、形成粪便颗粒的过程中可能增加了由肠道细菌活动形成的stanols;②在沉积物-水界面上发生stenols 的选择性降解,stanols 相对于stenols 更具有降解抵抗性,使得stanol/stenol 的比例发生改变;③ 在沉积物-水界面发生stenol 到stanol 的转化,碳骨架C5 位上有双键的甾醇(Δ5-stenol)被还原转化为甾烷醇(5α(H)-stanol),如缺氧环境中微生物作用下的加氢还原作用[62,66]。5α(H)-stanol/Δ5-stenol 比值也因此被用作氧化还原条件的示踪剂[62,70]。
在厌氧沉积物中控制Δ5-stenol 向5α(H)-stanol转化的主要因素可能是适合微生物代谢的原生有机质(即可代谢有机质)对沉积物的相对贡献[71]。还原环境和充足的海洋生物标志物可能是这一转换的关键因素。杭州湾外东海内陆架海域,水浅、营养盐充足,初级生产力高,大量有机物质较快沉降,并且处于东海季节性低氧区域[25,72]。沉积物的缺氧条件,既限制了可能发生的有机降解,加强了有机质的保存,又有利于缺氧还原环境中甾醇向甾烷醇转化的发生[57,62,73]。研究区域细小颗粒沉积物也有利于甾醇向甾烷醇转化的增强[52,62]。虽然菜籽甾醇和甲藻甾醇因分子结构相似,通常认为它们发生类似的氧化降解,且降解速率接近[30],但菜籽甾醇可能还发生了氢化还原作用,而甲藻甾醇由于分子结构中C4 位连接甲基,较菜籽甾醇有高的保存效率[29,61]。不同水层菜籽甾醇/甲藻甾醇的比值变化不大[44],可能由于水柱中含氧量较高不够还原条件。东海陆架沉积物中的微生物含量丰富,多样性高,但对邻近海域微生物生态研究主要集中在细菌和古菌多样性分析,部分针对反硝化微生物菌群结构和分布特征[24-25,74],目前还未见对甾醇还原加氢作用的报道。
Jeng 和Huh[29]在长江口附近陆架的研究提出,东海悬浮物质中较低的stanol 含量与海洋浮游生物来源一致,而陆架沉积物中较高的stanol/stenol 比值可能是由于沉积物-水界面stenols 相对于stanols 的选择性降解或stenols 的微生物加氢作用。还有研究显示,长江口外海域(31°~32°N、121°~124°E)表层沉积物中胆甾烷醇/胆甾醇(cholestanol/cholesterol)比值为0.15~0.90,比颗粒物中高10 倍[52]。长江口沉积物中C27—C29甾烷醇/甾醇比值为1.55~10.41[75]。我们的研究结果显示,表层沉积物中cholestanol/cholesterol 比值为0.37~0.80,颗粒物中为0.01~0.56(表4)。在长江口[75]、南海北部湾[76]、南海南沙海域大陆坡[77]、南海北部大陆架[78]的柱状沉积物中,都发现stanol/stenol 比值随着沉积深度的增加而增加。研究者解释样品中C27和C28甾烷醇/甾醇比值随沉积深度的增加,指示甾醇向甾烷醇的转化,反映区域沉积物中的有机质经历了强烈的细菌加氢还原作用。
因此,结合前人工作基础,我们推测研究区域内,在微生物活跃的缺氧沉积物中及沉积物-水界面,菜籽甾醇很可能经历后期的氢化作用转化为菜籽甾烷醇(图7)。即相对于甲藻甾醇,菜籽甾醇经历了额外的微生物加氢还原作用,从而导致沉积物与颗粒物中菜籽甾醇和甲藻甾醇的相对含量比值的巨大差异。但并不排除菜籽甾醇和甲藻甾醇可能存在的氧化降解差异,这里仍假设它们的降解速率类似。
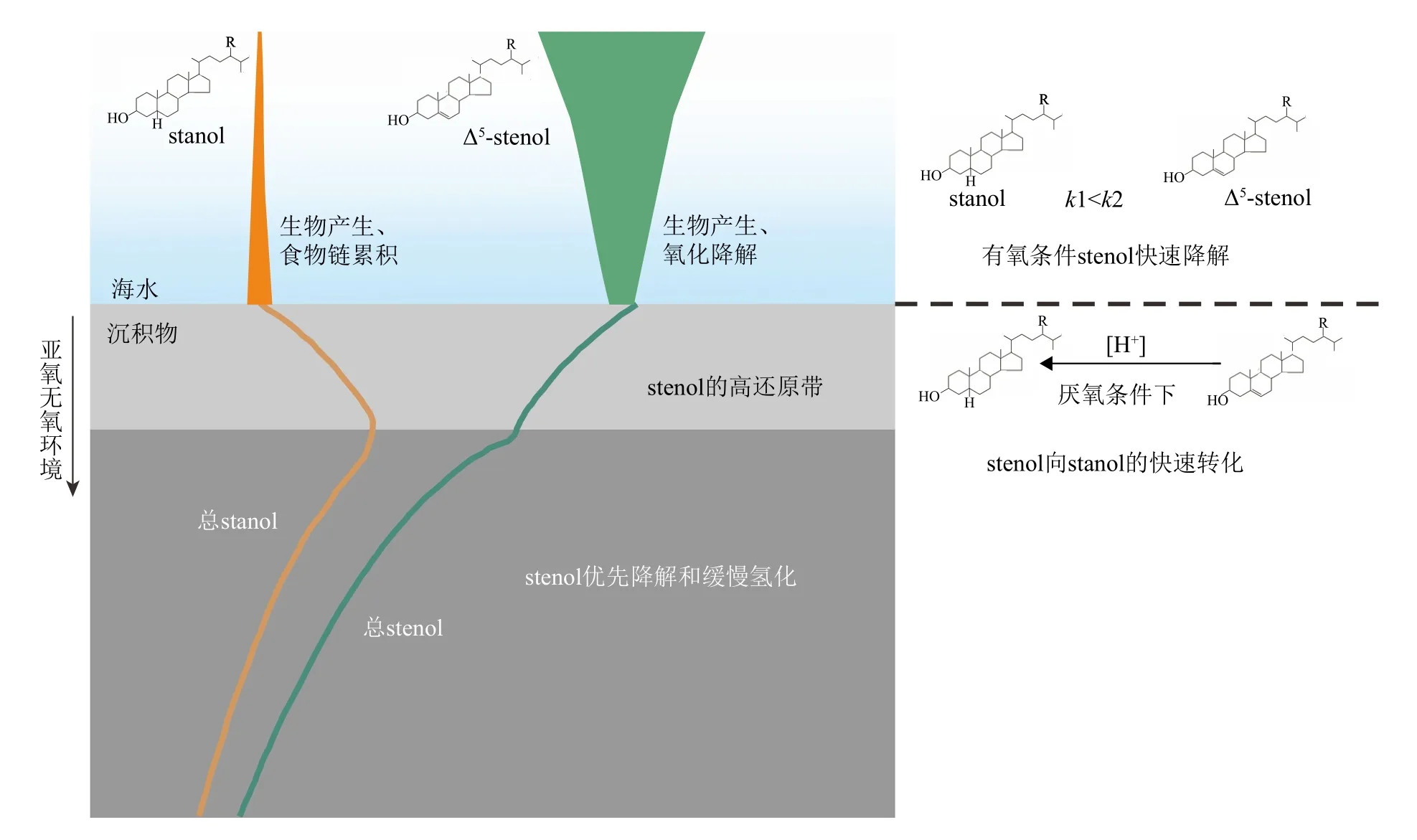
图7 海水和沉积物中甾醇及甾烷醇的变化示意图根据Nishimura 和Koyama[70]改绘。Fig.7 Diagrammatic representation of the changes of stenols and stanols in seawater and sediment Modified from Nishimura and Koyama [70].
5 结论与启示
(1)通过两年5 个航次对杭州湾外东海内陆架4 个断面的表层沉积物和颗粒物样品分析,结果显示菜籽甾醇和甲藻甾醇等藻类生标有明显的时空变化。表层沉积物中生物标志物空间分布特征明显,由近岸向海,随水深增加含量增加。颗粒物中的季节变化显著,夏季样品的含量更高。与前人研究一致,生物标志物的时空变化主要受控于藻类生产力的变化。
(2)表层沉积物和颗粒物中菜籽甾醇和甲藻甾醇的相对含量明显不同,表层沉积物中甲藻甾醇占优势,颗粒物中菜籽甾醇占优势。除了通常解释的表层沉积物和颗粒物中生物标志物包含的时空信息差异,由样品中甾烷醇/甾醇比的显著变化推测沉积物-水界面上发生了额外的改造作用。我们认为沉积物中菜籽甾醇发生后期氢化还原作用,部分转化为菜籽甾烷醇,从而导致沉积物中菜籽甾醇相对甲藻甾醇含量大幅降低。
(3)表层海洋藻类生标从产生输出直至保存到沉积物的过程十分复杂,如水柱中的横向运输和降解,不同粒径沉积物的保存等。目前的工作无法排除平流、再搬运等作用对沉积物中有机质的影响,也不能排除甾醇氧化降解差异。沉积物-水界面这一活跃的成岩带有丰富的微生物群落降解、转化有机物。有机质在表层(0~2.5 cm)发生较快的降解和转化,更深层的沉积物有机质组成基本上相对稳定(图7)。因此,对于应用藻类生标重建古环境,无论从代表的时空信息,还是考虑到生物标志物的稳定性,表层沉积物相较颗粒物的数据应该更具有参考意义。但表层沉积物中可能发生的这一甾醇的加氢还原转化需要受到重视,它不仅为表层沉积物中生物标志物相对含量和现代水体藻类丰度的差异提供有益见解,而且会影响对沉积记录里藻类生标生产力和群落结构变化的解读。这一推测还需要进一步的研究和更多的证据,如对不同水深颗粒物中甾烷醇/甾醇的变化的检测,生物标志物的单体氢同位素测试等。
致谢:本研究的样品采集得到国家自然科学基金委员会共享航次计划项目(41849903)的资助。该航次(航次编号:NORC2019-03,NORC2021-03)由“浙渔科2”号/“润江1”号科考船实施,在此一并致谢。
——以汝溪河为例

