Fe2(SiO3)3制 为合载成氧气体的的热甲力烷学化研学究链 部分氧化
方燕红,王正豪,王成瑞,段华美,张国权,李言栋
(1.重庆大学 材料科学与工程学院,重庆 400044;2.重庆大学 2M 研究室,重庆 400044;3.四川大学 化学工程学院,四川 成都 610065;4.长江师范学院 材料科学与工程学院,重庆 408100)
合成气是合成甲醇等高价值化学品及液体燃料的重要中间体。目前,一种新的技术——甲烷化学链部分氧化技术,在理论上展现出能耗低、环境友好以及气体产物品质高等优点。该技术主要通过载氧体在两个反应器之间的循环交替反复来传递晶格氧,从而获得高品质合成气。载氧体主要包括铁基载氧体[1-4]、镍基载氧体[5-8]、铜基载氧体[9-11]。其中,铁基载氧体具有储氧能力高、来源广泛、成本低、环境友好等优点,但随着循环次数的增加,纯铁基氧化物的磨损和团聚加剧,导致反应活性降低[12]。因此,越来越多的研究者对铁基复合材料进行了研究。Luo 等[13]制备了铁钛复合载氧体,在960 ℃时甲烷转化率接近100%;牛鹏杰[14]制备了CaO/Fe2O3复合载氧体,该载氧体在900 ℃时有较高的供氧效率且甲烷转化率可达90%;Qin 等[15]发现1%(w)铜掺杂Fe2O3复合载氧体可以提高低温时甲烷化学链部分氧化工艺过程中的反应活性,反应温度为700 ℃时,甲烷转化率可达90%。研究结果表明,铁基复合材料作为载氧体有巨大潜能。
本工作采用热力学软件Factsage8.1,对Fe2(SiO3)3作为载氧体用于甲烷化学链部分氧化过程进行了热力学计算,研究了Fe2(SiO3)3与甲烷摩尔比、反应温度及压力对载氧体反应活性的影响,以获得最佳工艺条件。
1 热力学模型的建立
载氧体的还原行为会显著影响合成气的质量及产率。载氧体应具有合适的氧化能力将甲烷部分氧化为合成气,同时防止甲烷完全氧化为CO2和H2O。而载氧体的还原性能很大程度上取决于活泼金属氧化物的热力学性能。采用Factsage8.1 软件中的Equilib 模块,建立了以Fe2(SiO3)3为载氧体的甲烷化学链部分氧化模型(见图1)。在还原反应器中,载氧体不与氧气直接接触,而是以载氧体中的晶格氧作为氧元素的来源,控制甲烷与载氧体的比例使反应生成以CO 和H2为主的高品质合成气;在氧化反应器中,被还原的载氧体在空气气氛下重新恢复晶格氧。
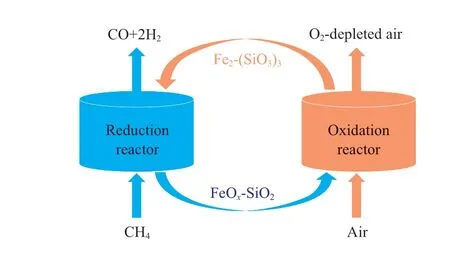
图1 甲烷化学链部分氧化模型Fig.1 Conceptual scheme of chemical looping partial oxidation of methane(CLPOM).
2 热力学分析与计算
吉布斯自由能最小化方法是求解热力学平衡态的常用方法之一,基本原理是:对于某一热化学反应体系,在恒温恒压下,反应向自由能减小的方向进行,当自由能达到极小值时,反应体系达到平衡状态[16]。Factsage 是目前较为广泛使用的热力学软件,可基于系统最小吉布斯自由能原理来计算多相体系中各成分的平衡组成。
以Fe2(SiO3)3为载氧体的甲烷化学链部分氧化制合成气过程中,当温度为900 ℃、压力为0.1 MPa 时,还原反应器中甲烷与Fe2(SiO3)3载氧体接触可能发生的反应见式(1)~(14)。

式中,ΔHϴ为反应过程中的焓变。
甲烷与Fe2(SiO3)3载氧体反应所生成的气体之间可能发生的反应见式(15)~(19)。
水煤气变换反应:

碳的气化反应:
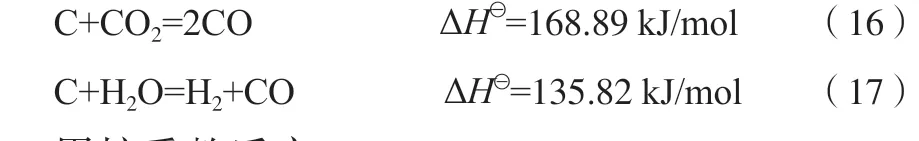
甲烷重整反应:
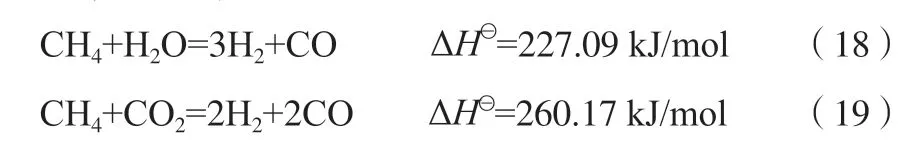
氧化反应器中可能发生的反应见式(20)~(23)。

从以上分析可知,甲烷化学链部分氧化过程是一个复杂的过程,涉及铁元素的多种价态以及水煤气变换、重整等反应,多个反应相互竞争,因此,最终是多个反应相互协同和综合作用的结果。根据热力学原理可知,当某一反应的吉布斯自由能小于0,平衡常数大于0,则该反应能自发进行;自由能越小或平衡常数越大,反应向正方向进行的可能性越大[17]。两个反应器中可能发生的反应的吉布斯自由能与平衡常数随温度的变化见图2。由图2可知,以上反应在一定温度条件下都可以满足吉布斯自由能小于零、平衡常数大于0,因此,理论上在热力学范围内均可自发进行。其中,随温度的升高,反应(15)、反应(20)~(23)的吉布斯自由能逐渐增大,平衡常数逐渐减小;其他反应的吉布斯自由能逐渐减小,平衡常数逐渐增大。这表明在反应过程中,反应(15)、反应(20)~(23)不易进行,反应活性较低;而其他反应容易进行,且反应活性较高。综合反应的吉布斯自由能及平衡常数随温度变化情况,可以得到Fe2(SiO3)3载氧体在还原反应器中是按照Fe2(SiO3)3→Fe2O3/SiO2→Fe3O4/SiO2→FeO/SiO2→Fe/SiO2的顺序逐级被还原的;在氧化反应器中,被还原的载氧体按Fe/SiO2→FeO/SiO2→Fe3O4/SiO2→Fe2O3/SiO2→Fe2(SiO3)3的顺序逐级恢复晶格氧。
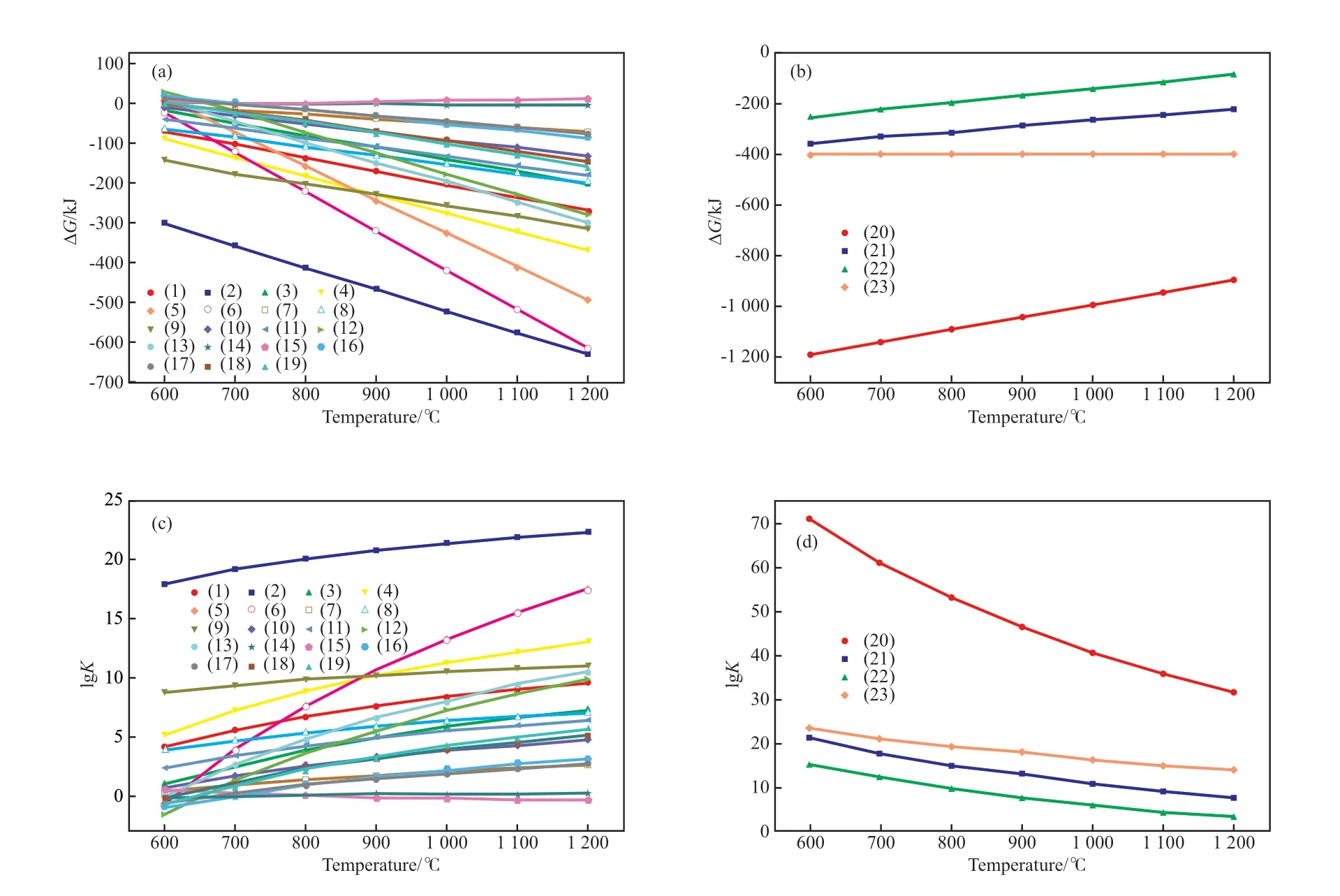
图2 还原反应器(a,c)与氧化反应器(b,d)中吉布斯自由能和平衡常数随温度的变化曲线Fig.2 Gibbs free energy(ΔG) and equilibrium constant(K) changes with temperature in reduction reactor(a,c) and oxidation reactor(b,d).
3 反应过程参数优化
对两个反应器中可能发生的化学反应进行热平衡分析后,进一步研究了反应条件对Fe2(SiO3)3载氧体活性的影响,从而获得优化后的反应条件。需要注意的是,采用热力学软件Factsage8.1只是在设定的理想条件下研究反应体系中化学反应发生的最大程度,没有考虑实际实验中有关动力学的因素,因此,计算获取的优化参数可以为实际研究提供理论参考,但不能完全代替实验研究[18-20]。在甲烷化学链部分氧化制取合成气的过程中,主要考虑还原反应器中Fe2(SiO3)3与甲烷摩尔比、温度、压力对反应的影响,并将甲烷转化率、CO 选择性、H2选择性、CO2选择性作为载氧体活性评价的主要指标,计算公式见式(24)~(27)。


式中,XCH4为甲烷转化率,%;SCO为CO 选择性,%;SH2为H2选择性,%;SCO2为CO2选择性,%;nCH4in为反应前甲烷的物质的量,mol;nCH4out为反应后甲烷的物质的量,mol;nCO为CO 生成量,mol;nH2为H2生成量,mol;nCO2为CO2生成量,mol。
3.1 Fe2(SiO3)3 与甲烷摩尔比的优化
Fe2(SiO3)3与甲烷摩尔比是影响甲烷化学链部分氧化制合成气的重要因素。若甲烷过量,即Fe2(SiO3)3载氧体提供的晶格氧不足,甲烷会发生裂解反应生成碳,碳会聚集在载氧体表面,导致载氧体反应活性下降;若载氧体过量,即Fe2(SiO3)3载氧体提供的晶格氧大于甲烷完全氧化所需的晶格氧时,会导致甲烷完全氧化生成CO2和H2O,不利于生成合成气。因此,为了获取以CO 与H2为主的高纯度合成气,需要严格控制Fe2(SiO3)3与甲烷的摩尔比。以Fe2(SiO3)3与甲烷摩尔比为研究对象,设定温度为900 ℃、压力为0.1 MPa,固定甲烷用量为1.00 mol,通过改变Fe2(SiO3)3与甲烷摩尔比来研究Fe2(SiO3)3载氧体在还原反应器中的反应情况,结果见图3。
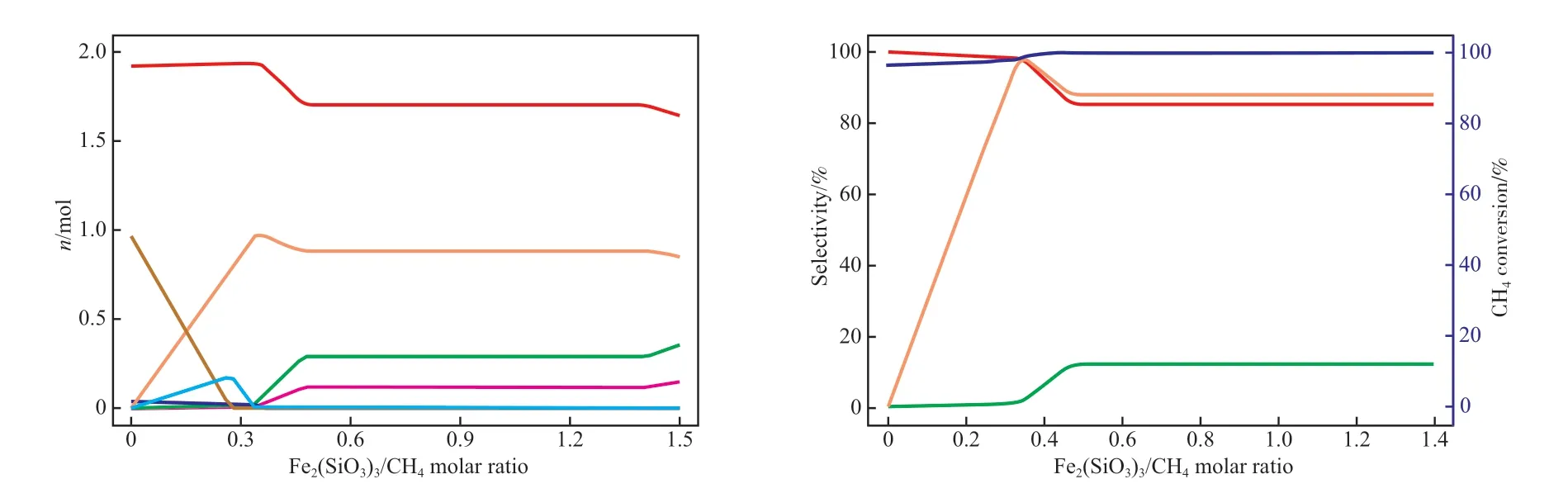
图3 Fe2(SiO3)3 与甲烷摩尔比对甲烷化学链部分氧化制合成气的影响Fig.3 Effect of Fe2(SiO3)3/CH4 molar ratio on syngas production from CLPOM.Reaction conditions:900 ℃,0.1 MPa,CH4 1.00 mol.
由图3 可知,甲烷与Fe2(SiO3)3载氧体反应可能会生成H2,CO,H2O,CO2,C,Fe3C 等。随着Fe2(SiO3)3与甲烷摩尔比的增加,H2与CO 的含量轻微下降后逐渐趋于稳定,当Fe2(SiO3)3与甲烷摩尔比为0.34 时,H2与CO 含量达到最大值,Fe2(SiO3)3与甲烷摩尔比为0.48~1.40 时,H2与CO 含量达到稳定状态。这是由于当Fe2(SiO3)3与甲烷摩尔比太小时,即载氧体提供的晶格氧不足,一部分甲烷先发生裂解反应生成了碳,一部分得到晶格氧生成了CO 和H2;由于碳会聚集在载氧体表面影响载氧体与甲烷的反应,导致反应活性下降,因此在反应过程中要尽量避免出现积碳现象。随着载氧体含量的增加,更多的晶格氧促使甲烷由部分氧化转为完全氧化,一部分甲烷被氧化成CO2和H2O,导致合成气纯度下降。当Fe2(SiO3)3与甲烷摩尔比为0.48~1.40 时,无碳和Fe3C 生成,甲烷理论上已完全转化,生成了较为稳定的合成气且合成气纯度较高。因此,综合考虑,该工艺还原阶段中的Fe2(SiO3)3与甲烷摩尔比优化值取0.34,此时在满足能稳定制取合成气的条件下,载氧体晶格氧利用率最高。通过式(24)~(27)可以计算得出:当Fe2(SiO3)3与甲烷摩尔比为0.34 时,甲烷转化率为98.0%,CO 选择性接近99.0%,H2选择性为98.0%左右,CO2选择性为1.0%。
3.2 反应温度的优化
反应温度是影响甲烷化学链部分氧化制合成气反应的另一个重要参数。在Fe2(SiO3)3与甲烷用量分别为0.34,1.00 mol,压力为0.1 MPa 的条件下,温度对甲烷化学链部分氧化制合成气的影响见图4。由图4 可知,随着温度的升高,H2与CO生成量先增大后趋于稳定,CO2和H2O 的生成量先小幅增加后减小,然后趋于稳定。由于还原反应器生成合成气的反应主要为吸热反应,基于化学平衡移动原理,高温有利于吸热反应的进行。因此,温度从700 ℃升至750 ℃时,CO 选择性急速增加,从30.0%增至80.0%左右;CO2选择性小幅增加,从3.0% 增至8.0% 左右。当温度从750 ℃升至1 200 ℃时,CO 和H2的选择性均增至99.0%左右;CO2选择性降至0.3%左右。综合考虑,该工艺还原阶段中的反应温度优化值取900 ℃,此时甲烷转化率、CO 选择性、H2选择性、CO2选择性分别达到98.0%,99.0%,98.0%,1.0%。
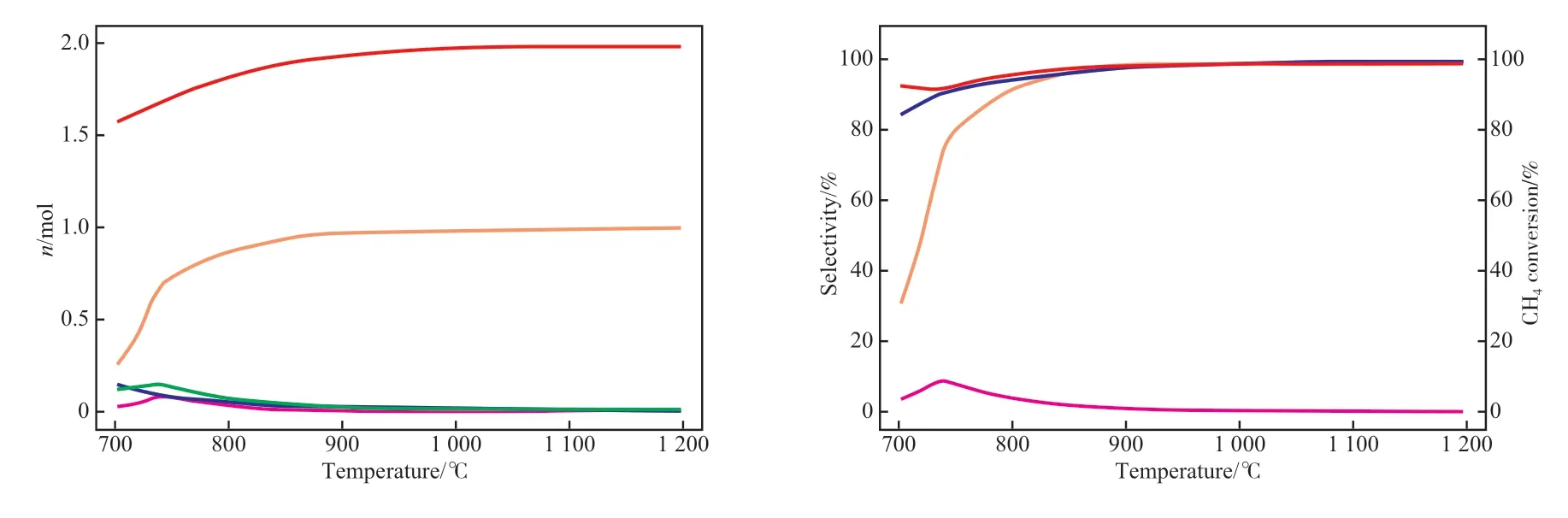
图4 温度对甲烷化学链部分氧化制合成气的影响Fig.4 Effect of temperature on syngas production from CLPOM.
3.3 反应压力的优化
还原反应器中温度为900 ℃,Fe2(SiO3)3与甲烷用量分别为0.34,1.00 mol 时,压力对甲烷化学链部分氧化制合成气的影响见图5。

图5 压力对甲烷化学链部分氧化制合成气的影响Fig.5 Effect of pressure on syngas production from CLPOM.
由图5 可知,随着压力的增加,CO2和H2O的生成量基本没有变化,CO 和H2的生成量呈现缓慢减小的趋势。由于甲烷与Fe2(SiO3)3反应生成合成气是气体体积增大的过程,根据化学反应平衡移动原理,压力增大有利于平衡向气体体积缩小的方向移动,因此,压力增大不利于合成气的生成及甲烷的转化。综合考虑,该工艺还原阶段中的压力优化值取0.1 MPa,此时甲烷转化率、CO 选择性、H2选择性、CO2选择性分别达98.0%,99.0%,98.0%,1.0%。
4 结论
1)采用Factsage8.1 热力学软件对以Fe2(SiO3)3为载氧体的甲烷化学链部分氧化制合成气过程进行了热力学计算与分析,并确定了该过程的优化参数。
2)Fe2(SiO3)3作为载氧体用于甲烷化学链部分氧化制合成气过程是可行的。在还原反应器中,载氧体是按照Fe2(SiO3)3→Fe2O3/SiO2→Fe3O4/SiO2→FeO/SiO2→Fe/SiO2的顺序逐级被还原的;在氧化反应器中,被还原的载氧体按Fe/SiO2→FeO/SiO2→Fe3O4/SiO2→Fe2O3/SiO2→Fe2(SiO3)3的顺序逐级恢复晶格氧。
3)还原反应器中,以甲烷转化率、CO 选择性、H2选择性、CO2选择性为主要评价指标,优化后的反应条件为:Fe2(SiO3)3与甲烷摩尔比为0.34,反应温度为900 ℃,压力为0.1 MPa;此时,甲烷转化率、CO 选择性、H2选择性、CO2选择性分别达98.0%,99.0%,98.0%,1.0%。

