复方苦参注射液联合替吉奥、奥沙利铂方案治疗进展期胃癌效果及对免疫功能的影响
薛天朗,史高锋,冯秀岭,宗洪飞
郑州市第六人民医院 河南郑州 450000
胃癌一般起源于胃粘膜细胞,早期无明显临床表现,少部分患者可出现消化不良等轻微不适,当患者出现如上腹痛、厌食、体重下降等明显临床症状入院就诊时,多数已发展为进展期胃癌,据统计,在我国胃癌发病率居于各类肿瘤首位,其5年生存率尚不足50%[1]。手术是早期胃癌患者唯一根治方法,然而部分患者因疾病进展、癌灶转移或无法耐受手术,需采取姑息性化疗方法,以延长患者生存期限[2]。替吉奥、奥沙利铂化疗方案(SOX方案)是进展期胃癌常用化疗方案,可明显改善患者生存预后,然而化疗除对癌症细胞有杀伤作用外,对正常细胞也有一定影响,极易出现各种化疗毒副反应,降低患者化疗耐受性[3]。有研究表明,中成药可降低化疗药物对全身各组织器官系统造成的不良后果,同时增强机体免疫功能,以提高对化疗药物的耐受性,达到延长患者化疗周期的目的,从而改善预后。复方苦参注射液是一种配伍化疗药物,其成分苦参碱对肿瘤细胞有抑制作用,还可以增强机体免疫力,改善癌痛,增强化疗耐受性[4]。基于此,本研究旨在探究复方苦参注射液联合SOX方案治疗进展期胃癌效果及对免疫功能的影响,报道如下:
资料与方法
1 入组标准
1.1 诊断标准 经电子计算机断层扫描技术、胃镜下活组织检查等确诊,处于进展期胃癌者[5]。
1.2 纳入标准 ①年龄≥18岁,且预计生存期≥3个月;②均为初次抗肿瘤治疗;骨髓造血功能正常:中性粒细胞计数≥1.5×109/L,血小板计数≥75×109/L,血红蛋白≥90g/L;③肿瘤卡氏评分≥80分;④美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~1分;⑤均对本次研究知情同意。
1.3 排除标准 ①严重精神及认知障碍,无法进行沟通;②严重脏器功能障碍;③严重血液系统感染,或合并自身免疫性疾病;④对本次研究所用药物有使用 禁忌。
2 一般资料
选择选取2019年1月~2020年1月本院普外科收治的98例进展期胃癌患者作为研究对象。患者按入院顺序依次进行编号,按照单双号法分为2组,单号为SOX组,双号为苦参组,各49例。SOX组男33例,女16例;年龄42~65岁,平均年龄(53.47±8.62)岁;分化程度:高分化腺癌15例,中分化腺癌14例,低分化腺癌20例;苦参组男29例,女20例;年龄42~67岁,平均年龄(54.81±8.93)岁;分化程度:高分化腺癌13例,中分化腺癌14例,低分化腺癌22例;2组患者基线资料未发现显著差异(P>0.05)
3 治疗方法
3.1 SOX组 给予替吉奥(爱斯万,Taiho Pharmaceutical Co.,Ltd. Tokushima Plant,批准文号 H20130811,规格 20mg×28粒)、奥沙利铂(艾恒,江苏恒瑞医药股份有限公司,国药准字 HH20000337,规格 50mg)化疗方案(SOX方案),具体方法为:第一天给予注射用奥沙利铂130mg/m2+10%葡萄糖注射液500ml,静脉滴注3h,隔21d治疗1次,21d为一个疗程,用药至疾病进展或出现不可接受的毒性反应;同时当天给予替吉奥胶囊,口服,根据体表面积确定给药剂量:体表面积<1.25m2,剂量为40mg/(m2·d),体表面积>1.5m2,剂量为60mg/(m2·d),体表面积在两者之间,剂量为50mg/(m2·d),2次/d,连续用药14d,停药7d,21d为一个疗程,用药至患者病情恶化或无法耐受,治疗前可给予盐酸甲氧氯普胺注射液[上海禾丰制药有限公司,国药准字 H31021522,规格 (1mL:10mg)×10支]20mg 肌肉注射,预防胃肠道反应。
3.2 苦参组 给予SOX组方案+复方苦参注射液(岩舒,山西振东制药股份有限公司,国药准字 Z14021231,规格 5mL/支),具体用法为:复方苦参注射液 20mL+0.9%氯化钠注射液250mL稀释,静脉滴注,1次/d,每个化疗周期同步用药,21d为一个疗程。
2组患者均在治疗4个周期后观察治疗效果,均随访至2年后。
4 观察指标
4.1 临床疗效 采用实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumor 1.1,version 1.1,RECIST1.1)评 价[6],分 为 完 全 缓 解(complete response,CR):肿瘤完全消失、持续时间≥4w,部分缓解(partial response,PR):肿瘤缩小体积>50%、持续4w以上,稳定(stable disease,SD):肿瘤缩小50%以下或增大不足20%,和疾病进展(progressive disease,PD):肿瘤增大20%以上或出现新病灶,总有效率为CR与PR之和占总例数的百分比,疾病控制率为除PD以外的部分占总例数的百分比。
4.2 肿瘤标志物 于治疗前、治疗4个周期后采集6ml患者清晨肘静脉血,经离心处理后,采用酶联接免疫吸附剂测定血清癌胚抗原(Carcinoembryonic antigen,CEA)、神经元特异性烯醇化酶(Neuron-Specific Enolase,NSE)、胃癌抗原(carbohydrate antigen 72-4,CA72-4)水平。
4.3 自然杀伤细胞(natural killer cell,NK)与T淋巴细胞亚群 采用流式细胞术检测NK细胞比例、分化 簇3+(cluster of differentiation 3+,CD3+)、CD4+、CD8+、CD4+/CD8+水平。
4.4 血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF) 采用ELISA法检测血清VEGF-C、VEGF-D水平。
4.5 化疗毒副反应 根据世界卫生组织(World Health Organization,WHO)抗癌药物常见毒副反应分级标准[7],将化疗毒副反应分为I-IV度,主要观察:白细胞下降、贫血乏力、恶心呕吐、肝功能损害等,其中Ⅰ级表示轻微不良反应、Ⅱ级即中度,Ⅲ、Ⅳ度为严重毒副反应。
4.6 随访情况 采用电话随访形式进行随访,随访2年,比较2组患者总生存期(Overall survival,OS)、无疾病进展生存期(Progression-free survival,PFS)和2年总生存率。
5 统计学方法
结 果
1 2组患者临床疗效比较
化疗4个周期后,苦参组治疗总有效率及疾病控制率稍高于SOX组,但比较差异无统计学意义(P>0.05),见表1。
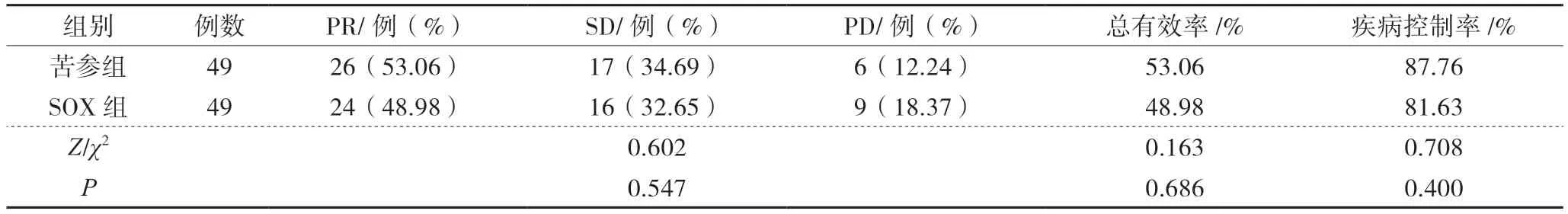
表1 2组患者临床疗效比较
2 2组患者化疗前后肿瘤标志物比较
化疗4个周期后,2组患者CEA、NSE及CA72-4水平均明显下降(P<0.05),且苦参组明显低于SOX组(P<0.05),见表2。
表2 2组患者化疗前后肿瘤标志物比较(±s)
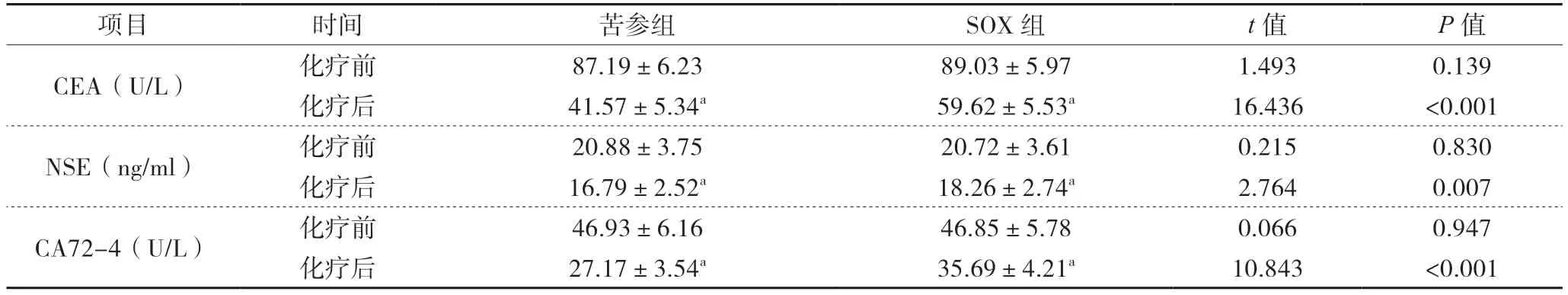
表2 2组患者化疗前后肿瘤标志物比较(±s)
注:与化疗前比较,aP<0.05
项目 时间 苦参组 SOX组 t值 P值CEA(U/L) 化疗前 87.19±6.23 89.03±5.97 1.493 0.139化疗后 41.57±5.34a 59.62±5.53a 16.436 <0.001 NSE(ng/ml) 化疗前 20.88±3.75 20.72±3.61 0.215 0.830化疗后 16.79±2.52a 18.26±2.74a 2.764 0.007 CA72-4(U/L) 化疗前 46.93±6.16 46.85±5.78 0.066 0.947化疗后 27.17±3.54a 35.69±4.21a 10.843 <0.001
3 2组患者化疗前后免疫功能指标比较
化 疗4个 周 期 后,2组NK细 胞 比 例、CD3+、CD4+、CD8+、CD4+/CD8+均明显降低(P<0.05),但苦参组化疗后指标明显高于SOX组(均P<0.05),见表3。
表3 2组患者NK细胞与T淋巴细胞亚群比较(±s )
注:与化疗前比较,aP<0.05
项目 时间 苦参组 SOX组 t值 P值NK细胞(%) 化疗前 17.51±3.24 17.59±3.26 0.122 0.903化疗后 14.89±3.16a 11.56±2.28a 5.982 <0.001 CD3+(%) 化疗前 56.82±7.16 56.93±7.25 0.076 0.940化疗后 53.99±6.72a 48.04±6.58a 4.692 <0.001 CD4+(%) 化疗前 52.37±7.43 52.18±7.06 0.130 0.897化疗后 48.82±5.37a 44.39±5.11a 4.183 <0.001 CD8+(%) 化疗前 26.12±4.93 26.20±4.62 0.829 0.934化疗后 24.23±3.12a 20.01±3.04a 6.781 <0.001 CD4+/CD8+ 化疗前 1.46±0.20 1.49±0.22 0.706 0.482化疗后 1.39±0.13a 1.20±0.08a 8.713 <0.001
4 2组患者化疗前后血管内皮生长因子比较
治疗4个周期后,2组患者血清VEGF-C水平明显降低(P<0.05),VEGF-D水平明显上升(P<0.05),且苦参组上述数据较SOX组差异明显,有统计学意义(P<0.05),见表4。
表4 2组患者血管内皮生长因子比较(±s)
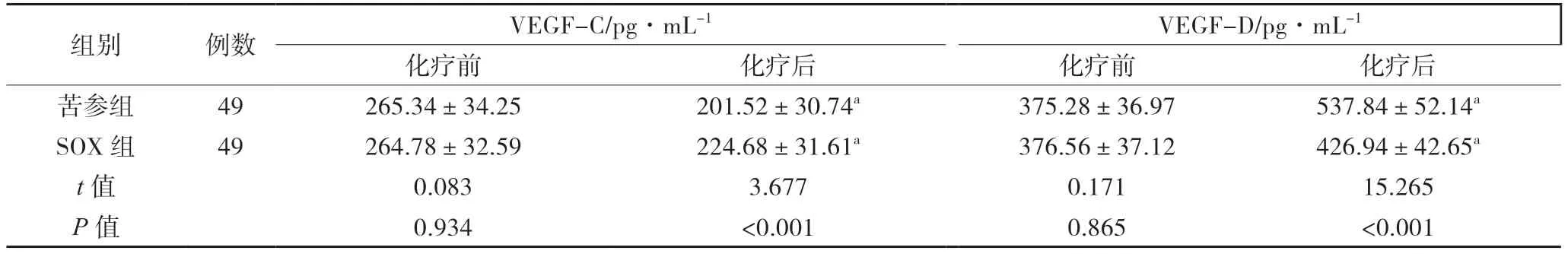
表4 2组患者血管内皮生长因子比较(±s)
注:与化疗前比较,aP<0.05
组别 例数 VEGF-C/pg·mL-1 VEGF-D/pg·mL-1化疗前 化疗后 化疗前 化疗后苦参组 49 265.34±34.25 201.52±30.74a 375.28±36.97 537.84±52.14a SOX组 49 264.78±32.59 224.68±31.61a 376.56±37.12 426.94±42.65a t值 0.083 3.677 0.171 15.265 P值 0.934 <0.001 0.865 <0.001
5 2组患者毒副反应比较
治疗期间,苦参组贫血乏力、脱发现象、白细胞下降毒副反应程度较SOX组轻(P<0.05),2组患者恶心呕吐、周围神经毒性、肝功能损害不良反应比较差异无统计学(P>0.05),见表5。
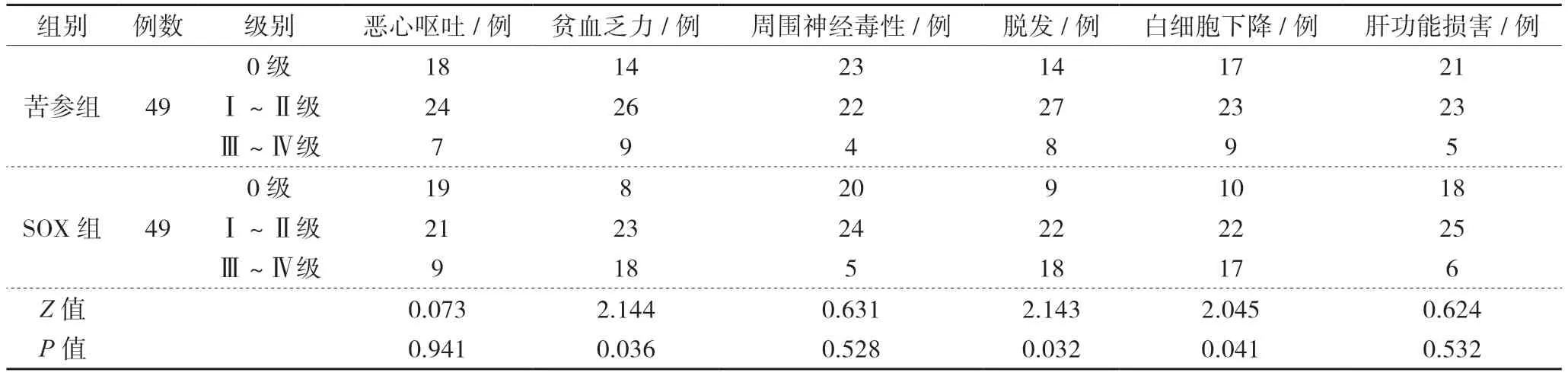
表5 2组患者治疗期间药物毒副反应比较
6 2组患者随访情况比较
随访截止2022年1月,苦参组OS以及PFS均明显高于SOX组(P<0.05),苦参组2年生存率高于SOX组,但差异比较无统计学意义(P>0.05),见表6。

表6 2组患者随访情况比较
讨 论
SOX方案是进展期胃癌常用化疗方案,由替吉奥、奥沙利铂组成,其中奥沙利铂可结合脱氧核糖核酸(Deoxyribonucleic acid,DNA)链上G共价键,对DNA合成复制起到抑制作用,产生细胞毒性,从而起到杀灭活跃肿瘤细胞的作用[8]。替吉奥作为临床上广泛应用的一种五氟尿嘧啶类改良制剂,具有增效减毒作用,由吉美嘧啶、替加氟、奥替拉西钾按照一定比例组成,其中吉美嘧啶可抑制体内5氟尿嘧啶(5-fluorouracil,5-FU)降解,从而增强替加氟抗癌作用,奥替拉西钾通过抑制5-FU磷酸化,从而抑制替加氟的毒副作用,提高患者耐受性,两者联用有协同增强作用[9]。本次研究显示,化疗4个周期后,2组实体瘤均明显改善,疾病均得以有效控制,表明SOX化疗方案的有效性。然而苦参组近期治疗总有效率及2年生存率均略高于SOX组,OS、PFS显著优于SOX组,这表示加用复方苦参注射液可明显改善进展期胃癌患者远期预后。分析可知,复方苦参注射液中的苦参具有清热利湿、抗菌消炎、健脾等功效;现代药理研究表明,苦参碱作为苦参中的有效成分,可通过线粒体促凋亡蛋白表达的上调,X-连锁凋亡抑制蛋白表达的下调,促进半胱氨酸天冬氨酸蛋白酶3高表达,对肿瘤细胞增殖起到抑制作用,从而促进肿瘤细胞凋亡;此外,苦参碱的应用可增强患者化疗耐受性,增加治疗周期,故而苦参组效果更佳[10]。
肿瘤标志物(Tumor marker,TM)是由肿瘤细胞基因表达产生,其对于肿瘤筛查、辅助诊断、病情监测具有重要价值。CEA是TM常用指标,可在多种肿瘤中表达,特异性低,CA72-4是胃肠道肿瘤和卵巢癌的标志物,对诊断胃癌的特异性优于癌胚抗原[11],NSE为烯醇酶的异构体,在肿瘤中存在表达过量的现象[12]。本次研究显示,2组患者治疗后CEA、NSE及CA72-4水平均明显下降,且苦参组明显低于SOX组,这表示复方苦参注射液联合SOX方案治疗进展期胃癌疗效显著,原因可能是,肿瘤细胞需要穿过基底膜才能向其邻近组织转移,复方苦参注射液可抑制癌细胞产生的蛋白水解酶活性,降低癌细胞对基底膜的侵袭,从而阻止肿瘤细胞转移[13]。
NK细胞和T淋巴细胞亚群在处于免疫抑制的恶性肿瘤患者中起到重要作用,T淋巴细胞亚群是观察机体细胞免疫水平的重要方法,NK细胞介导天然免疫应答,可作为判断机体抗肿瘤的指标之一,是机体防御肿瘤的天然屏障[14]。本次研究显示,化疗4个周期后,2组NK细胞比例、CD3+、CD4+、CD8+、CD4+/CD8+均明显降低,但苦参组化疗后指标明显高于SOX组,这表示复方苦参注射液联合SOX方案治疗进展期胃癌可明显改善患者免疫功能。文献报道,SOX方案在杀灭肿瘤细胞的同时,也会损害正常细胞,导致机体NK细胞比例、CD3+、CD4+、CD8+、CD4+/CD8+水平下降,从而造成免疫失衡;然而,复方苦参注射液中的有效成分可通过细胞膜,提高机体T淋巴细胞及NK细胞活性,以改善免疫功能[15],故而苦参组免疫功能得以改善。
卢玖菊等[16]研究表明,肿瘤细胞增殖、分化与微血管异常增生关联密切,VEGF可促进内皮细胞增生,诱导肿瘤新的血管形成,同时提高血管通透性。本次研究显示,2组患者治疗后血清VEGF-C水平明显降低,VEGF-D水平明显上升,且苦参组上述数据较SOX组差异明显,这表示复方苦参注射液联合SOX方案治疗进展期胃癌可明显减少表皮生长因子受体生长,可能是复方苦参注射液通过抑制基质金属蛋白酶2(Matrix metalloproteinase 2,MMP-2)以及MMP-9活性,阻断内皮细胞和肿瘤细胞粘附,从而减少表皮生长因子受体生长,抑制肿瘤细胞转移和病变发展,延长患者生存期[17]。
进展期胃癌患者化疗期间,化疗药物作用于全身细胞并对其造成损伤,从而引发诸多危害性反应,此外,肿癌患者多体质虚弱,受化疗毒性反应影响,会导致细胞因子出现紊乱,引起药物不耐受现象[18]。本次研究显示,治疗期间,苦参组贫血乏力、脱发现象、白细胞下降毒副反应程度较SOX组轻,这表示复方苦参注射液联合SOX方案治疗进展期胃癌可在一定程度上减少化疗毒副反应的发生,提升患者化疗耐受性,分析主要是复方苦参注射液具有减毒作用,可减轻化疗药物对于机体正常细胞的损害,同时提高机体免疫力,减少化疗不良反应的发生[19]。
综上所述,复方苦参注射液联合SOX方案治疗进展期胃癌可明显提高机体免疫力,降低化疗毒副反应,延长患者生存时间,提高患者治疗效果,具有临床应用价值。

