心率变异性与扩大的血管周围间隙脑部分布关系研究
周东杨,陈静,路畅,白宏英
随着老龄化进程的加剧及磁共振成像(MRI)技术的发展,扩大的血管周围间隙(EPVS)被更多地观测到[1]。血管周围间隙是围绕穿透小动脉和小静脉的充满间质液的空腔,是脑内间质液和溶质的重要引流管道,当其因各种生理、病理原因扩大即形成EPVS[2]。在最近的研究中,EPVS被认为是脑小血管病(CSVD)的一种早期影像学表现[3],其常出现在基底节区及半卵圆中心,在海马和中脑也可观测到[4]。研究发现,EPVS与认知功能障碍[5-6]、情感障碍[7-8]、脑卒中[9]及卒中后不良结局[10]等密切相关,但EPVS的危险因素及起源尚未完全明确。
最近的研究发现心率变异性(HRV)与脑血管事件的发生风险及其预后相关[11-12],HRV是一种无创的监测指标,已成为一个重要和公认的自主神经功能评估工具。近年来有研究探讨HRV与CSVD标志物中腔隙、脑白质高信号(WMH)等的关系[13-14],然而作为CSVD主要标志物之一的EPVS与HRV的关系尚不清楚。先前的研究表明,基底节区EPVS(BG-EPVS)与CSVD其他影像学特征(如WMH、腔隙等)密切相关,并被认为是血压相关性动脉疾病的标志[15-16],而半卵圆中心EPVS(CS-EPVS)在脑淀粉样病患者中检出率更高,且与脑叶微出血及铁沉积有关[16-18],提示BGEPVS及CS-EPVS可能具有不同的起源。因自主神经功能紊乱可引起血压及血流动力学等一系列变化[19],所以本研究假设相较于CS-EPVS,自主神经功能紊乱与BG-EPVS的相关性更强,且在BG-EPVS负荷大于CSEPVS负荷的优势模型中起作用[16,20],并对该假设进行检验,以期进一步揭示不同脑区EPVS的发病机制并为其防治提供依据。
1 对象与方法
1.1 研究对象 回顾性选取2020年1月至2022年5月在郑州大学第二附属医院神经内科住院治疗并完成24 h动态心电图监测和颅脑MRI的患者199例为研究对象,其中男105例(52.8%)、女94例(47.2%),平均年龄(63.2±11.6)岁。纳入标准:(1)年龄≥35岁;(2)接受3.0-T颅脑MRI检查;(3)完善颅内外血管检查(如颈部血管超声或经颅多普勒超声等)。排除标准:(1)EPVS评估困难;(2)血管检查提示颅内、外大血管狭窄>50%;(3)颅脑MRI提示存在既往或急性期脑血管病(如缺血性脑梗死且梗死灶直径>20 mm、脑出血或蛛网膜下腔出血);(4)已患有诊断明确的神经系统变性疾病,如帕金森病、多系统萎缩等;(5)入院时安装心脏起搏器和/或合并严重的基础心脏病,如心肌病、心力衰竭、心肌梗死、心律失常等可能影响HRV的疾病;(6)存在体温异常、感染等;(7)进行HRV监测前服用过如β受体阻滞剂、钙离子拮抗剂、他汀类药物、阿托品等可能影响自主神经功能的药物。本研究已获得郑州大学第二附属医院伦理委员会批准(2022193),研究对象或其授权人均签署知情同意书。
1.2 方法
1.2.1 一般资料 本研究为临床回顾性分析,采集患者的基线资料,包括性别、年龄、吸烟史(曾经吸烟且戒烟<3个月或目前吸烟>1支/d)、饮酒史(平均酒精摄入量>25 g/d,持续时间>1年或戒酒<3个月),询问其高血压、糖尿病等基础疾病史。收集实验室检查指标,包括总胆固醇、三酰甘油、高密度脂蛋白、低密度脂蛋白、小而密低密度脂蛋白、同型半胱氨酸。
1.2.2 HRV指标分析 研究对象均使用迪姆软件(DMS300-4A)12导联动态心电记录仪行长程HRV(>18 h)监测,收集HRV数据,并由1名心电图专科医师(对患者MRI数据及临床资料不知情)对数据进行审核。监测期间患者避免如吸烟、饮酒、情绪剧烈起伏等可能干扰HRV的活动。HRV指标包括(1)频域:低频功率(LF)、高频功率(HF)、总功率(TP)及LF与HF的比值(LF/HF);(2)时域:各正常间隔的标准差(SDNN)、目标区间内每5 min 正常间隔均值的SD(SDANN)、目标区间内每5 min 正常间隔SD的平均值(SDNNindex)、目标区间内NN间隔连续差的均方根(rMSSD)、>50 ms的相邻NN间隔的百分比(PNN50)。
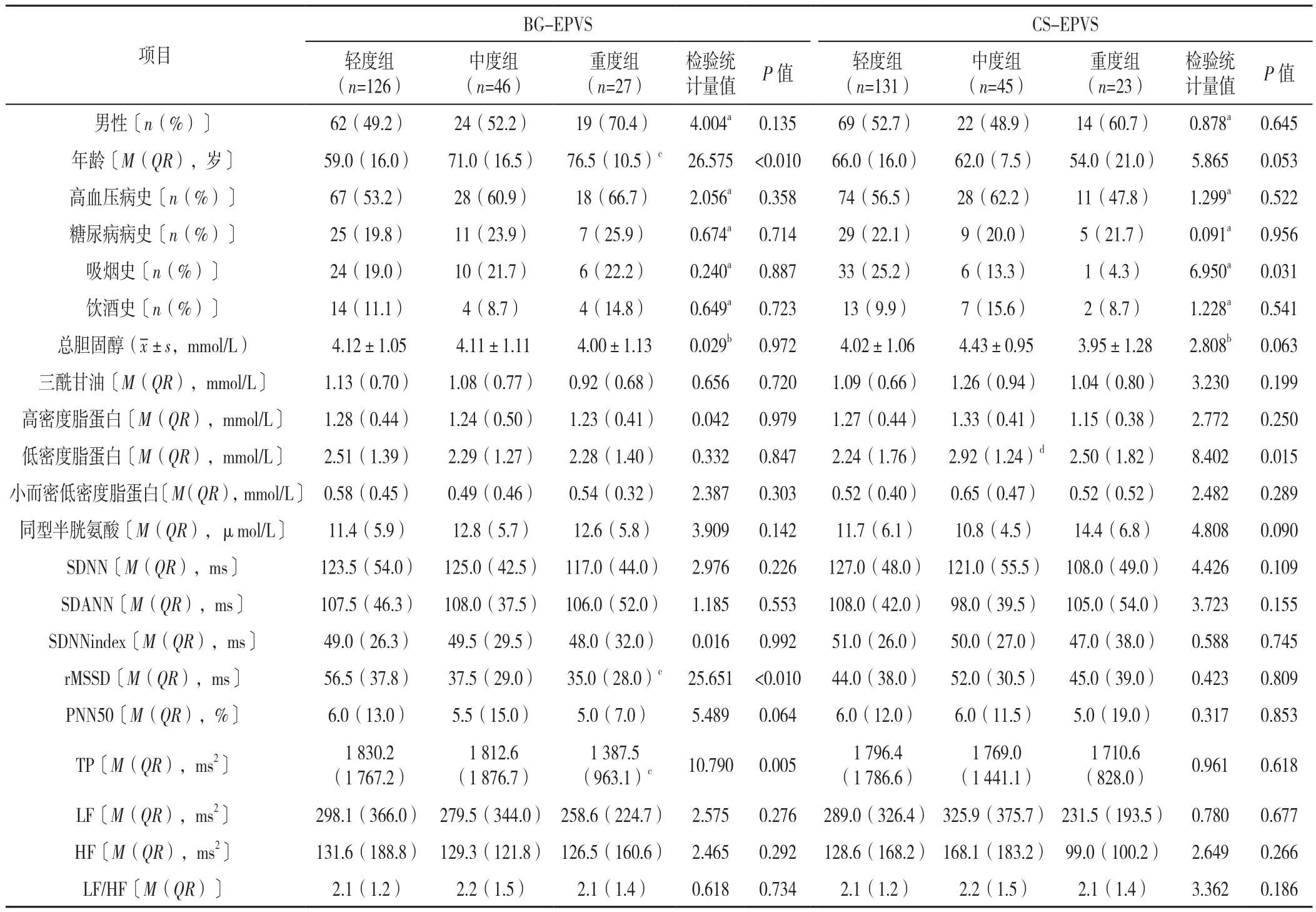
1.2.3 脑部影像学评价及分组 根据广泛接受的标准,在一台3.0-T MRI扫描仪(德国西门子Skyra)上进行颅脑MRI的扫描,脑部不同区域EPVS的严重程度由2名影像科医师分别进行评估,当出现分歧时讨论后取得共识。(1)EPVS的识别:EPVS主要由轴位T1加权成像、T2加权成像、液体衰减反转恢复(FLAIR)等序列进行识别,其具体表现为与血管走形相一致,形状呈线样、圆形或卵圆形;与脑脊液信号相一致,T2加权成像呈高信号且FLAIR序列成像无高信号影环绕,T1加权成像及FLAIR序列呈低信号影,无对比剂增强与占位效应,边界清晰且光滑,直径<3 mm。(2)EPVS的量化:采用经过验证的Potter视觉半定量评估法[9],分别对两个大脑半球进行评分,然后使用得分较高的半球对BG-EPVS和CS-EPVS进行评估,EPVS评分标准为1~10个计1分、11~20个计2分、21~40个计3分、>40个计4分。
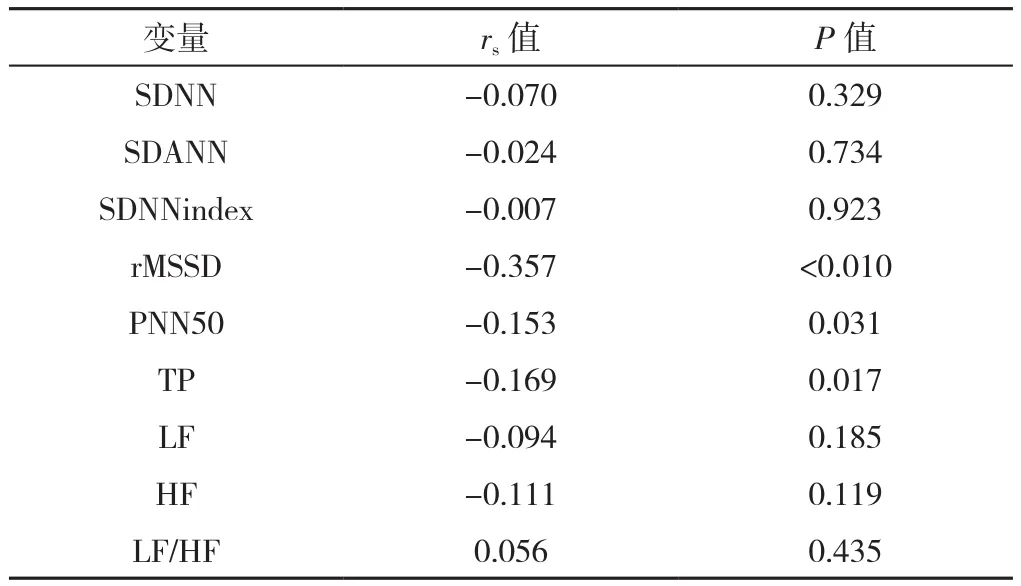
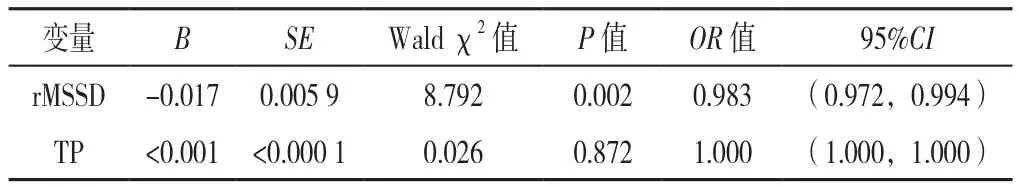
根据EPVS分数(Potter评分)将BG-EPVS分为3组:轻度BG-EPVS组126例(1分)、中度BG-EPVS组46例(2分)、重度BG-EPVS组27例(3~4分);将CS-EPVS分为3组:轻度CS-EPVS组131例(1分)、中度CS-EPVS组45例(2分),重度CS-EPVS组23例(3~4分)。根据BG-EPVS与CS-EPVS数量划分优势模型[16,20],模型1(BG>CS,119例)、模型2(BG=CS,20例)、模型3(BG 1.3 统计学方法 使用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料以(±s)表示,组间比较采用单因素ANOVA分析,组间两两比较采用SNK-q检验;不符合正态分布的以M(QR)表示,组间比较采用Kruskal-Wallis H检验;计数资料以相对数表示,组间比较采用χ2检验。采用Spearman秩相关分析探讨HRV指标与EPVS的相关性。将单因素分析中有统计学意义的HRV指标纳入多因素Logistic回归分析探讨EPVS严重程度及优势模型的独立影响因素。以P<0.05(三组间两两比较P<0.016 7)为差异有统计学意义。 2.1 EPVS严重程度的一般资料、HRV指标比较 轻、中、重度BG-EPVS组患者年龄、rMSSD、TP比较,差异有统计学意义(P<0.05);其中重度BG-EPVS组年龄高于轻度BG-EPVS组,rMSSD、TP低于轻度BGEPVS组,差异有统计学意义(P<0.016 7)。轻、中、重度BG-EPVS组患者性别、高血压病史、糖尿病病史、吸烟史、饮酒史、总胆固醇、三酰甘油、高密度脂蛋白、低密度脂蛋白、小而密低密度脂蛋白、同型半胱氨酸、SDNN、SDANN、SDNNindex、PNN50、LF、HF 及LF/HF比较,差异均无统计学意义(P>0.05),见表1。 表1 不同EPVS严重程度分组患者一般资料、HRV指标比较Table 1 Comparison of demographics,EPVS severity score and HRV indexes between groups of patients divided by sum of EPVS in basal ganglia region and in centrum semiovale region 轻、中、重度CS-EPVS组患者吸烟史、低密度脂蛋白比较,差异有统计学差异(P<0.05);其中中度CS-EPVS组低密度脂蛋白高于轻度CS-EPVS组(P<0.016 7)。轻、中、重度CS-EPVS组患者其余各指标比较,差异均无统计学意义(P>0.05),见表1。 2.2 HRV与EPVS的关系 HRV指标与BG-EPVS严重程度的Spearman秩相关分析显示,rMSSD、PNN50及TP与BG-EPVS严重程度呈负相关(P<0.05),见表2。 表2 HRV指标与BG-EPVS严重程度的Spearman秩相关分析Table 2 Spearman correlation analysis between HRV indexes and BGEPVS severity score 以BG-EPVS严重程度(赋值:轻度BG-EPVS=1,中度BG-EPVS=2,重度BG-EPVS=3)为因变量,以表1中差异有统计学意义的HRV指标rMSSD(赋值:实测值)、TP(赋值:实测值)为自变量进行多因素Logistic回归分析,以轻度BG-EPVS为参照,校正年龄、性别、高血压病史、糖尿病病史、吸烟史、饮酒史等可影响HRV和/或BG-EPVS的混杂因素后结果显示,rMSSD是BG-EPVS严重程度的独立影响因素〔OR=0.983,95%CI(0.972,0.994),P=0.002〕, 见表3。 表3 HRV指标与BG-EPVS严重程度的多因素Logistic回归分析Table 3 Multivariate Logistic regression analysis of HRV indexes andBG-EPVS severity score 2.3 EPVS优势模型间一般资料、HRV指标、EPVS严重程度比较 三组EPVS优势模型间SDNNindex、rMSSD、LF/HF、BG-EPVS严重程度、CS-EPVS严重程度比较,差异有统计学意义(P<0.05),其中模型2(BG=CS)、模型3(BG 表4 EPVS优势模型一般资料、HRV指标、EPVS严重程度的比较Table 4 Comparison of demographics,HRV indexes and EPVS severity score across EPVS advantage models 2.4 HRV与EPVS优势模型的关系 HRV指标与EPVS优势模型的Spearman秩相关分析显示,SDNNindex、rMSSD与EPVS优势模型呈正相关(P<0.05),见表5。 表5 HRV指标与EPVS优势模型Spearman秩相关分析Table 5 Spearman correlation analysis between HRV indexes and the EPVS advantage model 以EPVS优势模型(赋值:模型1=1,模型2=2,模型3=3)为因变量,以表4中差异有统计学意义的HRV指标SDNNindex(赋值:实测值)、rMSSD(赋值:实测值)和LF/HF(赋值:实测值)为自变量进行多因素Logistic回归分析,以模型1为参照,校正年龄、性别、高血压病史、糖尿病病史、吸烟史、饮酒史等混杂因素后结果显示,rMSSD是EPVS优势模型的独立影响因素〔OR=1.017,95%CI(1.006,1.028),P=0.003〕, 见表6。 表6 HRV指标与EPVS优势模型的多因素Logistic回归分析Table 6 Multivariate Logistic regression analysis of HRV indexes and theEPVS advantage model EPVS是CSVD的早期影像学标志物之一,被认为可能是脑老化的一种标志[3,21]。目前其相关的潜在机制在很大程度上是未知的,近期一些研究者逐渐开始关注自主神经功能与CSVD之间的关系,以动态心电图监测得到HRV指标来反映自主神经功能,研究结果显示HRV降低与WMH及CSVD总负荷相关[13,22]。一些横断面调查研究结果提示,不同脑区的EPVS可能有不同的危险因素,年龄、腔隙、WMH与BG-EPVS具有显著相关性;CS-EPVS的形成可能与tau蛋白的沉积有关[16-17,23]。故研究HRV指标与不同脑区EPVS的严重程度、EPVS分布优势模型的关系,对进一步探索EPVS的发病机制有积极意义,可对其进行早期检测及预防提供理论依据。 本研究以长时程动态心电图为监测手段,分析HRV与BG-EPVS、CS-EPVS严重程度及EPVS分布优势模型的关系。Spearman秩相关分析显示,rMSSD、PNN50、TP与BG-EPVS严重程度呈负相关。SDNNindex、rMSSD与EPVS优势模型呈正相关,即当SDNNindex、rMSSD的水平较低时,此时BG-EPVS负荷可能比CS-EPVS负荷更重。多因素Logistic回归分析显示,在校正混杂因素后,rMSSD是BG-EPVS严重程度及EPVS优势模型的独立影响因素。象征自主神经整体活性的SDNNindex、TP及象征迷走神经活性的PNN50、rMSSD是HRV的主要指标[24]。因此本研究结果提示,BG-EPVS严重程度与副交感神经活性下降有关,且此时更可能出现BG-EPVS负荷较CS-EPVS负荷高。MOON等[25]的研究探讨了阻塞性呼吸睡眠暂停患者HRV与CSVD之间的关系,发现HRV下降与CSVD的发生和发展存在着明显的相关性;一项研究对60岁以上的阻塞性呼吸睡眠暂停患者的HRV与CSVD总负荷评分进行了分析,结果显示夜间HRV与CSVD总负荷评分呈显著负相关[13];另一项两样本孟德尔随机化分析研究报告,HRV下降与CSVD风险增加有关[14]。本研究结果与上述研究类似。然而YAMAGUCHI等[26]的一项基于社区居民并通过动态血压检测夜间HRV的研究显示,HRV升高是老年人CSVD进展的危险因素;另一项在社区患者中进行的纵向研究也未能发现动态血压监测的HRV和WMH之间的联系[27]。本研究结果与之不一致,分析其原因可能与HRV检测的方法或时段不同有关。 目前对于自主神经功能障碍特别是副交感神经活性降低与EPVS发生、发展的关联机制尚不明确,可能的原因有:(1)由于副交感神经活动减少,交感神经-副交感神经系统失衡,导致心脏功能发生异常,引起血压、心率及血流动力学、血液流变学等的异常[19],而血管周围间隙的代谢废物清除作用是通过微血管的搏动来实现的,当血压或血流动力学改变时,可导致微血管搏动的振幅改变,使血管周围间隙净流量减少,代谢废物的清除减少,进而可能导致EPVS的形成[28-29]。(2)自主神经系统可调节心输出量及脑中毛细血管的直径[30-31],以维持脑血流量平稳,当其紊乱时,脑血管自我调节受损,可能造成全脑的低血流灌注,且基底节区域的血管结构缺乏吻合,更可能引起局部缺血、缺氧,随之可引发氧化应激,激活炎性级联反应,导致血脑屏障完整性破坏、胶质细胞和神经元细胞损伤[32]。另有研究发现交感神经兴奋性增高或副交感神经活性降低与血管壁搏动增加有关,可能会对内皮细胞造成机械应力,长期可导致内皮细胞功能障碍[33],进而可使血脑屏障受损;此时,代谢废物、小微蛋白等流动至血管周围间隙内,若未能及时清除,则可能促进EPVS的形成,这同样是CSVD一个潜在的关键致病过程[34]。最近的一项研究显示,BG-EPVS而不是CS-EPVS与血脑屏障的完整性受损有关[23],这可能为揭示HRV降低与BGEPVS严重程度相关而与CS-EPVS无关提供一个可能的解释。此外,当血管内漏出的成分在血管周围间隙内蓄积时可对血管周围组织造成损伤,导致总脑组织体积的减少,由于血管周围间隙靠近脑实质,这些区域的萎缩可能导致血管周围空间扩大,形成EPVS[35-36]。(3)中枢神经系统的胆碱能抗炎系统活性会随迷走神经活动的减少而降低[37-38],这可使体内炎性因子增多,血管内皮被破坏,导致神经血管单元损伤及血脑屏障的异常[39-40],由此会产生一个血管内皮损伤-血脑屏障受损-血管内物质漏出、蓄积的恶性过程,导致EPVS的进展。由于自主神经功能障碍、炎症、血管网状内皮系统受损等几者之间存在着复杂多样的交互传导关系,不能完全排除上述的多种机制共同参与导致了EPVS产生、发展的可能性。目前有关HRV水平下降及其和脑血管疾病之间的相互关系还没有很充分的明确,一些观察性的研究报道,脑血管病变也可能直接导致自主神经功能的失调[41-42]。 综上所述,rMSSD的下降是BG-EPVS负荷加重及BG>CS-EPVS负荷优势模型的独立影响因素,提示自主神经功能障碍可能参与BG-EPVS发生、发展的病理生理学机制。本研究可为探索EPVS早期生物标志物提供一定的理论支持。对于HRV改变但无自主神经障碍症状的患者,可给予积极的干预以减缓EPVS的发生和发展。 本研究局限性:首先,本研究纳入人群仅限于住院人群,不能排除选择偏差,因此将本研究的结论推断到社区群体时应谨慎;其次,本研究为横断面研究,因此需要进一步的大样本纵向研究来探讨HRV与EPVS之间的因果关系;最后,研究对象HRV的监测是在住院期间进行的,可能不能反映日常生活中的HRV。 作者贡献:周东杨进行实验设计,负责病例资料的收集与整理,进行统计分析,并撰写论文初稿;陈静参与实验设计,并为研究课题提供资金支持;路畅协助进行数据收集与整理;白宏英对研究的整体规划和执行进行监督与管理,对文章整体负责。 本文无利益冲突。2 结果



3 讨论

