整合流式评分在骨髓增生异常综合征中的诊断和预后价值研究
陈颖,李纪鹏*,叶佩佩
骨髓增生异常综合征(myelodysplastic syndrome,MDS)是一组异质性、髓系克隆性造血干细胞恶性肿瘤,其特征为血细胞减少,一个或多个细胞系病态造血,遗传学不稳定,转化为白血病的风险较高等[1]。尽管新的诊断方法不断出现,但诊断MDS的“金标准”仍是基于骨髓形态、祖细胞计数和细胞遗传学[2]。细胞发育不良并非MDS特有,骨髓涂片质量不佳、病态造血不明显或原始细胞增加不显著,尤其是在核型正常或没有MDS相关遗传变异的情况下,MDS诊断通常很有挑战性。多参数流式细胞术(multiparametric flow cytometry,MFC)用于评估骨髓细胞异常表型,已成为诊断MDS的重要共同标准[2-3]。普遍使用的四参数流式评分系统——Ogata评分[4]诊断MDS的特异度较高(90%以上),但灵敏度较低(30%~70%)[4-7]。2017年由CREMERS等[6]应用44个流式参数设计了整合流式评分(integrated flow cytometric score,iFS),包括Ogata评分,未成熟、成熟的粒细胞和单核细胞系以及红细胞的发育不良特征分析,该评分全面分析了各个细胞系,对MDS有较好的诊断价值,OELSCHLAEGEL等[7]认为iFS是诊断MDS的最佳评分系统。但目前关于此评分系统在中国人群中的研究鲜见报道,尤其是在原始细胞不增加的低级别MDS中,并未广泛应用。因此,本研究探索iFS在MDS诊断和预后评估中的应用前景,旨在为临床诊断MDS和评价预后寻找合适的流式细胞术评分系统。
1 对象与方法
1.1 研究对象 收集2019年1月至2022年4月在宁波大学附属人民医院血液科因外周血一系或多系减少而就诊的患者,均行血常规、骨髓形态学、流式细胞术、染色体核型分析检查,依据MDS最低诊断标准[2]进行诊断:(1)必要条件:持续4个月一系或多系血细胞减少(如检出原始细胞增多或MDS相关细胞遗传学异常,无需等待可诊断MDS)并排除其他可导致血细胞减少和发育异常的疾病;(2)MDS主要标准(至少满足1条):①骨髓涂片中红细胞系、粒细胞系、巨核细胞系发育异常细胞的比例≥10%;②环状铁粒幼红细胞占有核红细胞比例≥15%;③原始细胞达5%~19%;④检出有MDS诊断意义的染色体异常。满足必要条件和任意一条MDS主要诊断即可确定为最低诊断。纳入标准:(1)发病年龄>14岁;(2)初诊时具有完整的骨髓形态学、流式细胞术和染色体核型结果。排除标准:肿瘤史。共计纳入160例患者作为研究对象,经0~12个月随访最终确诊为MDS的患者83例(MDS组),MDS组中骨髓原始细胞比例<5%为低级别MDS,包括MDS伴单系病态造血(MDS-SLD)、MDS伴多系病态造血(MDS-MLD),MDS伴环形铁粒幼细胞(MDS-RS)、MDS无法分类(MDS-U)、MDS伴孤立5q-(MDS-5q-);77例为反应性的血细胞减少或发育异常,纳入非MDS组,患者临床特征见表1。患者均已签署知情同意书,本研究通过宁波大学附属人民医院伦理委员会批准〔2022-(科研)-031〕。
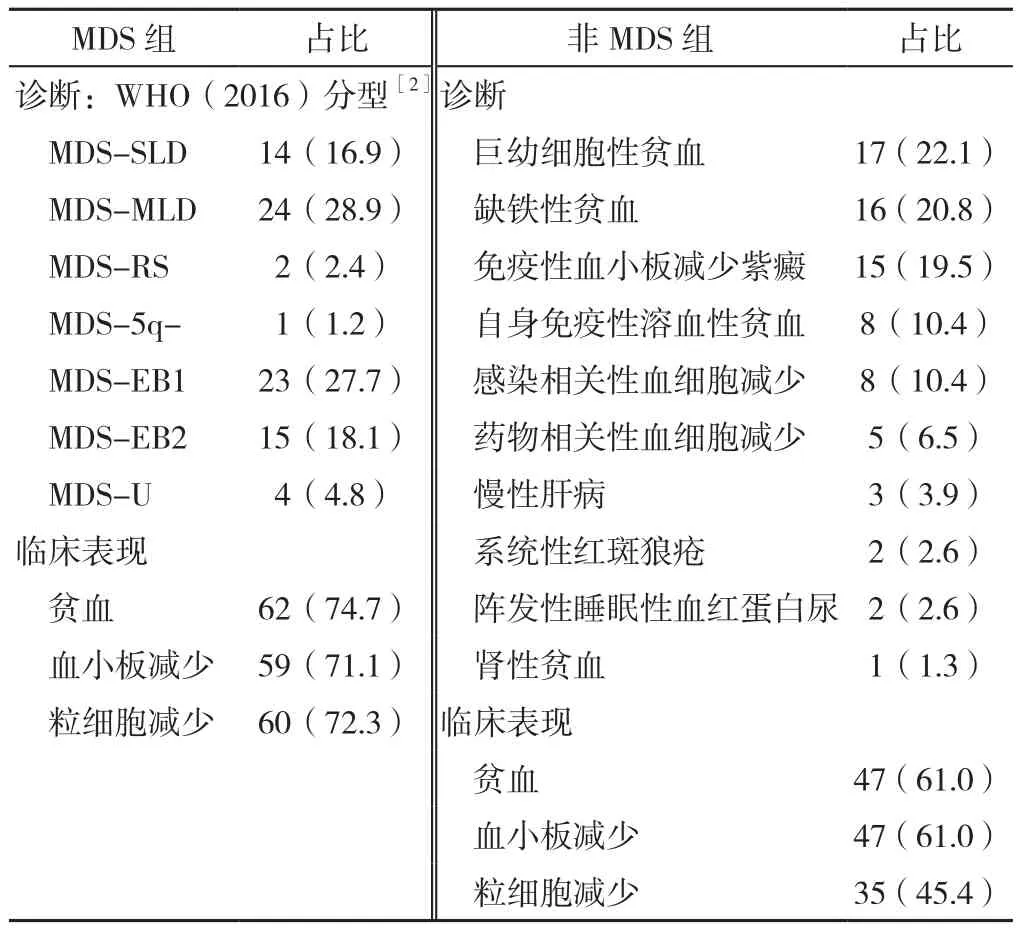
表1 患者临床特征〔n(%)〕Table 1 Clinical characteristics of the participants
1.2 方法
1.2.1 一般资料收集 收集所有患者的性别与年龄,MDS组患者的血常规检查结果〔血红蛋白(Hb)、血小板计数(PLT)和中性粒细胞计数〕、染色体核型结果和骨髓形态学结果。
1.2.2 MFC标本处理和获取数据 抽取患者新鲜骨髓3~6 ml,取1~2 ml用于流式细胞术检查,使用EDTA对其进行抗凝处理,样本处理参照欧洲白血病网(European Leukmia Net,ELN)的MDS标准化操作流程[8]。采用的抗体组合为:(1)CD34-FITC/CD33-PE/CD45-PERCP/CD13-PECY7/CD117-APC/HLA-DRAPC-H7;(2)CD16-FITC/CD56-PE/CD45-PERCP/CD13-PECY7/CD11b-APC;(3)CD15-FITC/CD64-PE/CD45-PERCP/CD34-PECY7/CD11c-APC/CD14-APC-H7;(4)CD38-FITC/CD34-PE/CD45-PERCP/CD19-PECY7/CD10-APC/CD20-APC-CY7;(5)CD3-FITC/CD7-PE/CD45-PERCP/CD4-PECY7/CD5-APC/CD8-APC-H7;(6)CD2-FITC/CD36-PE/CD45-PERCP/CD123-PECY7/CD71-APC。
单克隆抗体购自美国BD公司(Becton,Dickinson and Company),(5~10)×105个骨髓细胞与抗体孵育15 min后,BD FACS Lysing Solution溶解红细胞,洗涤后上机。多参数流式细胞仪 BD FACSCanto Ⅱ采集数据,每管至少获取10万个有核细胞和250个祖细胞。患者的MFC数据采用FACSDiva Version 6.1.3软件进行盲法、回顾性分析骨髓细胞异常表型。
1.2.3 MFC分层设门策略和诊断评分 分层设门识别各细胞系,设门策略参考ELN指南[8-9]。设置荧光参数/Time二维点图选择液流稳定区域;设置前向散射光(forward scatter,FSc)/侧向散射光(side scatter,SSc)二维点图,去除杂质;设置二维点图FSc-A/FSc-H,去粘连体细胞;骨髓有核细胞显示在CD45/SSc二维点图上,设置髓系祖细胞门(CD34+和 /或 CD117+CD45dimSScint)、B祖细胞门(CD19+CD34+CD45dimSSclow)、淋巴细胞门(CD45hiSSclow)、粒细胞门(CD45dimSScint/hi)、单核细胞门(CD45hiSScint)和有核红细胞门(CD45neg/dim),Ogata评分的4个参数见表2,SSc峰值和CD45平均荧光强度值由软件计算得出,粒细胞与祖细胞和/或单核细胞重叠时,必须通过适当的标志物(例如:CD34、CD117、CD15、CD64等)进行识别[8],分别对门内细胞不同抗原表达进行分析,Ogata评分≥2分为诊断标准的依据;根据Ogata评分和各系表型异常(表2),iFS判读患者为“A”表示“MFC无MDS迹象”,“B”表示“MFC提示有限的MDS迹象”,iFS判读为“C”表示“MFC符合MDS(即诊断为MDS)”。iFS[6]的判读标准见表3。
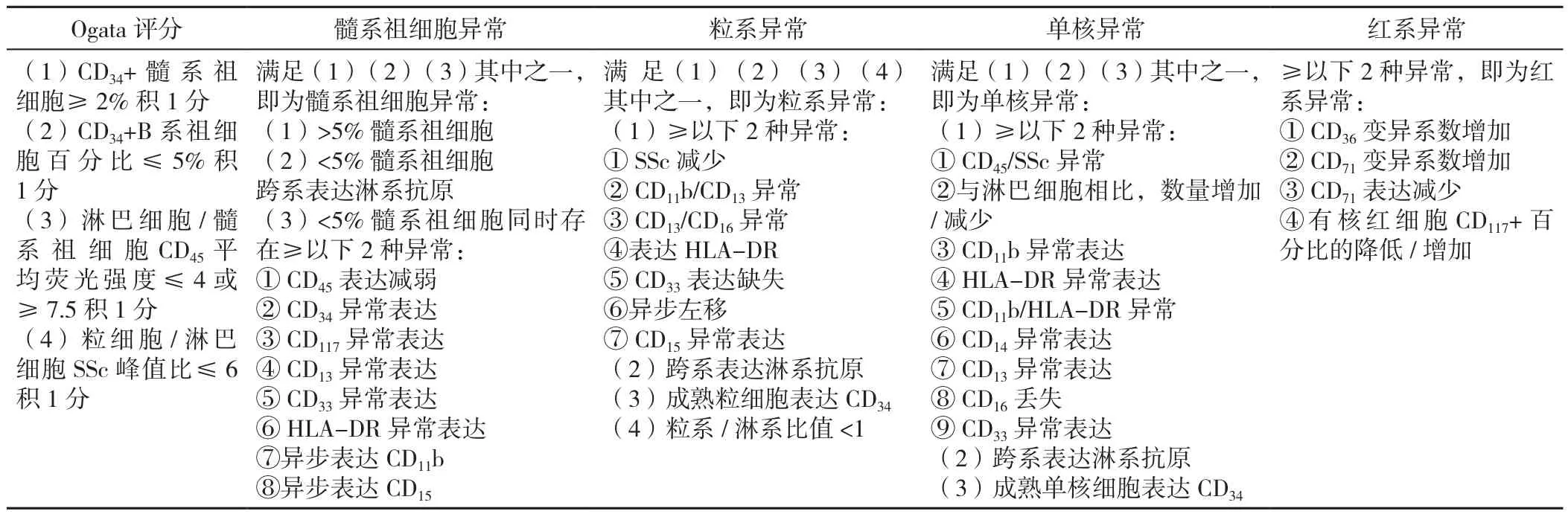
表2 整合流式评分参数Table 2 The parameters of integrated flow cytometric score
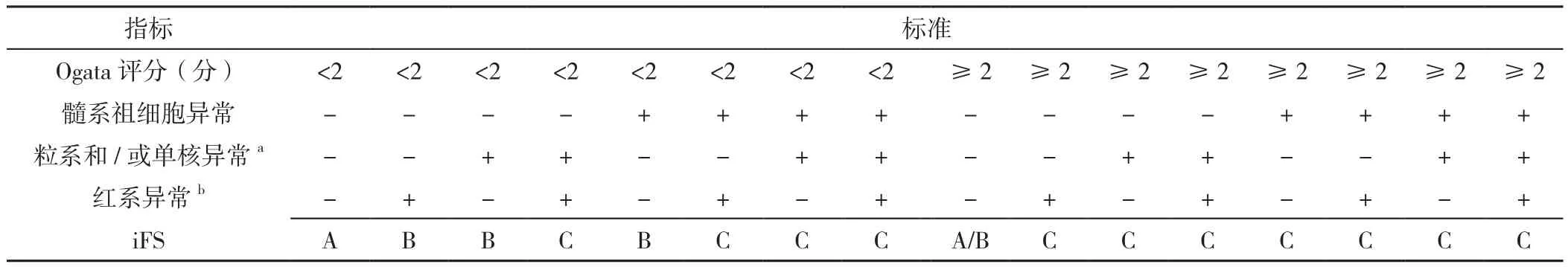
表3 整合流式评分判读标准Table 3 Interpretation criteria of theintegrated flow cytometric score
1.2.4 细胞遗传学风险分类及修订版国际预后积分系统(Revised International Prognositic Scoring System,IPSS-R)评估 在患者抽取的新鲜骨髓3~6 ml中取2~4 ml用于染色体检查,使用肝素对其进行抗凝处理,经RPMI-1640培养基24 h短期培养法制备染色体,R显带技术光学显微镜下分析核型,分析20个分裂象。核型异常依据《人类细胞基因组学国际命名体系2016》(ISCN2016)[10]进行描述。83例MDS患者进行了染色体核型分析,其中2例无中期分裂象,无法获得染色体核型。按照文献[11]对81例MDS患者的染色体核型进行细胞遗传学风险分类:(1)极好:-Y、del(11q);(2)好:核型正常、del(5q)、del(12p)、del(20q)、del(5q)附加另一种异常;(3)中等:del(7q)、+8、+19、i(17q)及其他1~2种独立克隆的核型异常;(4)差:-7、inv(3)/t(3q)/del(3q)、-7/del(7q) 附 加 另 一 种异常和复杂核型(3种);(5)极差:>3种复杂核型。
采用IPSS-R[11]对MDS患者进行预后分层:(1)染色体核型“极好”计0分,“好”计1分,“中等”计2分,“差”计3分,“极差”计4分;(2)骨髓原始细胞≤2%计0分,>2%~5%计1分,>5%~10%计2分,>10%计3分;(3)血红蛋白≥100 g/L计0分,80~<100 g/L计1分,<80 g/L计1.5分;(4) 血小板≥100×109/L计0分,50×109/L~<100×109/L计0.5分,<50×109/L计1.0分;(5)中性粒细胞计数≥0.8×109/L计0分,<0.8×109/L计0.5分。危险度分层标准为:各预后指标计分相加,总积分≤1.5分为极低危,>1.5~3.0分为低危,>3.0~4.5分为中危,>4.5~6.0分为高危,>6.0分为极高危。
1.2.5 MDS治疗方案和患者随访 MDS治疗方案参照《骨髓增生异常综合征中国诊断与治疗指南(2019年版)》[12]。随访开始时间为患者确诊之日,结束时间为2022-04-30,随访资料通过查阅住院、门诊病历和电话随访获得,随访终止事件为患者转白血病或死亡。无事件生存期是指确诊之日起至转白血病或死亡日期为止,无上述事件发生的患者从确诊之日起计算至末次随访日期或经异基因造血干细胞移植日期为止。
1.3 统计学方法 应用SPSS 26.0软件进行统计分析。非正态分布的计量资料用中位数和范围表示,组间比较采用Mann-Whitney秩和检验;计数资料以相对数表示,组间比较采用χ2检验或Fisher's确切概率法。对所有患者按照iFS进行诊断评分,绘制iFS和Ogata评分诊断MDS的受试者工作特征(the receiver operating characteristic,ROC)曲线,计算灵敏度、特异度和ROC曲线下面积(AUC)等;采用Spearman秩相关分析MDS患者iFS评价等级与细胞遗传学风险分类、IPSS-R的相关性;应用Kaplan-Meier法绘制MDS(iFS评价为C)的患者和其他MDS(iFS评价为A或B)患者的无事件生存曲线,生存曲线比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 MDS组和非MDS组中各系的表型异常情况MDS组患者男53例(64%),女30例(36%);年龄25~84岁,中位年龄63岁;低级别MDS 45例,核型正常的低级别MDS 20例;非MDS组患者男40例(52%),女37例(48%);年龄25~89岁,中位年龄68岁。MDS组和非MDS组患者性别和年龄比较,差异无统计学意义(χ2=2.327,P=0.127;Z=-0.442,P=0.658)。根据iFS判读(表2)各系表型异常,MDS组髓系祖细胞出现异常的比例为71.1%(59/83),高于非MDS组的1.3%(1/77),差异有统计学意义(χ2=82.998,P<0.001);MDS组粒系和/或单核系表型异常的比例为73.5%(61/83),高于非MDS组的18.2%(14/77),差异有统计学意义(χ2=49.074,P<0.001);MDS组MDS表型出现≥2种红系表型异常比例为60.2%(50/83),高于非MDS组的14.2%(11/77),差异有统计学意义(χ2=35.760,P<0.001)。
2.2 iFS、Ogata评分诊断MDS的 ROC曲线 81.9%(68/83)的MDS患者iFS评价为C;100%(38/38)的MDS伴原始细胞增多1型(MDS-EB1)和MDS伴原始细胞增多2型(MDS-EB2)评价为C;45例低级别MDS中,42.2%(19/45)的患者Ogata评分≥2分,iFS均评价为C,其余26例(57.6%)患者Ogata评分<2分,按照iFS其中11例评价为C,另有15例(7例MDS-SLD,8例MDS-MLD)未诊断为MDS:3例评价为A,12例为B。不同iFS评价结果与MDS分类比较,差异有统计学意义(χ2=27.930,P<0.001)。各组中iFS评价为A、B、C的患者例数和百分比见图1。iFS诊断MDS的AUC为0.921〔95%CI(0.876,0.967)〕,特异度为93.5%,灵敏度为81.9%,约登指数为0.754;iFS诊断低级别MDS和核型正常的低级别MDS灵敏度分别为66.7%和65.0%,Ogata评分诊断MDS效能见图2、表4,iFS诊断效能见表5。
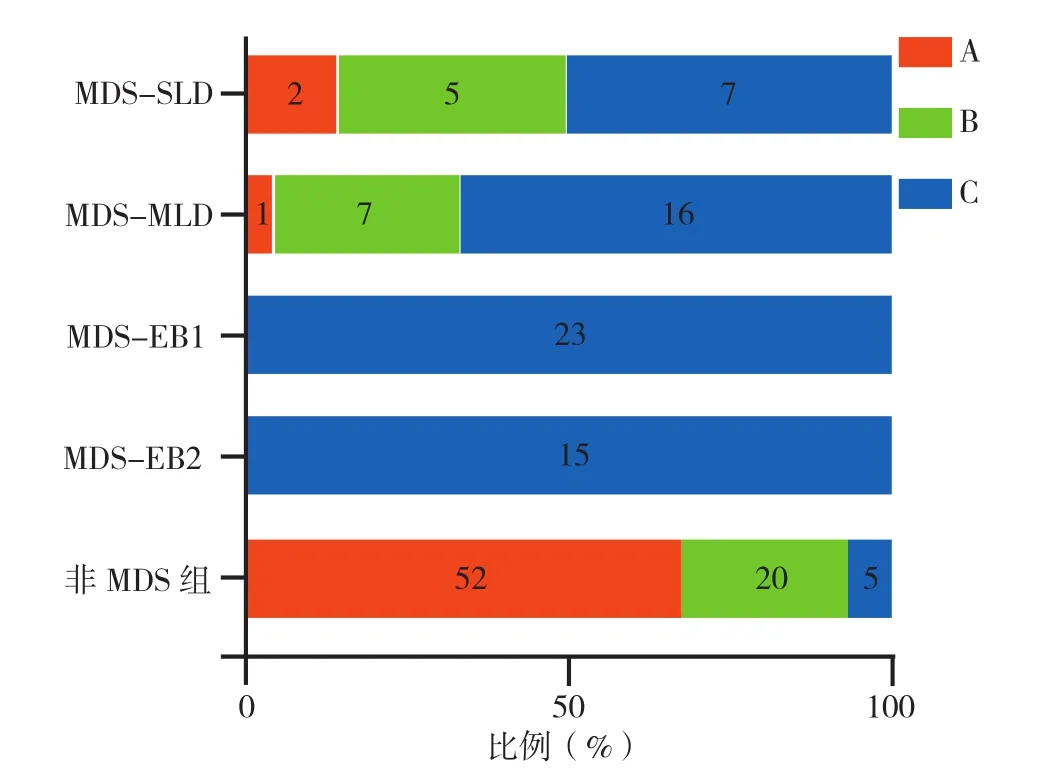
图1 各组中iFS评价为A、B、C的患者数量和百分比Figure 1 The number and percentage of patients evaluated as A,B,orC by the integrated flow cytometric score in each group
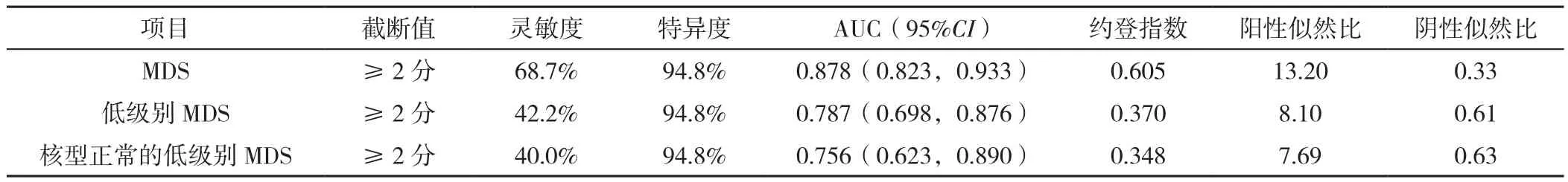
表4 Ogata评分对MDS的诊断效能评估Table 4 The diagnostic efficacy of the Ogata score in myelodysplastic syndrome
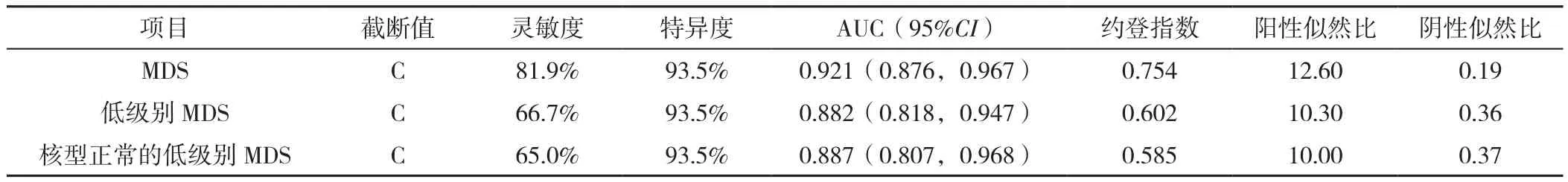
表5 iFS对MDS的诊断效能评估Table 5 Diagnostic efficacy of the integrated flow cytometric score in myelodysplastic syndrome
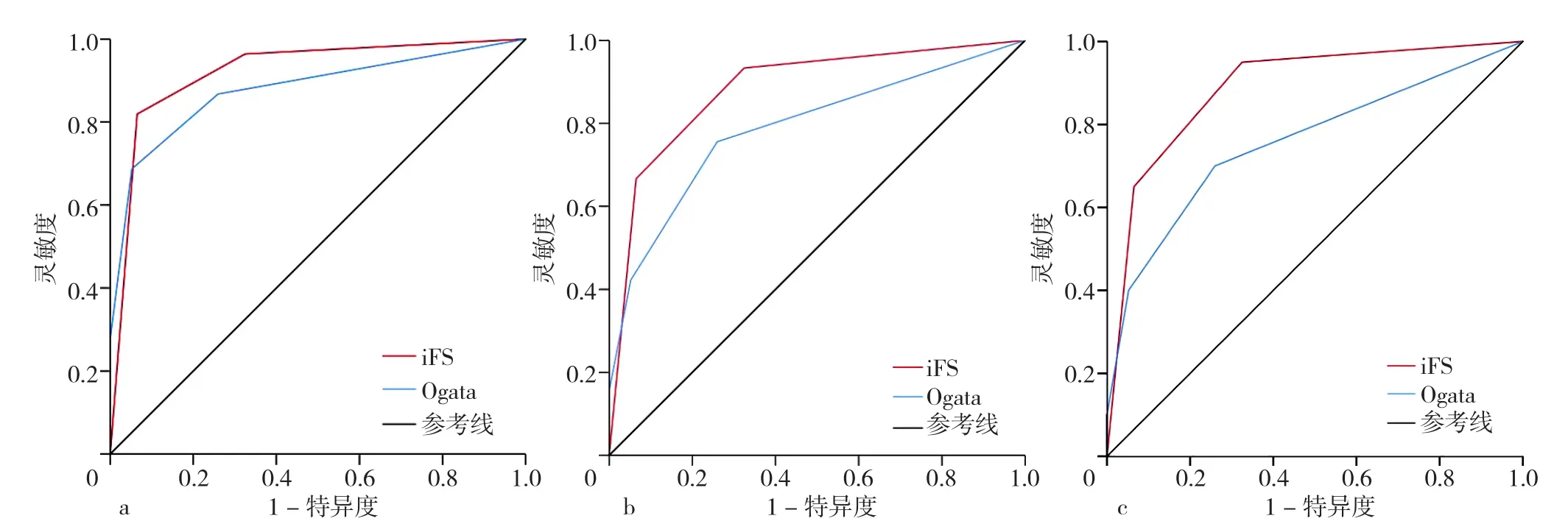
图2 Ogata评分和iFS诊断MDS、低级别MDS以及核型正常的低级别MDS的ROC曲线Figure 2 ROC curves of the Ogata score and integrated flow cytometric scorein diagnosing myelodysplastic syndrome,low-grademyelodysplastic syndrome,and low-grade myelodysplastic syndrome with normal karyotype
2.3 iFS与MDS预后的相关性 为评价iFS与MDS预后的关系,本研究还试图发现iFS与细胞遗传学、IPSS-R之间的联系。81例MDS患者进行了细胞遗传学风险分类,无核型极好患者,核型好组53例(65.4%),核型中等组12例(14.8%),核型差组6例(7.4%),核型极差组10例(12.3%)。iFS的评价等级与细胞遗传学风险分类无相关关系(rs=0.047,P=0.676)。由于IPSS-R极低危样本数量有限(仅1例极低危),将极低危和低危并为一组,以减少误差。iFS的评价等级与IPSS-R呈正相关(rs=0.411,P<0.05),见表6。对83例MDS患者进行随访,中位随访时间12.0(0.2~41.0)个月,评价为C的患者中位无事件生存时间短于评价为A或B的患者(χ2=5.71,P<0.05),见图3。
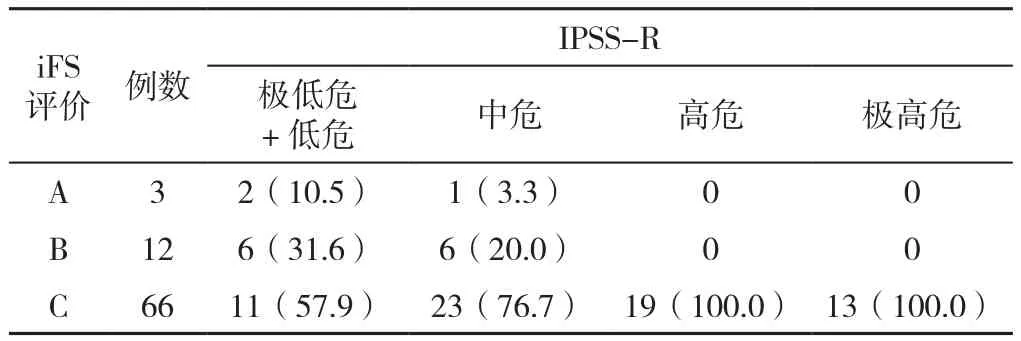
表6 iFS评价等级与IPSS-RTable 6 The evaluation grade of the integrated flow cytometric score and Revised International Prognostic Scoring System
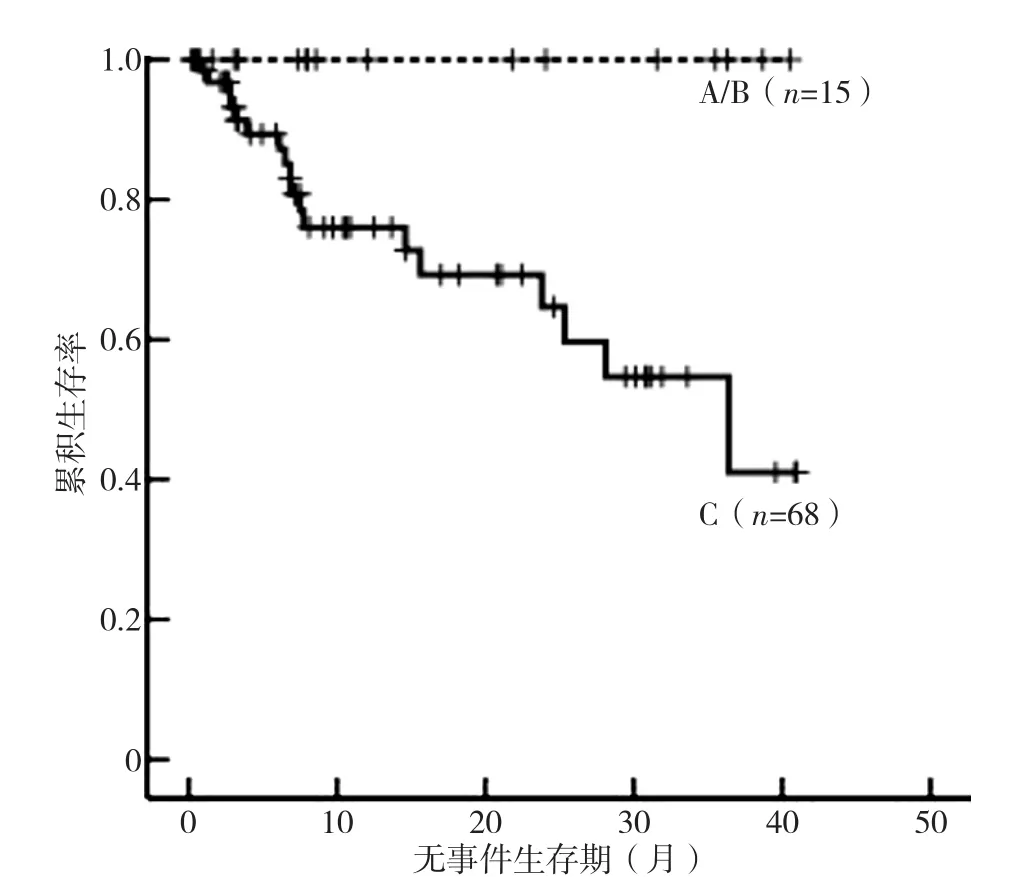
图3 83例iFS评价为A/B和C的MDS患者无事件生存期比较Figure 3 Comparison of the event-free survival in 83 cases of myelodysplastic syndromeevaluated as A/B orC by the integrated flow cytometric score
3 讨论
WHO造血和淋巴组织肿瘤分类(2016)[13]列出了MFC检测MDS的免疫表型异常,包括粒系CD11b/CD13或CD13/CD16成熟发育模式异常;祖细胞、粒细胞或单核细胞上跨系表达CD56和/或CD7;粒细胞SSc减少;以及幼红细胞CD71或CD36变异系数的增加或表达强度的降低等。近几年多个MDS流式评分系统被开发出来,应用不同抗原表达和不同评分策略对MDS的诊断评估。以ELN为平台,多中心大样本研究提出的Ogata评分[4]分析祖细胞和成熟粒细胞异常,特异度高,灵敏度较低;MATHIS等[14]评估红系CD36和CD71变异系数的增加,并结合Hb水平辅助诊断MDS,灵敏度为88%,特异度为89%,但后续的研究没有得到很好的证实[7];iFS将ELN的MDS流式工作组评价系统[15]和红系评分[16]相结合,综合Ogata评分和各系表型异常加以评价,是迄今为止评价细胞系最全面的MDS诊断评分系统[17]。
本研究结果发现,根据iFS判读各系表型异常,MDS组和非MDS组髓系祖细胞、粒系和/或单核系、红细胞表型的异常检出率比较,差异均有统计学意义,均与MDS的诊断显著相关。CREMERS等[6]研究结果表明,iFS特异度(95%)优于Ogata评分(86.9%),而OELSCHLAEGEL等[7]指出iFS特异度(86%)不如Ogata评分(94%),本研究发现,iFS特异度(93.5%)基本与Ogata评分(94.8%)相当,可能与不同的抗体组合或人种差异有关。多个研究小组表明,骨髓祖细胞的数量和免疫表型异常对区分MDS和非克隆性血细胞减少症非常有效,原因可能是MDS的本质是干细胞的克隆性异常,干祖细胞很大概率会有表型异常,并且与成熟细胞相比,祖细胞受感染或炎症的影响更小[17-21]。本研究非MDS组中仅有1例(1.3%)患者髓系祖细胞表型异常,而粒系和/或单核系、红细胞表型异常分别为14例(18.8%)和11例(14.2%),推测祖细胞表型异常对MDS的诊断更具特异性,但仍需要大量研究验证该推测。Ogata评分≥2分特异性高,iFS在Ogata的基础上分析髓系祖细胞表型异常,这可能是iFS评价为C同样特异性较高的原因,即使粒系和/或单核系合并红细胞表型异常可能会影响iFS的评价结果。
本研究iFS灵敏度为81.9%,优于Ogata评分(68.7%),AUC也优于Ogata评分,尤其是在低级别MDS和核型正常的低级别MDS中,iFS将Ogata评分灵敏度从42.2%和40.0%分别提高至66.7%和65.1%,提示iFS是MDS的有效鉴别方法,这与以往研究结果[6-7]基本一致。45例低级别MDS中Ogata评分<2分为26例,按照iFS判读其中11例评价为MDS。越来越多的研究显示,MDS没有单一特异的免疫表型标志物,干祖细胞[19-21]、成熟粒单系[21-22]和红系[14,16,23]多种表型异常提示存在潜在的MDS克隆性异常。MDS患者髓系祖细胞CD34表达减少或缺失、CD34<2%但伴有祖细胞表型异常以及仅成熟粒单系和/或红系发育不良的情况下,Ogata评分很难达到2分,iFS能识别部分Ogata评分<2分的MDS患者,灵敏度优于Ogata评分。
DELLA PORTA等[24]提出Ogata评分可能为低级别MDS提供额外的生存信息;MDS患者的祖细胞、粒细胞和单核细胞发育不良,与IPSS-R和总生存期均存在相关性[17,22,25],iFS与预后分层的相关性研究鲜见报道。本研究结果发现iFS评估等级与IPSS-R呈正相关,iFS为C的患者比例随着MDS预后评分的升高而增加,15例评价为A或B的患者均属于IPSS-R低风险或中风险。但是,iFS与细胞遗传学风险分类无相关性,可能是由于细胞遗传学亚组中的患者数量较少,需要增加病例加以分析。另外,对83例MDS患者的治疗和生存情况进行随访,评价为C的患者无白血病时间或生存时间明显短于评价为A或B,因此iFS可为MDS提供预后信息,尤其是在骨髓纤维化、骨髓涂片质量不佳或染色体无分裂象等原因无法获得预后评分的情况下。
诊断MDS最大的挑战是将MDS与血细胞减少和发育不良的反应性原因分开。MFC提供了一种更客观可靠的诊断工具,iFS全面地分析各细胞系表型异常,有助于诊断MDS,特别是原始细胞无增加的正常核型MDS。此外,该评分提示疾病预后,为临床合理治疗提供重要的预后依据,具有重要的临床意义,可进一步推广。
本研究首次探索了中国人群中iFS在MDS中的诊断价值,以及iFS与IPSS-R的相关性。结果发现,iFS诊断MDS的特异度为93.5%,灵敏度为81.9%,诊断低级别MDS、核型正常的低级别MDS的灵敏度分别为66.7%和65.0%,iFS评价等级与IPSS-R呈正相关(rs=0.411,P<0.05)。在骨髓涂片质量不佳、病态造血不明显或原始细胞不显著增加的情况下,尤其是在核型正常或无分裂象时,iFS可为MDS提供客观而可靠的诊断和预后价值。但本研究为单中心研究,样本数较少,随访时间较短以及少数患者失访,发生死亡的病例数尚少,需要继续随访病例并收集更多样本进行多因素生存分析,以深入评价iFS对MDS的预后意义。
作者贡献:陈颖进行文章的构思与设计,文章的可行性分析,负责收集病例、数据整理分析及论文撰写;李纪鹏负责研究指导、论文修改及经费支持,并对文章整体负责、监督管理;叶佩佩负责收集病例、临床指导。
本文无利益冲突。

