mRNA 疫苗技术和产业发展概况
刘财旺
玉溪沃森生物技术有限公司
龙新华
玉溪沃森生物技术有限公司
包嫄
云南沃森生物技术股份有限公司
李薇*
云南沃森生物技术股份有限公司
1989年,有研究者发现在脂质包裹下mRNA 可以在真核细胞内转染和表达,mRNA 作为药物的概念被提出[1]。1990年,研究者成功完成了体外转录mRNA 在小鼠体内的表达,证明了mRNA作为药物的可行性[2]。1995年,又有研究者用小鼠模型开发了第一种编码癌胚抗原(CEA)的mRNA 肿瘤疫苗,证明mRNA疫苗在肿瘤治疗领域具有较好前景[3]。然而,由于mRNA 稳定性差、先天免疫原性高、体内递送效率低下,mRNA 药物开发在很长一段时间内受到限制[4]。近年来,mRNA 修饰技术和递送技术不断进步。2005年有研究者发现使用修饰尿苷合成的mRNA可以避免被免疫系统识别和降解,有效解决了mRNA 在体内的不稳定性和高免疫原性问题;非翻译区的优化和poly(A)尾优化技术提高了mRNA 的稳定性和翻译效率;纯化方法的改进有效去除了双链RNA 杂质,从而减少先天免疫的非特异性激活;通过将mRNA 配制成纳米颗粒,如脂质纳米颗粒(LNP)、聚合物纳米颗粒和脂质-聚合物杂化纳米颗粒,mRNA 技术逐渐成为传染病和肿瘤防治领域的焦点[4-17]。2023年诺贝尔生理学或医学奖授予了科学家Katalin Karikó 和Drew Weissman,以表彰他们在核苷碱基修饰方面的发现,推动了mRNA 疫苗在抗击COVID-19大流行过程中发挥巨大作用;同时,mRNA 疫苗也在此期间取得了快速发展[12,18-21]。mRNA 药物技术开发过程中的部分关键节点见图1[22]。
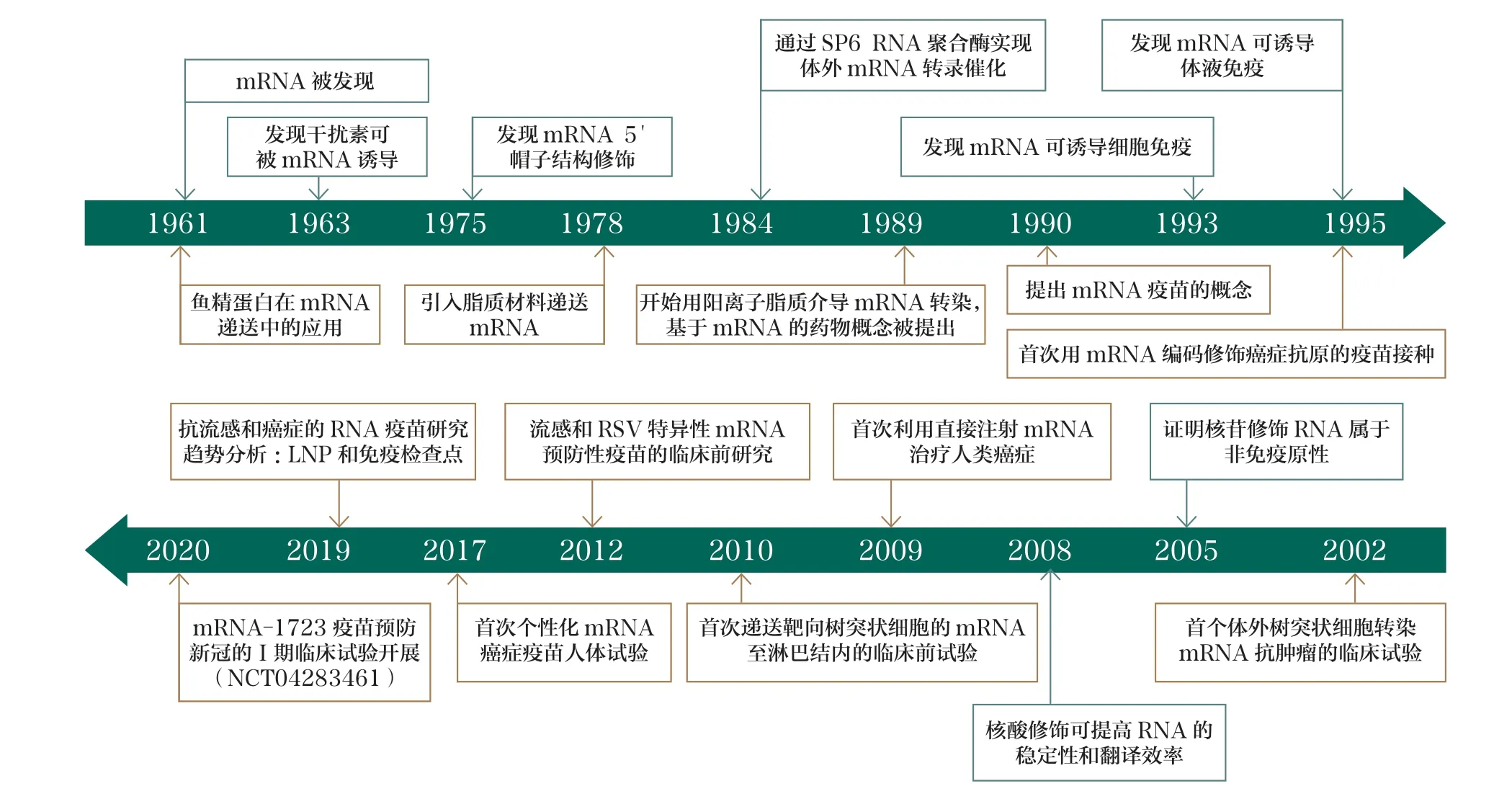
图1 mRNA 药物技术开发过程部分关键节点[22]
1 mRNA 疫苗简介
1.1 mRNA疫苗的作用机制
如图2 所示,接种mRNA疫苗后,体外转录(IVT)mRNA 通过递送载体进入靶细胞的细胞质中,通过靶细胞的表达系统合成具有特定药理活性的抗原蛋白,翻译的抗原蛋白被蛋白酶降解为抗原肽,然后被转运到内质网中,并通过主要组织相容性复合体(MHC)Ⅰ途径呈递给CD8+T 细胞,以诱导细胞介导的免疫反应。部分抗原蛋白由宿主细胞分泌并被附近的抗原呈递细胞(APC)吸收,通过MHC Ⅱ途径呈递给抗原特异性CD4+T细胞,分泌细胞因子引发细胞免疫反应,并激活B 细胞产生抗体。抗原蛋白也可以通过一种交叉呈递的机制被处理,并通过MHCⅠ途径激活抗原特异性CD8+T细胞,从而杀死肿瘤细胞或病毒感染的细胞,以达到预防和治疗疾病的目的[16,23-27]。

图2 mRNA 疫苗作用机制示意图[28]
1.2 mRNA 疫苗的结构
目前用于疫苗研究的mRNA主要有3 种类型:非复制mRNA、自扩增RNA(saRNA)和环状RNA(circRNA)。其中,非复制mRNA 最为常用。环状mRNA 模仿了病毒感染过程,其复制机制可以大幅降低疫苗剂量;环状mRNA 的闭环结构保护其免受核酸外切酶降解,稳定性更好。mRNA 含有几个必要的结构,包括帽子结构(Cap)、5'非翻译区(5'UTR)、编码抗原蛋白的开放阅读框(ORF)、3'非翻译区(3'UTR)和poly(A)尾结构。自扩增mRNA 疫苗的开放阅读框还包括编码细胞内RNA 扩增所需的非结构蛋白,环状mRNA 则是一个没有5'UTR 和3'UTR 的闭环结构[29]。不同类型mRNA的结构和翻译过程见图3。
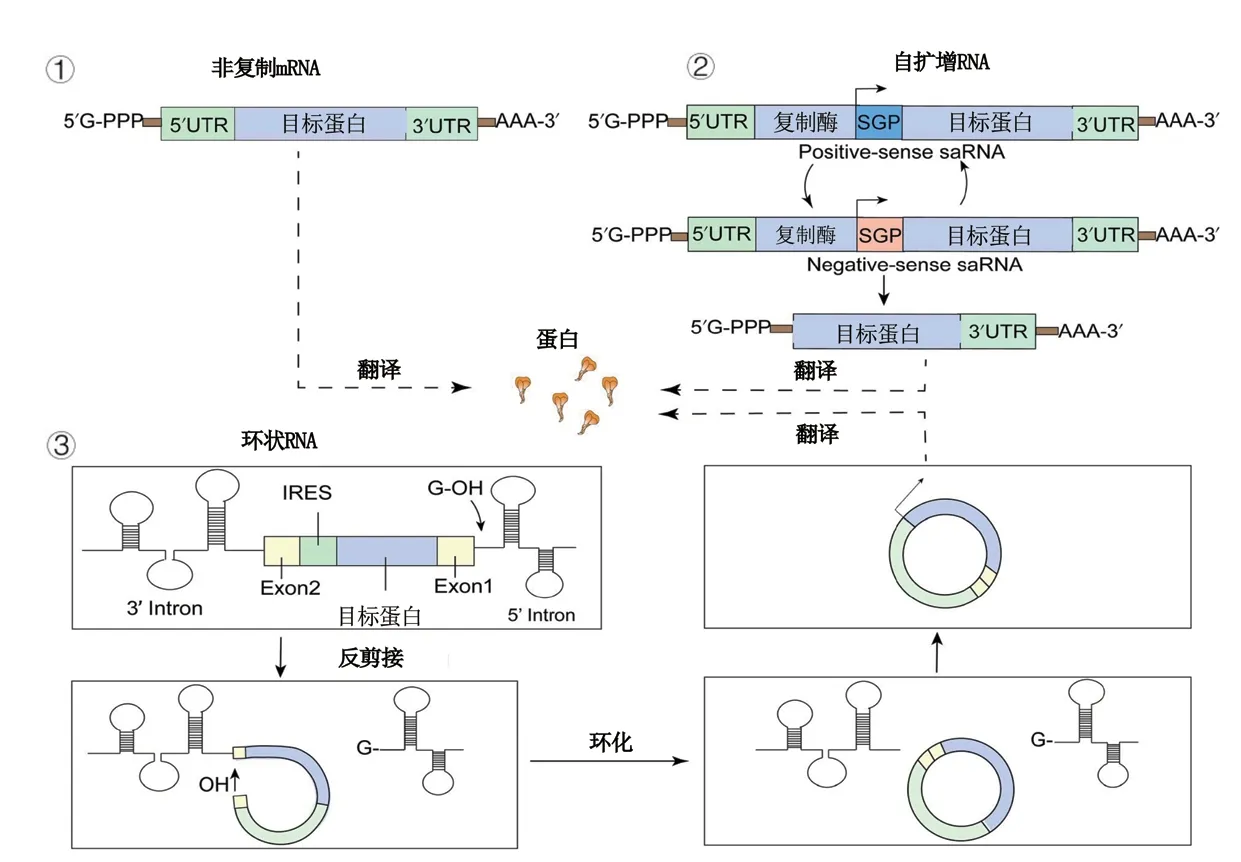
图3 不同类型mRNA 的结构和翻译过程[29]
如前文所述,mRNA 疫苗必须被输送到人体的靶细胞才能引发免疫反应,但是mRNA 进入人体后很容易被核酸酶降解,且难以透过细胞膜屏障到达细胞质,因此mRNA 疫苗还需要合适的递送载体。另外,mRNA 疫苗通常需要冷冻储存,需要冷冻保护剂保护递送系统不被破坏。因此,mRNA 疫苗的主要组成部分包括编码抗原蛋白的mRNA,用于包埋、递送mRNA 的脂质载体(最常用的是LNP),缓冲溶液(如PBS buffer 或Tris buffer),冷冻保护剂(如蔗糖)。以新冠mRNA 疫苗为例,辉瑞(Pfizer)与BioNTech 公司合作开发的BNT162b2 以及莫德纳公司开发的mRNA-1273 这两款疫苗的结构组成见图4。
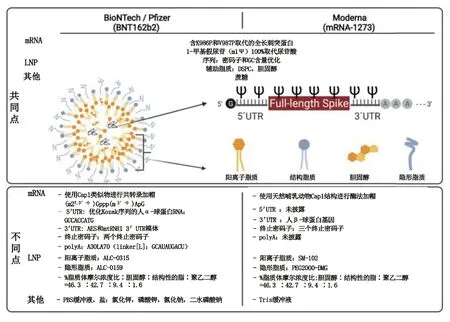
图4 新冠mRNA 疫苗BNT162b2 和mRNA-1273 的结构组成[30]
其中,mRNA 制剂依靠阳离子脂质在低pH 环境下有效地复合带负电荷的mRNA,形成LNP 的核心[31-33]。磷脂在LNP中发挥结构作用,有助于脂质双分子层的形成和破坏,以促进内体逃逸[34-35]。胆固醇在LNP 中起稳定作用,在细胞转染中至关重要[36-37]。聚乙二醇(PEG)脂质在LNP 表面充当屏障,在空间上稳定LNP 并减少与蛋白的非特异性结合[38]。
1.3 mRNA疫苗生产方式
基于目的mRNA 的特性及临床应用,其合成方式主要有化学合成、重组生产、酶法合成等,其中体外转录(酶法)被认为是大规模生产mRNA 金标准[39]。mRNA 疫苗制备流程如图5 所示,在上游,疫苗靶序列被导入质粒中,DNA 模板被生成、扩增、纯化和线性化;在中游,使用T7 RNA 聚合酶在体外转录反应后合成RNA,并使用5'帽类似物共转录(或转录后加帽)实现RNA的5'加帽,再通过纯化得到高纯度的mRNA;在下游,将获得的高纯度mRNA 配制在LNP 中,并装入小瓶或容器中,用于大规模接种或使用[5,40-41]。

图5 mRNA 疫苗制备流程[42]
上述方法几乎适用于生产任何mRNA 序列,批次间变异性低,与其他平台相比,有助于节省时间并降低经济成本。对mRNA原料药和制剂药物产品进行测试和过程分析,以评估鉴别、外观、含量、纯度、RNA 完整性、残留DNA、包封率、粒径、生物活性内毒素污染和无菌性[5,43]。对于特定的mRNA,制备mRNA 药物的程序可能会稍作调整,包括修饰核苷,以及采用加帽策略或纯化策略等。
生产mRNA 所需的所有设备均符合良好生产规范(GMP)级别,在有限的工业规模的生产设施内,每年可生产数千万剂基于RNA 的产品[5]。
1.4 mRNA 疫苗优势
首先,mRNA 疫苗是一种无感染、安全的平台,没有感染或插入基因组突变的潜在风险性[11,44]。其次,mRNA 体内半衰期可以通过使用mRNA 修饰和递送方法来调节[45]。再次,mRNA 疫苗允许同时递送多种抗原,特别是对于肿瘤疫苗,可以覆盖各种肿瘤相关抗原(TAA)、肿瘤特异性抗原(TSA)或细胞因子,以引发体液和细胞介导的免疫反应,从而增强抗肿瘤功效[46]。最后,如前文所述,mRNA 疫苗具有可扩展性,可以通过无细胞的体外转录(IVT)获得高产量的mRNA,且一旦建立了成熟的mRNA 疫苗平台,就可以通过该平台快速开发不同的mRNA 疫苗。
2 mRNA 疫苗产业发展状况
2.1 mRNA疫苗研发进展
目前,大量mRNA 疫苗正在研制中,部分已应用于临床治疗各种疾病,包括新冠mRNA 疫苗、其他传染病mRNA 疫苗和肿瘤mRNA 疫苗。此外,mRNA 疫苗也会与其他疗法(如化学疗法和免疫疗法)联合使用。
2.1.1 新冠mRNA 疫苗
新冠病毒(SARS-CoV-2)感染引起的COVID-19 大流行仍在持续,对人类健康和全球经济造成巨大影响,疫苗是抗击COVID-19 大流行的主要途径。2023年1月24日世界卫生组织发布的数据显示,全球有300 多种新冠候选疫苗,其中176 种已进入临床试验阶段。基于mRNA疫苗在预防传染病方面的优势,新冠mRNA 疫苗在COVID-19大流行期间得以快速开发及迭代,并为抗击COVID-19 作出了重要贡献。辉瑞/BioNTech 公司联合开发的BNT162b2(Comirnaty)于2020年12月在美国获得紧急使用授权(EUA),其生物制品许可证申请(BLA)亦于2021年8月在美国获批,是全球第一个上市的mRNA 疫苗;莫德纳(Moderna)公司的mRNA-1273(Spikevax)于2020年12月在美国获得EUA,BLA 于2022年2月1日在美国获批,是全球第二个上市的mRNA 疫苗;我国军事医学科学院、苏州艾博生物和云南沃森生物共同研发 的AWcorna 于2022年9月在印度尼西亚获得EUA,这也是我国在海外获得的第一个EUA;石药集团的SYS6006 于2023年3月在我国获得EUA,为国内首款[47]。部分针对COVID-19的代表性mRNA 疫苗见表1。
莫德纳公司的mRNA-1273 和辉瑞/BioNTech 公司的BNT162b2 均于2020年1月开始研发,并在12 个月内获得EUA,目前仍在全球范围内使用,证明了mRNA 疫苗预防病毒感染的有效性。临床结果表明,BNT162b2 和mRNA-1273 都可以诱导产生高水平的中和抗体,并引发强大的T 辅助因子1 细胞反应,因此在预防野生型病毒感染方面具有较好的效果(~95% )[30]。
COVID-19 暴发以来,参考SARS-CoV-2序列(hCoV-19/Wuhan/WIV04/2019)观察到超过12 000 个突变,大约每11 天发生一次核苷酸替换[48-49]。SARS-CoV-2 的特定突变引发不同的表型改变,其中一些由于可能导致病毒的传播性或毒力增强,通过自然感染或疫苗接种获得的中和抗体减少,使治疗或疫苗接种的有效性降低,被归为关注变体(VOC)[50-51]。截至目前,已经确定了5 种VOC,包括 Alpha、Beta、Gamma、Delta 和Omicron 变体[51]。莫德纳公司的mRNA-1273 和辉瑞/BioNTech 公司的BNT162b2对于上述5 种VOC 的保护效果均出现了不同程度的下降,尤其是对于突变位点达30 多个的Omicron 变体的保护效果下降更为显著[52]。目前,已有多种针对SARS-CoV-2 VOC,尤其是Omicron 变体的mRNA 疫苗正在开发中,包括云南沃森生物与上海蓝鹊生物合作开发的RQ3013、RQ3033 疫苗,并有数种已被授权使用[51-53]。
2.1.2 其他传染病mRNA疫苗
基于mRNA 疫苗在传染病预防方面的优势以及在COVID-19预防中取得的效果,近年来,预防其他传染病病毒[如流感病毒、寨卡病毒、呼吸道合胞病毒(RSV)、带状疱疹病毒]的mRNA 疫苗也成为研发热点,且部分已进入临床试验阶段(表2)。其中,莫德纳公司研发的针对巨细胞病毒(CMV)的mRNA-1647、针 对RSV 的mRNA-1345 以及针对流感病毒的mRNA-1010 进度较快[29]。

表2 部分临床试验阶段的传染病预防mRNA 疫苗[29]
2.1.3 肿瘤mRNA 疫苗
基于可编码多种肿瘤抗原、安全给药和诱导强大T 细胞反应的高免疫原性等优点,mRNA疫苗已成为一种越来越受欢迎的肿瘤治疗方法。肿瘤疫苗的开发主要针对TAA 和TSA。其中,TAA 是由正常基因翻译而来的蛋白质,在肿瘤细胞表面异常或过度表达,但同时也存在于正常组织中,特异性较低。TSA 在正常组织中不存在,但在个体肿瘤细胞中表达,具有高度特异性,因此被认为是理想的肿瘤疫苗抗原。目前,肿瘤mRNA 疫苗大多仍处于Ⅰ/Ⅱ期临床试验阶段(表3)[29,54-55]。
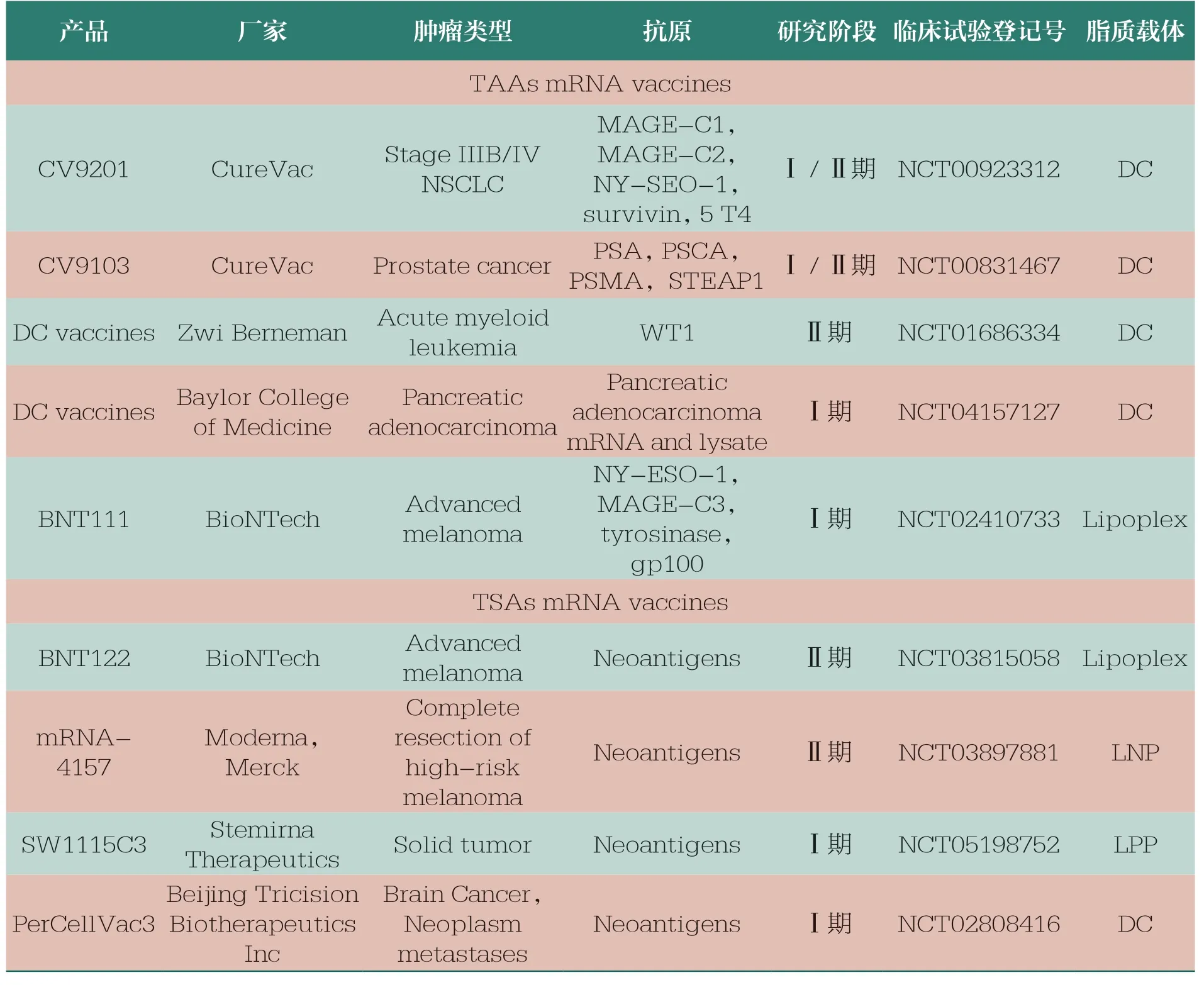
表3 部分临床试验阶段的肿瘤mRNA 疫苗[29]
2.2 mRNA 疫苗的GMP生产
2.2.1 国内外对于mRNA疫苗GMP 生产的要求及差异
我国对疫苗生产实施严格的准入制度,疫苗上市许可持有人自身应当具备疫苗生产能力,一般情况下不允许委托生产。因此,在我国预防用mRNA 疫苗上市许可持有人必须自建GMP 生产线,具备生产和检验放行的能力;但若不是预防用mRNA 疫苗,则不受此限制,可以委托生产。国外药品监管机构对于自建生产线无具体限制要求。因此,我国mRNA 疫苗企业普遍选择自建生产线;而国外相关企业更多的是基于企业自身发展战略选择自建生产线、与其他企业合作或委托生产。
预防传染病用mRNA 疫苗的质粒DNA(pDNA)是否能委托生产,也是一个值得关注的问题。欧盟相关指南(Questions and Answers on the Principles of GMP for the Manufacturing of Starting Materials of Biologicalorigin Used to Transfer Genetic Material for the Manufacturing of ATMPs)把pDNA 作为起始物料进行监管,允许企业委托医药合同生产组织(contract manufacture organization,CMO)生产pDNA。在我国,根据《疫苗管理法》《新型冠状病毒预防用疫苗研发技术指导原则(试行)》等相关规定,pDNA 模板定义为原液的生产工艺,企业应当自主生产pDNA[47]。
2.2.2 国内外mRNA 疫苗GMP 生产基地概况
疫苗生产必须通过GMP 符合性检查,每个工厂都必须具备符合资质要求的人员和基础设施,因此大规模集中生产是mRNA 疫苗生产现状。基于国内外疫苗监管要求的差异,国外mRNA 疫苗企业主要通过与有生产能力的企业合作或委托生产,以快速扩大产能,同时启动新建生产基地,可能用于生产质粒、mRNA 原液、LNP(DP )或者进行灌装和分发;而我国的大部分mRNA 疫苗企业在项目早期就启动建设GMP 生产基地,大多涵盖从质粒生产到最终灌装和分发的功能。
莫德纳公司和辉瑞/BioNTech 公司的新冠mRNA疫苗生产工厂几乎都分布在欧美地区。为了更好地实现疫苗的全球供应,莫德纳公司、辉瑞/BioNTech 公司与包括我国、澳大利亚、加拿大、新加坡、南非和韩国在内的几个国家或地区的企业建立了合作关系,并在部分国家和地区布局了生产基地建设计划。
mRNA 疫苗企业三巨头之一CureVac,在德国总部拥有自己的GMP 级别临床样品生产车间和产业化工厂,其产业化工厂面积达8800m2,设计年产能为3000 万剂。此外,CureVac 还与诺华(Novartis)公司合作,计划在位于奥地利的工厂生产mRNA 原液和制剂,年产能可达2 亿剂[53]。
云南沃森生物是国内最早布局mRNA 疫苗产业化的企业,早在2021年9月就在云南省玉溪市高新区疫苗产业园建成mRNA疫苗模块化工厂,原液年产能可达10 亿剂,制剂产能可达2.4 亿剂。石药集团的SYS6006 由其子公司巨石生物负责生产,巨石生物的mRNA 生产厂房产能可达15 亿剂,其中新冠mRNA 疫苗10 亿剂。此外,国药中生复诺健位于上海嘉定的GMP 生产基地,设计最高年产能为20 亿剂;云顶新耀位于浙江嘉善的GMP 生产车间年产能预计可达7 亿剂次;启辰生生物在珠海金湾国际健康港的GMP 生产车间,建筑面积超1300m2,能实现全链条生产;还有成都威斯津位于成都天府国际生物城的在建生产基地,规划年产能1 亿剂;蓝鹊生物在上海宝山规划了10 000m2GMP 生产基地;康希诺在上海临港规划了约17 000m2生产厂房[53]。
现阶段,由于新冠疫苗的需求大幅下降,mRNA 生产基地的发展目标由快速扩大产能转变为与mRNA 疫苗企业自身战略相适应。基于mRNA 疫苗高度平台化的特点,这些生产基地可以迅速用于其他mRNA 疫苗的开发。
3 mRNA 疫苗供应链概况
3.1 国内外mRNA 疫苗供应链概况
随着新冠mRNA 疫苗的发展,基于传统生物药物的供应链,mRNA 疫苗供应链也愈发成熟。mRNA 疫苗供应链主要包括主要设备、原材料及关键耗材,其中比较关键的是酶、核苷酸底物、帽子结构类似物、脂质辅料、分离纯化设备与耗材、LNP 包封设备与质控设备等。
已上市的新冠mRNA 疫苗中,莫德纳公司的mRNA-1273 和辉瑞/BioNTech 公司的BNT162b2 的原材料成本占比分别为55.9% 和 41.7%(表4),可见原材料在mRNA 疫苗生产中的重要性。其中,帽子结构类似物(46%)、酶类(约30%)占据了大部分原材料成本(表5)[47]。

表4 新冠mRNA 疫苗mRNA-1273(莫德纳公司)和BNT162b2(辉瑞/BioNTech 公司)的生产成本分布情况[47]

表5 新冠mRNA 疫苗mRNA-1273(莫德纳公司)和BNT162b2(辉瑞/BioNTech 公司)的原材料成本分布情况[47]
mRNA 疫苗生产各关键链点的主要供应商详见表6。从表中可以看出,mRNA 疫苗生产所需原材料和设备等已基本实现国产替代,进步巨大。部分原辅料和耗材由于生产工艺和质量的局限性和稳定性,目前仍难以实现国产替代。尤其是mRNA 合成纯化及后续制剂工艺中的关键耗材,由于色谱填料和中空纤维柱等生产用高值耗材研发周期较长,且涉及材料学、流体动力学、工程力学及精细化工等多学科交叉,尚存在国产化水平较低、产品质量有待提高等情况;基于对检测仪器的高精度要求,大部分检验仪器仍依赖进口。另外,递送系统、核苷酸修饰、帽子结构类似物、LNP 制备设备还存在一些专利问题。因此,为了实现国产mRNA疫苗的国际化,开发具有自主知识产权的国产物料将成为未来我国mRNA 疫苗产业化的重点之一。
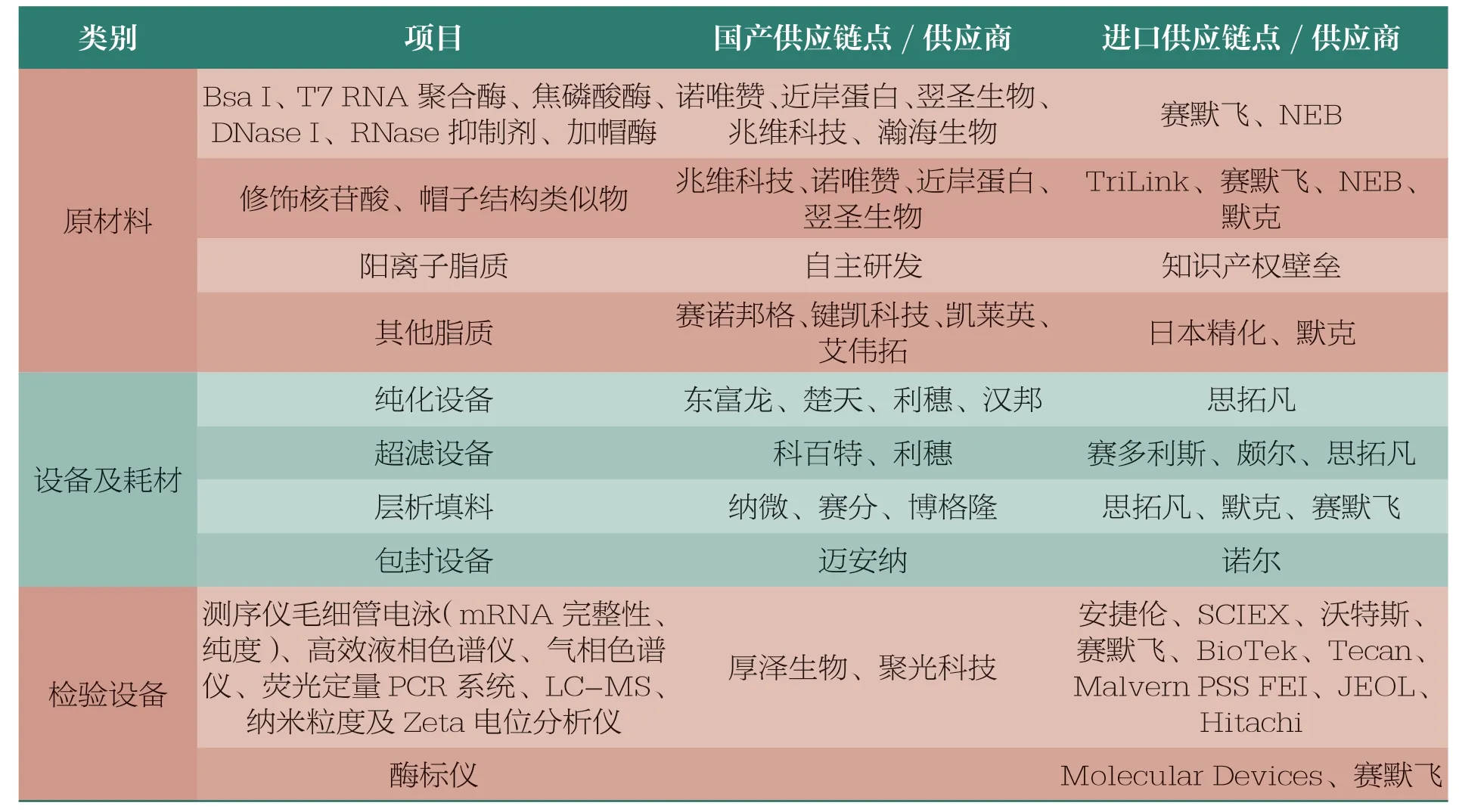
表6 mRNA 疫苗生产各关键链点的主要供应商[47]
许多国内mRNA 疫苗研发企业出于降低供应链风险的考虑,正积极开展关键原材料的国产化替代研究工作,如对限制性内切酶(Bsa Ⅰ)、DNA 核酸酶(DNase Ⅰ)开展了全面的质量标准和工艺对比研究。结果表明,国产物料质量标准在一定程度上比进口物料的质量标准更加完善;对于同一物料,国产供应商和进口供应商来源对产品质量的影响无明显差异。
目前,从mRNA 疫苗物料供应商调研和审计情况来看,大部分原辅料均可实现国产替代。极少部分原辅料的纯度对于LNP结构稳定非常重要,国产物料纯度尚不能满足产品工艺质量需求,仍然采用进口物料。
4 总结与展望
mRNA 疫苗因具有灵活、安全、可调控以及快速开发等特点,成为生物制药领域的一颗冉冉升起的新星。其不仅在抗击COVID-19 大流行中发挥了巨大作用,也将在肿瘤免疫和传染病领域成为应用热点。相关研产管线及供应链也将更加成熟,同时已建成或在建的平台化mRNA 疫苗研产管线将推动mRNA 疫苗产业高速发展。此外,个体化医疗也有望成为mRNA 疫苗研产管线布局的重要方向之一。但需要关注的是,目前mRNA 疫苗生产成本尤其是原材料成本仍较高,降低原材料成本可大大提高疫苗的产品可及性。开发自扩增RNA(saRNA)疫苗以降低mRNA疫苗的剂量要求可能是前景较好的方法之一,另外也有报道采用类似重组蛋白的方式基于细菌/细胞系统生产mRNA,从而在保证mRNA 疫苗质量的同时有效降低生产成本。目前,mRNA 疫苗的专利壁垒仍较多,为了实现国产mRNA 疫苗的国际化,具有自主知识产权的国产物料的开发力度需要进一步加强。

