甲酸微生物转化研究进展
赵同心,赵磊,2,张延平,李寅
(1 中国科学院微生物生理与代谢工程重点实验室,微生物资源前期开发国家重点实验室,中国科学院微生物研究所,北京 100101;2 中国科学院大学,北京 100049)
二氧化碳(CO2)中的碳是正四价,为最高氧化价态,分子结构十分稳定。CO2的生物固定主要是利用合适的能量和还原力将CO2的碳氧双键打开,使之加成到其他底物上实现四价碳的还原和碳链延长,转化为有机化合物。自然界中的生物固碳过程主要由包含固碳酶的多酶催化体系协调完成,已经发现了6条天然的固碳途径,其中包含9种固碳酶[1]。天然固碳途径固碳效率普遍较低,用于生产目标产品存在诸多问题。随着合成生物学的发展,效率更高的人工生物固碳途径也被开发出来,如CETCH 循环[2]、人工合成淀粉的ASAP 途径[3]、最简酶促碳固定循环POAP循环[4]等。
CO2接受电子,依次能够还原为甲酸、甲醛、甲醇等一碳化合物。这些一碳化合物同化路径的研发,也为CO2的生物利用提供更多的可能,如利用体外多酶途径将甲醇转化为淀粉[3]。随着电催化技术的发展,CO2生产甲酸技术日益成熟。甲酸的碳原子活化度更高、在水中溶解度更大,因此近年来甲酸生物转化成为了生物固碳研究的热点方向,在甲酸生物转化途径、甲酸途径能量驱动方面取得了较多研究进展,有研究者已经初步实现了大肠杆菌利用甲酸自养生长。本文从以上几个方面总结该研究方向的最新研究进展,分析现有甲酸生物转化的现状、存在问题,并讨论了甲酸生物转化未来努力的方向。
1 甲酸生物转化途径
本文作者前期对6条天然固碳途径的热力学性质、固碳酶特性等进行过系统分析和比较[5]。在6条固碳途径中,每摩尔碳原子被还原降低一个化合价所需的NAD(P)H 均为0.5mol,而所需ATP 的量为0.125~0.7mol,其中最节能的是Wood−Ljungdahl(WL)途径。该途径除可以转化CO2和CO 外,还可以转化甲酸。其中,CO2和CO 生物转化的关键酶为甲酸脱氢酶和一氧化碳脱氢酶/乙酰辅酶A(CODH/ACS)合酶,后者蛋白结构复杂,对氧非常敏感。因此,该途径仅在厌氧菌丙酮丁酸梭菌(Clostridium acetobutylicum)中实现了异源重构,通过13C 标记分析可以检测到微量13C−乙酰辅酶A的生成[6]。WL 途径能将甲酸转化为一碳供体——亚甲基四氢叶酸,随后一碳供体能够通过宿主菌本身的代谢网络或者重构的代谢途径进入中心代谢,从而为生物体利用甲酸提供更多可能。基于WL途径中的甲酸转化模块具有较高普适性的特点,研究人员先后已尝试在大肠杆菌、酵母等常用底盘细胞中将其进行途径重构。
为了便于理解,本文将甲酸生物途径分为上游甲酸同化模块(甲酸→亚甲基四氢叶酸)和下游亚甲基四氢叶酸代谢途径(亚甲基四氢叶酸进一步生物代谢)两部分进行介绍。
1.1 上游甲酸同化模块
如图1所示,甲酸生成亚甲基四氢叶酸的过程是目前甲酸生物利用体系共有的模块。该模块包含的三步反应依次被甲酸四氢叶酸连接酶、甲酰四氢叶酸水合酶和亚甲基四氢叶酸脱氢酶催化。甲基扭杆 菌(Methylobacterium extorquensAM1) 和 梭 菌(Clostridium ljungdahlii)中,这三个酶分别有三个基因编码[7−8];而在其他菌株中后两个酶大多由同一基因编码,如大肠杆菌中存在由folD基因编码的双功能蛋白酶,该蛋白催化的是可逆反应,生理状态下,催化亚甲基四氢叶酸生成甲酰四氢叶酸方向。在大肠杆菌中,为了实现甲酸生成亚甲基四氢叶酸,研究者尝试引入了fhs/ftl、fchA、folD/mtdA三基因编码的途径[9−11]和fhs/ftl、folD两基因编码的途径[12],结果表明三基因编码的途径能较快提供亚甲基四氢叶酸。
1.2 下游亚甲基四氢叶酸代谢途径
目前,利用内源或者重构的亚甲基四氢叶酸下游代谢途径主要有三条(图1中用不同颜色标示):一条是线性途径(图1 中蓝色途径)[9−11],另外两条是循环途径(图1中红色和黄色途径)[12−13]。
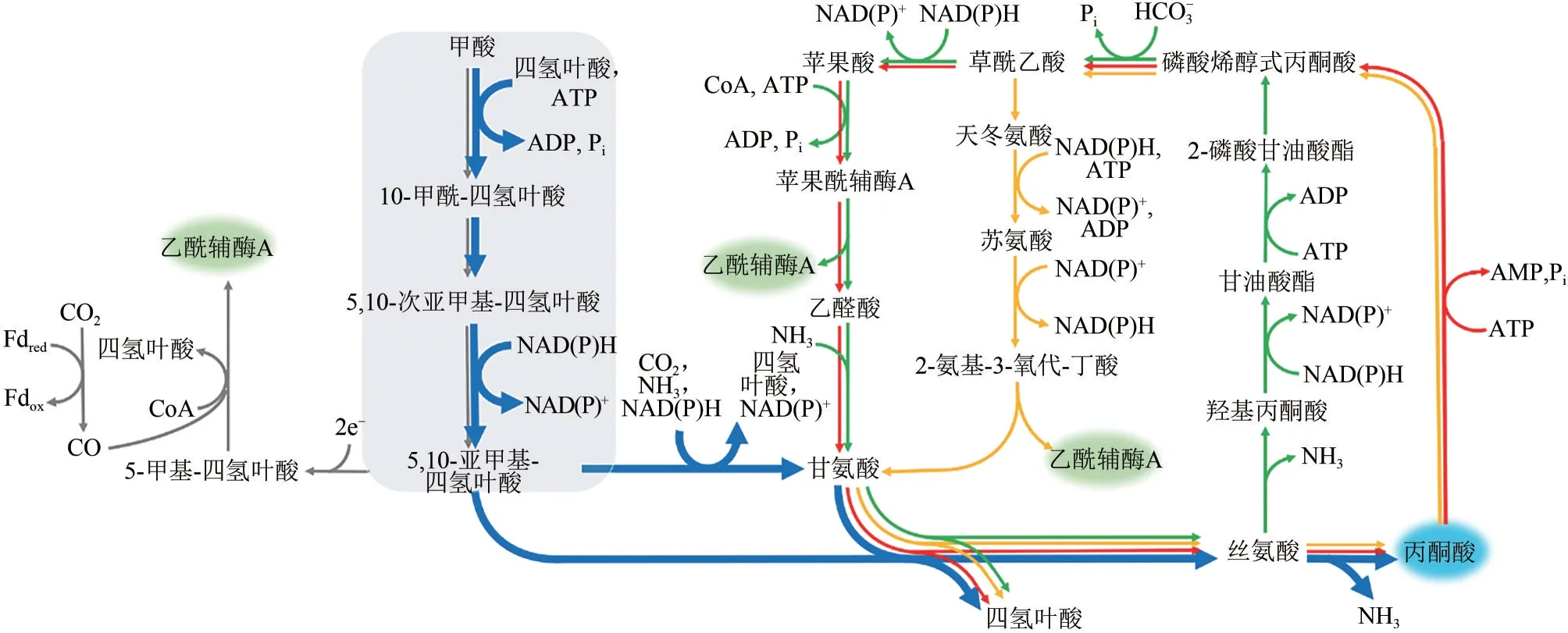
图1 甲酸同化途径
上游甲酸同化模块内中间产物不稳定或缺乏标准品,很难通过测定酶活性的方式筛选相关酶,因此研究人员多采用生长缺陷菌株依赖的生长评价的方式进行表征。研究人员首先构建甘氨酸或丝氨酸生长缺陷菌株,然后导入“甲酸→亚甲基四氢叶酸→甘氨酸/丝氨酸”途径相关基因,通过生长回补的方式来评价甲酸同化进而生成甘氨酸、丝氨酸的能力[9−10]。
下游亚甲基四氢叶酸代谢途径中,“甲酸→亚甲基四氢叶酸→甘氨酸/丝氨酸→丙酮酸”途径已逐步在大肠杆菌构建成功[9−11]。最初,研究人员在大肠杆菌中引入上游甲酸同化模块后,利用菌株自身的甘氨酸切割系统,并不能使甘氨酸生长缺陷的菌株恢复生长;通过过表达大肠杆菌自身的甘氨酸切割系统的基因gcvTHP,在10%CO2情况下,甘氨酸缺陷型菌株的生长得以回补;继而以葡萄糖和13C 标记CO2及甲酸钠为碳源,证实13C 标记CO2及甲酸钠能通过甲酸同化途径合成甘氨酸以满足生长需求[10−11]。利用大肠杆菌体内glyA编码的丝氨酸羟甲基转移酶和丝氨酸脱氨酶,可以依次催化甘氨酸和亚甲基四氢叶酸生成丝氨酸,并进一步生成丙酮酸。通过上述改造,在葡萄糖、甲酸和CO2共培养条件下,甲酸线性途径可以贡献丙酮酸合成代谢流的10%左右[9−10]。
在循环途径中,甲基扭脱杆菌中天然存在“亚甲基四氢叶酸→丝氨酸”循环,但该菌株生长较慢[14]。为了克服其菌株缺点,Liao 课题组[13]结合大肠杆菌的内源代谢途径,构建了改良版丝氨酸循环途径:用“丝氨酸→丙酮酸”途径替代原来的“丝氨酸→2−P−glycerate”途径,解决羟基丙酮酸还原酶底物非特异性问题,乙醛酸和丙氨酸转氨反应替代丝氨酸供给氨基反应,补给充足氨基供体,保证乙醛酸生成甘氨酸反应顺利进行。研究人员通过“甘氨酸→草酰乙酸”“丝氨酸→丙酮酸”两个模块叠加的方式,在大肠杆菌中证实了改良的丝氨酸循环能够工作。
Bar−Even 课题组[12]则探索了“亚甲基四氢叶酸→丝氨酸/苏氨酸”循环途径,通过生长缺陷型菌株和13C 标记的方式,在大肠杆菌内证实该途径能够工作。上述两种循环途径转化甲酸的代谢流情况,目前尚未见报道。
2 甲酸再生NAD(P)H 和甲酸自养菌株构建
由于CO2及甲酸中的碳处于较氧化状态,其固定转化为生物质或丙酮酸等化合物均需要净输入还原力NAD(P)H及能量ATP。目前用于生物固碳的还原力及能量供给研究主要集中在光能、电能或化学能利用。天然自养微生物利用光能驱动的较多,为了提高天然生物光系统的光捕获能力,研究人员缩短蓝藻吸光天线的尺寸,可将太阳光吸收效率提高57%[15]。光能转化为生物能是一个有前景的能量供给方式,吸收光能的光敏材料也引起人们的关注。研究者[16]创建热醋穆尔氏菌−硫化镉(M. thermoacetica−CdS)杂合体系,利用CdS 将光子转化为电子,提供给含有WL途径的热醋穆尔氏菌,利用该电子驱动固碳途径生成乙酸。江南大学研究团队利用自组装CdS 纳米捕光系统,实现光驱动大肠杆菌封存CO2生产有机酸[17]。电子除来自光能之外,也可以直接来自电极,该想法已得到初步证实。乙酸梭菌能够利用从电极上得到的电子,将CO2还原成乙酸和甲烷[18]。目前利用光能和电能提供能量的方式主要集中在天然固碳的宿主菌,在模式生物中提供电子,用于生物固碳还需要很多努力。
在微生物体系中,甲酸是一种常见的电子供体,可以利用甲酸脱氢酶将其分解为CO2和水,同时再生NADH 或者NADPH,从而为生物体提供还原力。目前,已发现来自假丝酵母的甲酸脱氢酶具有较强的NADH 再生活性,因此该甲酸/甲酸脱氢酶的NADH再生系统被广泛应用于科学研究[19]和工业生产[20]。研究者将来自假丝酵母的甲酸脱氢酶进行突变,还得到了可再生NADPH 的突变体[21]。另外,自然界中也存在再生NADPH的甲酸脱氢酶,例如Burkholderia stabilis15516来源的甲酸脱氢酶[22]。
目前,已有很多研究将甲酸/甲酸脱氢酶NAD(P)H再生系统用于生物固碳。一种情况是甲酸只作为电子供体,比如真养产碱杆菌(Ralstonia eutrophaH16),其能够利用甲酸脱氢酶这一功能将甲酸转化为还原力,驱动内生的固碳途径——卡尔文循环[23]。这一思路也被用于大肠杆菌或酵母菌株的改造,在导入固碳途径卡尔文循环(CBB循环)的大肠杆菌[24]和酵母菌[25],利用甲酸/甲酸脱氢酶提供还原力NADH,在有氧的情况下,NADH经氧化磷酸化生成ATP,从而实现甲酸提供固碳途径所需要的还原力和ATP。
另一种情况是甲酸既作为电子供体又作为代谢的碳源。随着甲酸生物转化途径深入研究,研究人员将甲酸再生NAD(P)H 模块和甲酸生物转化途径相结合,尝试构建甲酸自养型的工程菌株。近期,Liao 课题组[9]将甲酸脱氢酶引入到含有甲酸线性转化途径的大肠杆菌中,当葡萄糖耗尽后,通过补加甲酸实现维持菌株的OD值的稳定。随后,该课题组通过加强固碳模块并强化NADH氧化磷酸化生成ATP的效率,以甲酸和CO2为碳源,在发酵罐中培养工程菌株450h,最终获得OD值可由1.02提高到7.38 的菌株[26]。类似地,Bar−Even 课题组[27]将甲酸线性转化途径和甲酸脱氢酶引入大肠杆菌,得到了生长代时为70h的工程菌株,并通过进化工程提高了菌株以甲酸和CO2为碳源进行生长的性能,将代时缩短到7.7h。
3 问题与讨论
甲酸作为生物可利用的碳源和能源,是一种极具潜力的一碳化合物资源。目前甲酸生物转化途径方面,主要以甲酸生成亚甲基四氢叶酸的共有途径为主要切入口,通过线性或循环途径进行生物转化合成Cn(n≥2)化合物。目前虽然用生长缺陷型菌株和13C 标记的方式验证甲酸生物转化途径已打通(表1),但其代谢通量还很低,处于“概念验证”阶段,其技术指标远未达到规模化生物制造的需求。

表1 关于甲酸生物转化的大肠杆菌分子改造研究进展
为了提高甲酸生物转化合成化学品效率,必须加强在该领域的研究部署。一方面需对现有甲酸生物转化途径进行系统研究,找出并突破限速步骤。目前的研究主要依赖营养缺陷菌株偶联生长或者13C 标记的形式来进行路径表征,很少能够测定具体酶活,这就不能确定一个代谢模块内部各个酶催化反应的活性,不能明确具体的限速步骤和分子机制,限制了代谢路径通量的提高。针对这种现状,寻找新方法/技术研究单个关键酶或者某个模块的能力可能成为努力的方向。另一方面,天然甲酸生物转化途径在大多数宿主细胞中非中心代谢途径,所涉及的酶活性有限,需通过大数据挖掘和计算设计分析,构建更加高效的新途径。
除代谢途径本身,本文作者认为充足的能量和还原力供给对驱动甲酸生物转化至关重要。目前的研究发现,当供给充足甲酸和氧气条件下,具有甲酸转化模块和甲酸供给还原力模块的大肠杆菌和酵母工程菌也很难实现菌株生长,说明现有的甲酸转化模块和能量模块匹配性还不够,仍需要更多理性的探索。如Liao课题组改造氧化呼吸链,提高菌株生长,但具体NADH经呼吸链供给ATP能力有待深入研究。已知甲酸能够提供能量,那么在甲酸、CO2自养供给体系中,ATP 生成能力、NADH 及NADPH 之间的供给能力、还原力供给与路径需求之间是否匹配等诸多科学问题亟需解决。
4 结语
二氧化碳的高效减排、捕集和利用,已经成为科研界和产业界共同关注的重大课题。目前已发现6条天然的生物固碳途径,随着二氧化碳化学转化为甲酸技术的日渐成熟,以甲酸为底物的微生物转化成为生物固碳领域的热点研究方向,包括甲酸生物转化途径改造和重构、与之匹配的还原力供给方式以及甲酸自养型菌株构建等方面。近年来微生物利用甲酸的研究较多,但仍存在诸多挑战。针对目前微生物利用甲酸能力有限的现状,找出甲酸固碳路径、能量供给等方面的限速步骤成为新的突破口。

