草甘膦分子印迹电化学电极制备及其性能研究*
练惠琳,李雨欣,周圆圆,田雯欣,许祯毅
(武夷学院茶与食品学院,福建 武夷山 354300)
草甘膦,又称为农达,是一种内吸传导型广谱灭生性除草剂,虽然已被国际癌症研究机构列为“可能对人类有致癌作用”的物质[1],但因其除草效果好、成本低而被广泛使用[2]。目前食品中草甘膦的检测主要是用水进行提取,经阳离子交换柱净化后进行浓缩和衍生化处理,最后采用液相色谱-串联质谱仪或气相色谱-质谱仪进行检测,但由于草甘膦的水溶性极强、易电离且易跟部分金属离子络合[3],导致较难将其从样品中提取出来。
分子印迹技术(molecular imprinted technique,MIT)被形象的认为可以用来制造识别“分子钥匙”的“人工锁”,它具有构效预定性、选择性强和实用性广等特点[4-5],常被用于食品、环境等复杂样品中残量或微量物质的检测。目前为止,以MIT技术与电化学理论相结合,可制备得到具有高度选择性的分子印迹电极,已在敌草隆、绿麦隆、速灭威等农药品种中得到应用[6-8]。
本文以吡咯为功能单体,草甘膦分子为模板,通过电化学聚合,在金电极表面合成草甘膦分子印迹膜,制备得到草甘膦分子印迹电极(工作电极),再以铂电极作为辅助电极,饱和甘汞电极为参比电极组成三电极系统,通过筛选电极制备关键参数和优化最佳实验条件,优化得到快速检测草甘膦残留量的电化学方法。
1 实 验
1.1 试剂与设备
草甘膦(C14050000,0.25 g/支),德国Dr.Ehrenstorfer公司;吡咯(AR)、氧化铝粉末,上海麦克林生化科技有限公司;铁氰化钾(AR)、亚铁氰化钾(AR)、氯化钾(AR),均为国药集团化学试剂有限公司;无水乙醇(AR),西陇科学股份有限公司;0.1 mol/L磷酸盐缓冲溶液(PBS),北京百奥莱博科技有限公司。
CHI660E电化学工作站,上海辰华仪器公司;KQ-30VD0E超声波清洗仪,昆山市超声仪器有限公司;HH-4水浴锅,金坛市鸿科仪器厂;FA1004B分析电子天平,上海佑科仪器仪表有限公司;PHS-3C pH计,上海雷磁有限公司;Milli-Q超纯水系统,法国Millipore公司;金电极、铂片电极、饱和甘汞电极,上海仪电科学仪器股份有限公司。
[Fe(CN)6]3-/4-溶液配制:称取18.638 0 g氯化钾、0.411 5 g铁氰化钾以、0.528 0 g亚铁氰化钾溶于250 mL超纯水中进行混合。
1.2 分子印迹电极的制备
金电极的预处理过程分为物理打磨、化学清洗及电化学清洗顺利进行[9],具体为先将金电极依次用0.3、0.05 μm Al2O3粉抛光,再依次用无水乙醇和去离子水超声清洗3 min,最后将金电极置于0.5 mol/L H2SO4溶液中,以0 V作为起始电位、1.2 V作为终止电位循环伏安扫描50圈进行电化学清洗。
将预处理后的金电极置于总量为5 mL,内含有0.1 mol/L吡咯、0.02 mol/L草甘膦的PBS溶液中,超声5 min,在-1.0~1.0 V范围内,以100 mV·s-1速率循环扫描10圈。然后再将金电极置于0.1 mol·L-1的NaOH溶液中,采用循环伏安法,在-1.2~1.2 V范围内,以相同速率循环扫描30圈,在金电极表现形成过氧化聚吡咯[10],从而将草甘膦从电极上洗脱下来,得到草甘膦分子印迹电极。
1.3 检测方法
将草甘膦分子印迹电极作为工作电极、铂电极为辅助电极,饱和甘汞电极为参比电极组成三电极系统,将电极置于pH值为4的甲酸水溶液中,在-0.2~0.6 V范围内在进行多次循环伏安扫描,直至曲线稳定。然后再将电极浸入含有草甘膦的样品中,富集20 min后取出,用超纯水反复冲洗后,再将电极置入0.01 mol/L[Fe(CN)6]3-/4-溶液中,采用差分脉冲伏安法(DPV)进行电化学检测,检测参数是起始电压为-0.2 V、终止电压为0.6 V、扫描速度为50 mV·s-1。
2 结果与讨论
2.1 电极制备体系的优化
2.1.1 草甘膦与吡咯比例的优化
模板分子与功能单体的比例不同将影响分子印迹电极的的识别性和吸附性能,比例太高和太低时,有效印迹位点数目均较少,不利于目标分子的响应。同时,比例低时复合印迹膜结构变得比较致密,不利于传质[11]。试验通过改变草甘膦与吡咯的摩尔浓度比(1∶1、1∶3、1∶5、1∶7、1∶9)制备得到不同的电极,并分别比较电极对体积为10 mL,浓度为100 ng/mL的草甘膦溶液的吸附响应效果。结果如图1所示,当草甘膦与吡咯的摩尔比为1∶5 时,印迹电极对草甘膦的响应电流变化最大,这说明此时印迹电极形成了最多的有效识别位点,对草甘膦的吸附效果最好。因此,实验选择草甘膦与吡咯的最佳摩尔比为1∶5。

图1 模板分子与功能单体的摩尔比对聚合效果的影响
2.1.2 电极扫描圈数的优化
在电化学反应中,电极扫描圈数直接影响电极的聚合情况,特别是分子印迹电极的制备过程中,改变扫描圈数会影响制备分子印迹电极的膜厚度[12]。将1.2方式实验,分别将扫描圈数设为5、10、15、20、25,从峰电流变化情况考察电极的印迹情况。结果如图2所示,当扫描圈数为5时,草甘膦印迹电极的峰电流响应值较小,这可能是因为扫描圈数少时,通过电极的电量少,使得电极表面形成了很薄的聚合膜[13],使得电极在[Fe(CN)6]3-/4-溶液能够结合的点位少,进而导致峰电流响应值较小。随着扫描圈数增加,分子印迹电极的峰电流也增加,意味着分子印迹电极对草甘膦的吸附响应能力逐渐增强,当扫描圈数为15时,峰电流达到最大值,当继续增加扫描圈数时,峰电流反而呈缓慢递减趋势,这可能是因为随着扫描时间增长,导致分子印迹电极上的聚合膜变厚,阻碍了带电草甘膦分子离子的传递[14],使得峰电流下降。因此本试验选择扫描圈数为15作为制备分子印迹电极的最佳圈数。

图2 电极扫描圈数对聚合效果的影响
2.2 实验条件优化
2.2.1 检测体系pH值的影响
由于草甘膦分子印迹电极只在含草甘膦的甲酸水溶液中检测信号最高[11],而且检测体系的pH值会影响印迹电极的吸附效果,因此本实验分别探究了检测体系的pH值为3.0,4.0,5.0,6.0,7.0时(用10%甲酸调整pH值),分子印迹电极的吸附情况。实验结果如图3所示,当体系的pH值为4.0时,印迹电极对草甘膦的吸附能力最大,随着体系pH值增大,印迹电极对草甘膦的吸附能力减小。这是因为随着溶液pH值的增加,溶液中草甘膦分子更容易带上负电荷,这时带负电荷的草甘膦分子离子容易与过氧化聚吡咯膜上带负电的羰基或羧基产生静电排斥,导致吸附能力减少[15]。因此,实验选择pH=4.0作为检测草甘膦的最佳检验体系。

图3 反应体系pH值对峰电流的影响
2.2.2 吸附时间的影响
采用DPV方法考察了洗脱模板后的分子印迹电极在10 mL 50 ng/mL的草甘膦溶液中,其峰电流随时间的变化情况。结果显示,随着吸附时间的增长,分子印迹电极对草甘膦的吸附量也逐渐增加,当吸附时间达到20 min之后,分子印迹电极的峰电流保持不变。因此,本试验选择20 min作为检测体系的最佳吸附时间。
2.3 方法的线性范围与检出限
采用DPV方法考察制备得到的分子印迹电极吸附不同浓度的草甘膦20 min后的峰电流变化趋势(图4),草甘膦浓度在5~500 ng/mL范围内与峰电流呈较良好的线性关系,线性方程为y=-0.104 3x+80.544 8,r2=0.985,定性检出限(S/N=3)为0.5 ng/mL。
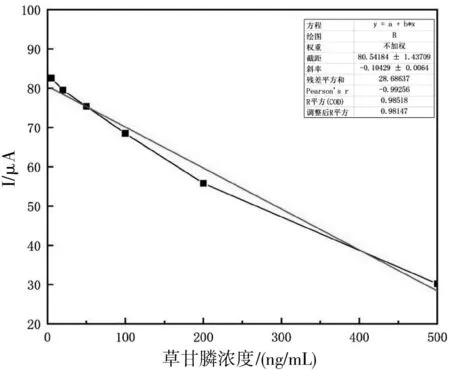
图4 草甘膦标准品的线性方程
2.4 电极的精密度与稳定性研究
为了考察制备的分子印迹电极的重现性和稳定性,试验在相同条件下制备得到5支草甘膦分子印迹电极,将这5支电极分别放置在体积为10 mL、浓度为50 ng/mL的草甘膦溶液中进行测定,测量得到5个电流响应值,计算相对标准偏差(RSD)为2.89%,表明该方法制备的分子印迹电极具有良好的精密度。分子印迹电极经洗脱可重复利用,因此将多次使用后的电极洗脱后置于超纯水中常温保存,分别在7、14、21、28天检测印迹电极的稳定性,如果所示,在第7、14、21、28天时,印迹电极的响应值降至初始响应值的90.4%、87.8%、80.4%、75.7%,总体表明印迹电极的稳定性良好。
3 结 论
本试验以吡咯为功能单体,草甘膦标准物质为模板分子,在金电极表面通过电化学聚合方法形成了聚吡咯多孔印迹膜,制备得到草甘膦分子印迹电极。试验通过筛选电极制备关键参数和优化最佳实验条件,优化得到快速检测草甘膦残留量的电化学方法。该电极制备方法简单,操作方便快捷,对草甘膦分子具有较强重现性,而且稳定性好、检测时间短。在一定的浓度范围内(5~500 ng/mL),草甘膦分子印迹电极的响应值与草甘膦浓度呈良好的线性关系,r2=0.985。根据3倍信噪比要求,计算得到该电极的定性检出限为0.5 ng/mL,该研究可为下一步将草甘膦分子印迹电极用于茶叶中草甘膦残留量的快速检测提供依据。

