miR-143-3p 通过靶向integrin β1 抑制肝癌进展
李丽坤,邸雅南,陈帝,张晶
(北京航天总医院消化内科,北京 100076)
据流行病学调查显示,肝癌是发病率排名前四的癌(每年约748 300 名新增病例),也是世界各地因癌致死排名前三的癌(每年约695 900 名死亡病例)。我国肝癌高发,其患病人数占世界50%以上[1‐2]。目前的研究显示肝癌的发病与乙型肝炎、丙型肝炎、饮酒以及黄曲霉素污染等因素有关[3‐4],但对肿瘤进展的分子机制仍了解甚少。因此迫切需要对肝癌的进展与转移的机制进行研究。
据报道,miRNAs 在癌的发生、进展与预后的调节中发挥着举重轻重的作用[5]。迄今为止,在各种癌症中已鉴定出数以千计的发生表达变化的miR‐NAs,这些miRNAs 中就有很多参与调节癌的进展与预后[5‐6]。miR‐143‐3p 已被发现其在结直肠癌、肺癌和胃癌等癌中发挥肿瘤抑制因子的作用[7‐9]。在肝癌中,miR‐143‐3p 也发现与肝内转移以及不良预后相关,但其对肝癌的具有作用以及潜在的机制仍不完全清楚[10‐11]。近来研究表明,整合素β1(integrin β1)不仅可促进肝癌细胞与基底膜、细胞外基质以及宿主细胞间的黏附,并且其与配体结合进而激活的下游信号进而促进肝癌细胞的增殖、迁移与侵袭[12,13]。在前期实验中,我们通过生物信息学预测miR‐143‐3p 与integrin β1 存在潜在的结合序列。因此,本研究旨在调查miR‐143‐3p 在肝癌进展中的作用,以及其与integrin β1 的内在联系。
材料和方法
1 主要实验试剂
TRNzol Universal总RNA提取试剂、FastKing一步法反转录荧光定量PCR 试剂盒(北京天根生化科技有限公司);miR‐143‐3p 和U6 引物、miR‐143‐3p拟 似 物(miR‐143‐3p mimics;5’‐UGAGAUGAAG‐CACUGUAGCUC‐3’)及其阴性对照(miR‐NC)、pcDNA‐integrin β1 及其阴性对照(pcDNA‐NC)(生工生物工程(上海)股份有限公司);Lipofectamine 3000(美国Invitrogen 公司);XTT 细胞活力检测试剂盒(美国Trevigen 公司);EdU 检测试剂盒、双荧光素酶报告基因检测试剂盒(上海碧云天生物科技有限公司);ECL 化学发光试剂(上海碧云天生物科技有限公司);integrin β1 和GAPDH 兔源抗体、HRP‐羊抗兔二抗(成都正能生物技术有限责任公司);SP 兔免疫组织化学染色试剂盒(北京索莱宝生物科技有限公司)。
2 临床样本收集
收集自2019 年6 月—2022 年6 月在我院行根治性肝叶切除术的25 例肝癌患者(男21 例,女4例;42 ~69 岁,平均年龄(54.7±6.7)岁; T1 期4例、T2 期9 例、T3 期8 例、T4 期4 例;病理分型为肝细胞型),收集肝癌和癌旁组织。患者为首次确诊,未进行过治疗。研究方案通过了本院伦理委员会的批准,且获得了所有患者签写的知情同意书。
3 细胞培养、转染与分组
肝癌细胞株(HepG2、SMMC‐7721、Huh7 和Hep3B)购自北京普非生物科技有限公司,人正常肝细胞株(HHL‐5、HL‐7702、QSG‐7701)购自武汉纯度生物科技有限公司。上述细胞接种在含10%胎牛血清的DMEM 培养基中常规培养。取生长良好的HepG2 和Huh7 细胞,按说明书用Lipofectamine 3000 分 别 将miR‐NC、miR‐143‐3p mimics、miR‐143‐3p mimics+pcDNA‐NC 和miR‐143‐3p mimics+cDNA‐integrin β1 转入细胞,培养48 h 后经过鉴定的细胞分别命名为miR‐NC 组、Mimics组、Mimics+Vec组和Mimics+integrin β1 组。
4 XTT 法检测细胞增殖活力
将各组细胞以104个/孔的密度再次接种于96孔板中,分别常规培养1、2、3 和4 d,按照说明书,每孔加入50 μL XTT 试剂,37 ℃孵育2 h,用酶标仪检测450 nm 波长处光密度值(A),并绘制细胞生长曲线。
5 EdU 法检测细胞增殖
将各组细胞以104个/孔的密度再次接种于96孔板中,按照说明书,每孔加入终浓度为10 μmol/L EdU 溶液,37 ℃孵育2 h,用4%多聚甲醛固定后,再用0.5% Trizol X‐100 通透细胞5 min,加入100 μL按照说明书配置的荧光标记检测反应液室温孵育20 min,用DAPI 染核,用荧光显微镜对每视野下EdU阳性细胞计数。
6 Transwell 法检测细胞迁移与侵袭
将各组细胞以104个/孔的密度(无血清培养基配置的细胞悬液,100 μL)再次接种于Transwell 嵌套小室(包被基质胶的滤膜用于侵袭测定,仅滤膜用于迁移测定),下室孔加600 μL 正常培养基作为诱导剂,培养24 h。用4%多聚甲醛固定嵌套小室滤膜,并用0.2%结晶紫染细胞10 min,显微镜下任选5 个实验对迁至滤膜下表面的细胞计数。
7 RT-qPCR 检测miR-143-3p 表达
按照试剂盒说明,用TRNzol Universal 总RNA提取试剂提取临床组织样本以及培养的细胞的总RNA。将提取的各样本总RNA 模板连同目的基因的引物用FastKing 一步法反转录荧光定量PCR 试剂盒在AFD4800 实时荧光定量PCR 检测系统(杭州安杰思生物科技有限公司)反应。设置程序为:50 ℃ 30 min,95 ℃ 3 min,40 个循环(95 ℃ 15 s,60 ℃ 30 s)。引物序列:miR‐143‐3p 正向5’‐GT‐GAGATGAAGCACTGTAGC‐3’,反向5’‐GTGCAGG‐GTCCGAGGT‐3’;U6正向5’‐CTCGCTTCGGCAGCA‐CA‐3’,反向5’‐AACGCTTCACGAATTTGCGT‐3’。以U6 作为内部对照,用2‐ΔΔCt法计算miR‐143‐3p 的相对表达量。
8 荧光素酶活性分析检测miR-143-3p 与integrin β1 靶向关系
将Targetscan 软件预测的miR‐143‐3p 与integrin β1(基因名为ITGB1PB1)在其3′‐UTR 区的假定结合位点进行碱基突变,并分别将野生型integrin β1 3’UTR 序列片段和突变型序列片段克隆至pGL3‐荧光素酶报告基因的下游。将此俩种荧光素酶活性报告基因载体质粒分别与miR‐143‐3p mimics 或miR‐NC 共转入细胞。48 h 后,通过化学发光荧光仪检测的荧光素酶活性分析二者的靶向关系。
9 Western blot 检测integrin β1 表达
常规法提取临床组织样本和培养的细胞样本中的蛋白。定量样本中的蛋白浓度后,取等量的蛋白进行常规的Western blot 实验转印。封闭膜面上非特异性蛋白后,4 ℃孵育integrin β1(1 ∶2000)和GAPDH(1 ∶8000)抗体过夜;洗膜后,室温孵育HRP‐羊抗兔IgG(1 ∶2000)1 h;洗膜后,ECL 孵育、化学发光成像仪成像并量化各条带光密度值,然后以GAPDH 为内部对照进行归一化处理。
10 integrin β1 免疫组织化学染色
将临床组织样本用4%多聚甲醛固定后,按照常规程序用石蜡包埋,然后将其切为连续的切片(6 μm厚)。切片依次脱蜡、水化和阻断过氧化氢酶后,按照SP 兔免疫组织化学染色试剂盒说明书步骤,行integrin β1 免疫组织化学染色,在显微镜获取染色图像。
11 统计学分析
用SPSS 20.0 软件对数据统计分析,数据表示为均数±标准差(±s)。两组数据间的比较采用t检验,多组数据间比较采用单因素方差分析。P<0.05则认为差异具有统计学意义。
结 果
1 肝癌中miR-143-3p 低表达integrin β1 高表达
qRT‐PCR 检测显示,肝癌组织中miR‐143‐3p 的表达水平明显低于癌旁组织(图1A、B),且随肝癌T 分期增加而逐渐降低(图1B);Western blot 和免疫组织化学检测表明,integrin β1 的表达水平明显高于癌旁组织(图1C、D),并随肝癌T 分期增加而逐渐增高(图1D)。Pearson 相关性分析显示,miR‐143‐3p 与integrin β1 的表达呈现明显的负相关(图1E)。
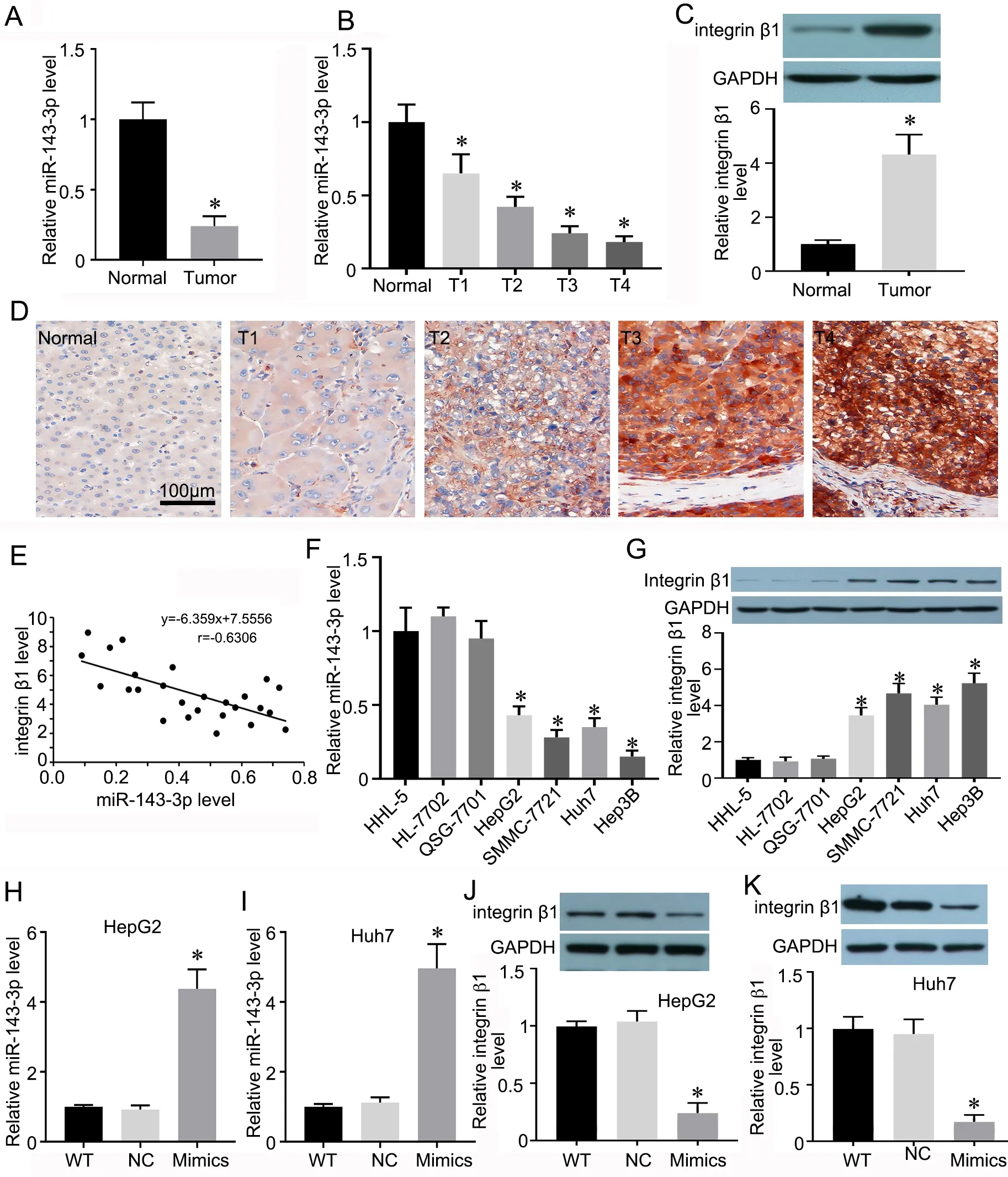
图1 miR‐143‐3p 和integrin β1 在肝癌组织和细胞系中表达水平检测。A,肝癌组织与癌旁正常组织中miR‐143‐3p 表达水平的RT‐qPCR 检测与统计学分析。B,各T 分期肝癌组织中miR‐143‐3p 表达水平的RT‐qPCR 检测与统计学分析;C,肝癌组织与癌旁正常组织中integrin β1 表达水平的Western blot 检测与统计学分析;D,各T 分期肝癌组织中integrin β1 表达的代表性免疫组织化学检测结果;E,肝癌中miR‐143‐3p 与integrin β1 表达水平相关性的Pearson 分析;F,正常肝细胞株(HHL‐5、HL‐7702、QSG‐7701)与肝癌细胞株(HepG2、Hep3B、Huh7 和SMMC‐7721)中miR‐143‐3p 表达水平的RT‐qPCR 检测与统计学分析;G,正常肝细胞株(HHL‐5、HL‐7702、QSG‐7701)与肝癌细胞株(HepG2、Hep3B、Huh7 和SMMC‐7721)中integrin β1 表达水平的Western blot 检测与统计学分析;H 和I,HepG2(H)和Huh7(I)细胞中miR‐143‐3p mimics 转染效果的RT‐qPCR 检测与统计学分析;J 和K,转染miR‐143‐3p mimics 的HepG2(J)和Huh7(K)细胞中integrin β1 表达水平的Western blot 检测与统计学分析。*P<0.05 vs 癌旁正常组织(n=25)或正常肝细胞株(n=4)或对照组(n=4)Fig. 1 Detection of expression levels of miR‐143‐3p and integrin β1 in the tissues and cell lines of liver cancer. A, RT‐qPCR detection and statistical analysis of miR‐143‐3p expression levels in liver cancer tissue and adjacent normal tissue; B, RT‐qPCR detection and statistical analysis of miR‐143‐3p expression levels in liver cancer tissues of different T stages; C, Western blot detection and statistical analysis of integrin β1 expression levels in liver cancer tissue and adjacent normal tissue; D, immunohistochemical examination of integrin β1 expression in liver cancer tissues of different T stages;E, Pearson correlation analysis of miR‐143‐3p and integrin β1 expression levels in liver cancer; F, RT‐qPCR detection and statistical analysis of miR‐143‐3p expression levels in normal liver cell lines (HL‐5, HL‐7702, QSG‐7701) and liver cancer cell lines (HepG2, Hep3B, Huh7 and SMMC‐7721);G, Western blot detection and statistical analysis of integrin β1 expression levels in normal liver cell lines (HL‐5, HL‐7702, QSG‐7701) and liver cancer cell lines (HepG2, Hep3B, Huh7 and SMMC‐7721); H and I, RT‐qPCR detection and statistical analysis of miR‐143‐3p mimics transfection effect in HepG2 (H) and Huh7 (I) cells; J and K, Western blot detection and statistical analysis of integrin β1 expression in HepG2 (J) and Huh7 (K) cells after transfection with miR‐143‐3p mimics.*P<0.001 vs adjacent normal tissue (n=25), normal liver cells (n=4), or control group (n=4)
在培养的肝癌细胞株(HepG2、Hep3B、Huh7和SMMC‐7721)中,miR‐143‐3p 水平均明显低于正常肝细胞株(HHL‐5、HL‐7702、QSG‐7701)(图1F, RT‐qPCR 法),integrin β1 的 表达 水平 明显高于正常肝细胞株(图1G, Western blot 法)。用miR‐143‐3p mimics 转染肝癌细胞HepG2(图1H)和Huh7(图1I)以过表达miR‐143‐3p,Western blot检测integrin β1 表达,与miR‐NC 组比较,过表达miR‐143‐3p 的肝癌细胞HepG2(图1J)和Huh7(图1K)中,integrin β1 表达均显著下调。
2 miR-143-3p 抑制肝癌细胞的增殖、迁移和侵袭
分别应用XTT、EdU 染色和Transwell 法检测过表达miR‐143‐3p 对肝癌细胞增殖、迁移和侵袭的影响显示,与miR‐NC 组比较,过表达miR‐143‐3p 显著抑制肝癌细胞HepG2(图2A)和Huh7(图2B)的增殖活性、EdU 阳性细胞数(图3C‐3F)、迁移(图3A、3B、3D、3E)和侵袭(图3A、3C、3D、3F)。
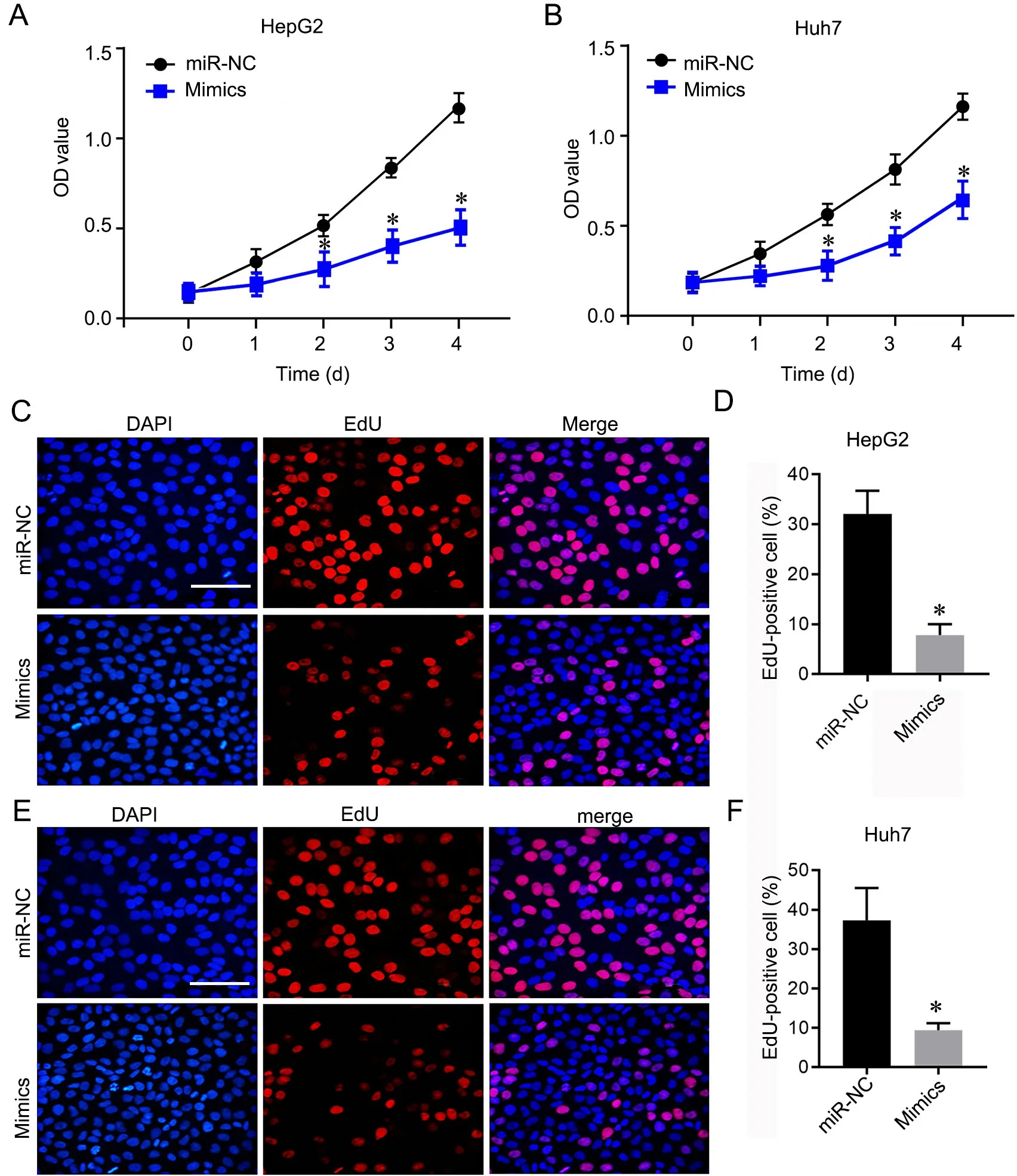
图2 过表达miR‐143‐3p 抑制肝癌细胞增殖。A 和B,转染miR‐143‐3p mimics 的HepG2(A)和Huh7(B)细胞增殖活性的XTT 检测与统计学分析;C 和D,转染miR‐143‐3p mimics 的HepG2 细胞的EdU 代表性染色图像(C)与EdU 阳性细胞比例(D)统计学分析;E 和F,转染miR‐143‐3p mimics 的Huh7 细胞的EdU 代表性染色图像(E)与EdU 阳性细胞比例(F)统计学分析。比例尺,50 µm;*P<0.05 vsmiR‐NC 组,n=4Fig. 2 Over‐expression of miR‐143‐3p inhibited the proliferation of liver cancer cells. A and B, XTT assay and statistical analysis of cell viability of HepG2 (A) and Huh7 (B) cells transfected with miR‐143‐3p mimics; C and D, representative EdU staining images (C) and statistical analysis of the EdU‐positive cells proportion (D) in HepG2 cells overexpressing miR‐143‐3p mimics; E and F, representative EdU staining images (E) and statistical analysis of the EdU‐positive cells proportion (F) in Huh7 cells overexpressing miR‐143‐3p mimics. Scale bar, 50 µm; *P<0.05 vs miR‐NC group; n=4
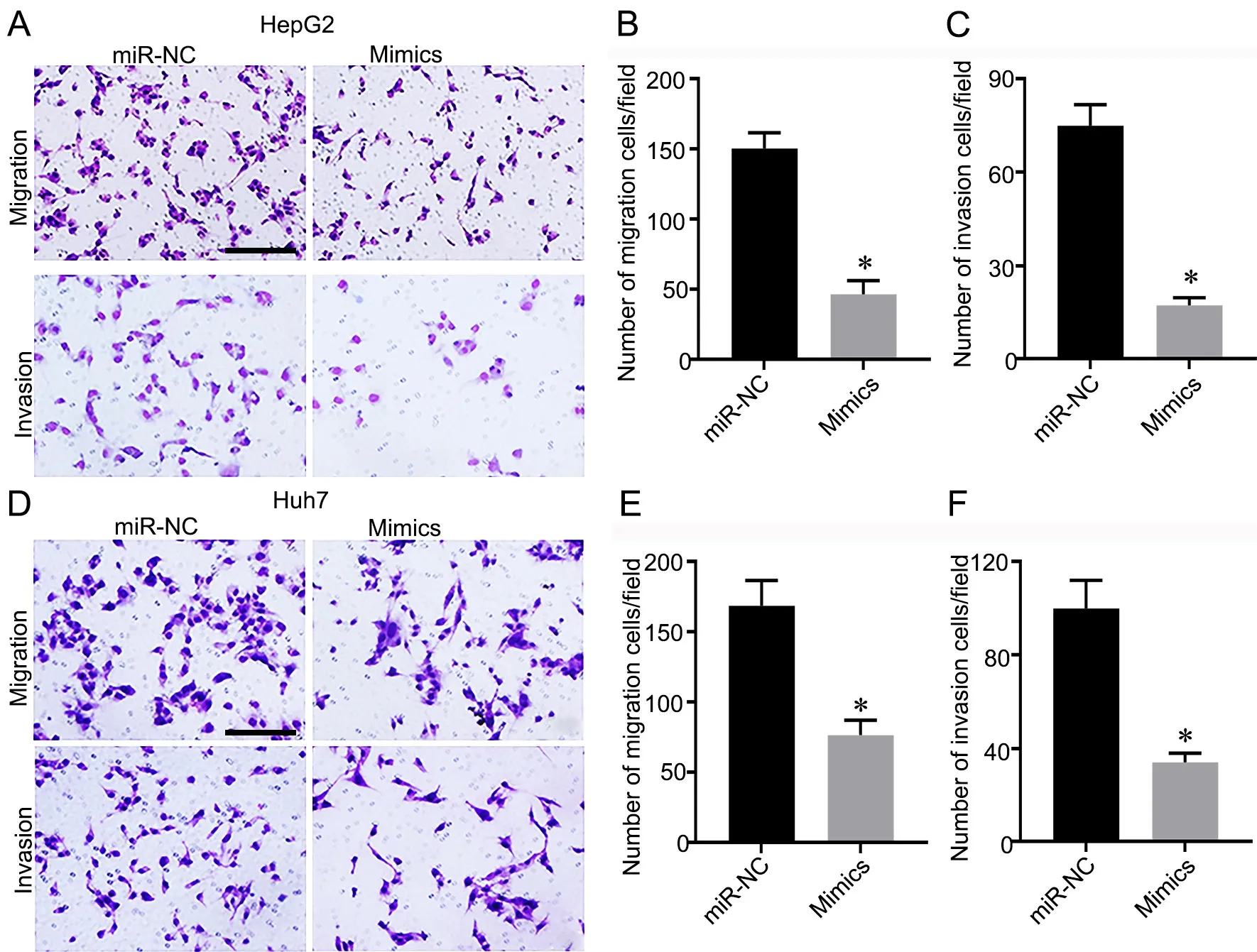
图3 过表达miR‐143‐3p 抑制肝癌细胞迁移与侵袭。A—C,过表达miR‐143‐3p mimics 对HepG2 细胞迁移和侵袭影响的Transwell 法检测(A)和统计学分析(B 和C);D—F,过表达miR‐143‐3p mimics 对Huh7 细胞迁移和侵袭影响的Transwell 法检测(D)和统计学分析(E和F)。比例尺,100 µm;*P<0.05 vsmiR‐NC 组;n=4。Fig 3. Over‐expression of miR‐143‐3p inhibited the migration and invasion in liver cancer cells. A to C, representative Transwell assay (A) and statistical analysis (B and C) for the effect of overexpression of miR‐143‐3p mimics on migration and invasion of HepG2 cells; D to F, representative Transwell assay (D) and statistical analysis (E and F) for the effect of overexpression of miR‐143‐3p mimics on migration and invasion of Huh7 cells. Scale bar,100µm; *P<0.05 vs miR‐NC group; n=4
3 miR-143-3p 靶向integrin β1
TargetScan 软 件 预 测 的miR‐143‐3p 与integrin β1(基因名为ITGB1PB1) 3’‐UTR 区的假定结合位点的碱基互补序列(图4A),以及突变体的碱基序列。双荧光素酶活性分析显示,在与野生型(WT)integrin β1 3’UTR 荧光素酶报告基因载体质粒共转体系中,miR‐mimics 组荧光活性显著低于miR‐NC组;在与突变型(Mut)integrin β1 3’UTR 荧光素酶报告基因载体质粒共转体系中,miR‐mimics 组荧光活性与miR‐NC 组无明显差异(图4B)。
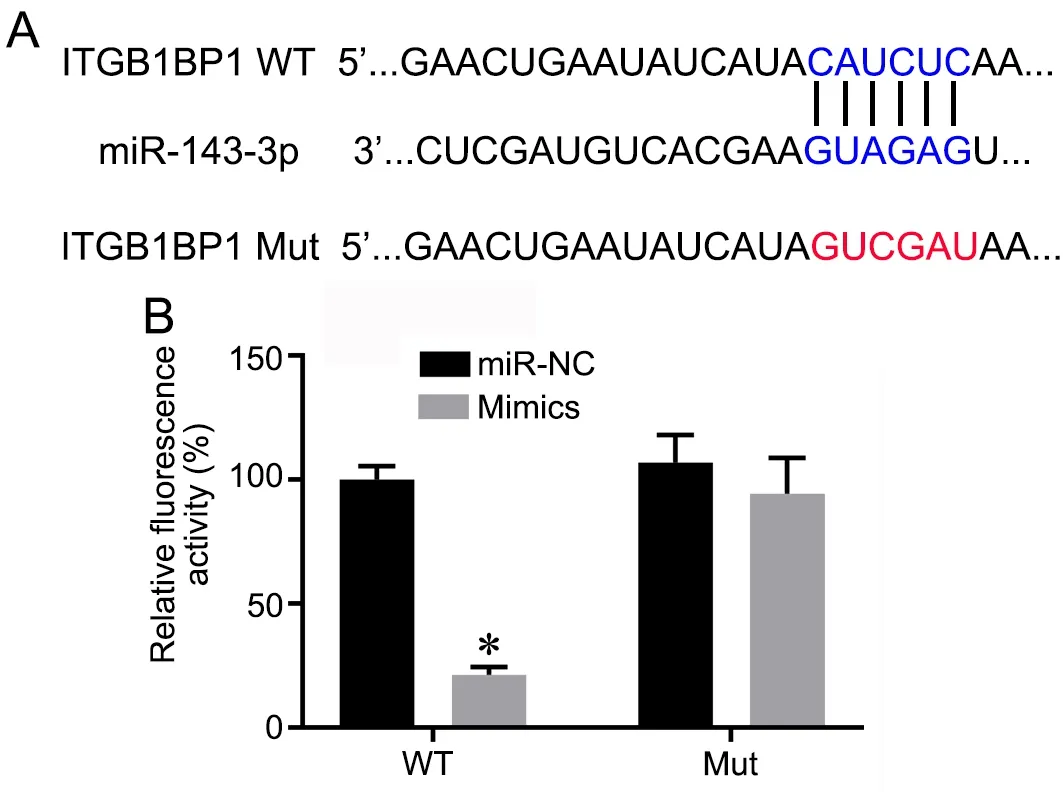
图4 Integrin β1 为miR‐143‐3p 的靶点。A,TargetScan 软件预测的miR‐143‐3p 与integrin β1 ITGB1PB13’‐UTR 区的假定结合位点的碱基互补序列;B,miR‐143‐3p 与integrin β1 靶向关系的双荧光素酶报告基因活性检测与统计学分析。*P<0.05 vsmiR‐NC 组;n=3Fig. 4 Integrin β1 was a target for miR‐143‐3p. A, the base complementary sequences of putative binding sites of miR‐143‐3p and integrin β1 gene ITGB1PB1 3’‐UTR region predicted by TargetScan software; B, detection and statistical analysis of dual luciferase reporter activity in the targeting relationship between miR‐143‐3p and integrin β1. *P<0.05 vsmiR‐NC group; n=3
4 上调integrin β1 逆转miR-143-3p 对肝癌细胞增殖、迁移和侵袭的抑制作用
Western blot 检测Mimics+Vec 组和Mimics+inte‐grin β1组肝癌细胞HepG2和Huh7中integrin β1表达显示:Mimics+integrin β1组中integrin β1表达明显高于Mimics+Vec 组(图5A)。XTT 检测细胞增殖活性结果显示,Mimics+integrin β1组肝癌细胞HepG2(图5B)和Huh7(图5C)的增殖活性较Mimics+Vec 组明显升高。EdU 染色显示,Mimics+integrin β1 组肝癌细胞HepG2(图5D、5E)和Huh7(图5F、5G)的EdU 阳性细胞数同样明显增多。Transwell 法检测2 组细胞迁移和侵袭显示,Mimics+integrin β1 组肝癌细胞HepG2(图6A—6C)和Huh7(图6D—6F)的迁移和侵袭均较Mimics+Vec 组明显升高。
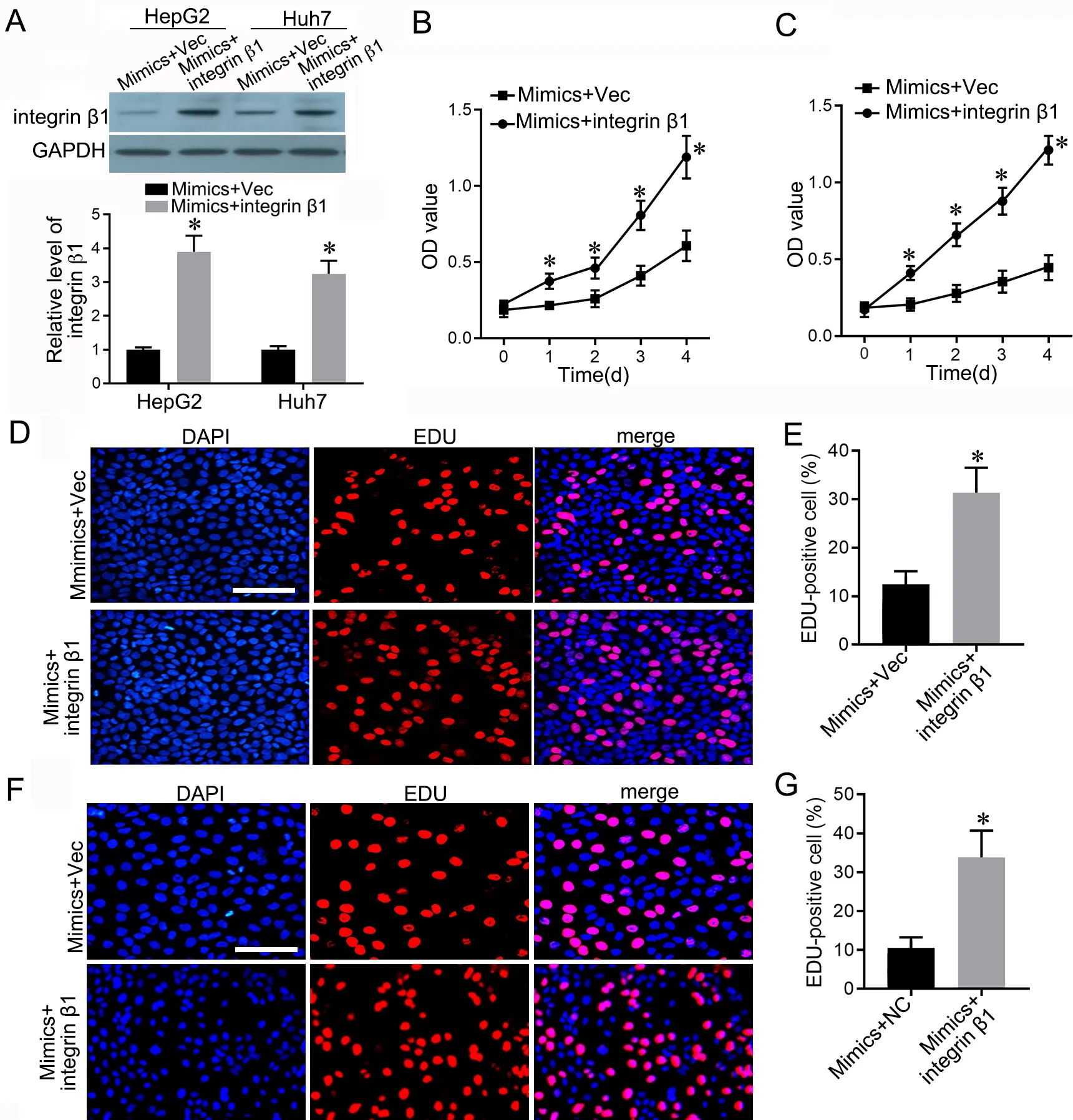
图5 过表达integrin β1 对miR‐143‐3p 抑制肝癌细胞增殖作用的影响。A,共转染miR‐143‐3p mimics 和pcDNA‐integrin β1 的HepG2 和Huh7细胞中integrin β1 表达水平的Western blot 检测与统计学分析;B 和C,共转染miR‐143‐3p mimics 和pcDNA‐integrin β1 的HepG2(B)和Huh7(C)细胞增殖活性的XTT 检测与统计学分析;D 和E,共转染miR‐143‐3p mimics 和pcDNA‐integrin β1 的HepG2 细胞的EdU 代表性染色图像(D)与EdU 阳性细胞比例(E)统计学分析;F 和G,共转染miR‐143‐3p mimics 和pcDNA‐integrin β1 的Huh7 细胞的EdU 代表性染色图像(F)与EdU 阳性细胞比例(G)统计学分析。比例尺,50 µm;*P<0.05 vsmiR‐mimics+NC 组;n=3。Fig. 5 Over‐expression of integrin β1 reversed the inhibitory effects of miR‐143‐3p on proliferation of liver cancer cells. A, Western blot detection and statistical analysis of integrin β1 expression in HepG2 and Huh7 cells after co‐transfection of miR‐143‐3p mimics and pcDNA‐integrin β1; B and C,XTT assay and statistical analysis of cell viability of HepG2 (B) and Huh7 (C) cells with co‐transfection of miR‐143‐3p mimics and pcDNA‐integrin β1;D and E, representative EdU staining images (D) and statistical analysis of the EdU‐positive cells proportion (E) in HepG2 cells with co‐transfection of miR‐143‐3p mimics and pcDNA‐integrin β1; F and G, representative EdU staining images (F) and statistical analysis of the EdU‐positive cells propor‐tion (G) in Huh7 cells with co‐transfection of miR‐143‐3p mimics and pcDNA‐integrin β1. Scale bar, 50 µm; *P<0.05 vs miR‐mimics+NC group; n=3
讨 论
肝癌是一种致命的疾病,其发病率在全球范围内呈较高的增长率[1,2],但目前对肝癌的治疗效果并不能令人满意。因此,需要对肝癌的发生与进展机制进行更深入的研究。
已有大量数据表明miRNAs 是癌的关键调节因子,其可参与调控癌的发生、发展以及预后[5,6,14]。面对庞大的miRNAs 家族成员,人们目前对miRNAs调节癌细胞的分子机制仍所知甚少。miR‐143‐3p 作为重要的抑癌基因调节因子,其可抑制如结直肠癌、肺癌和胃癌等癌细胞的增殖、迁移与侵袭[7‐9]。但miR‐143‐3p 在肝癌中的具有作用以及相关机制并不清楚。我们的研究结果表明miR‐143‐3p 在肝癌中表达下调,且伴随T 分期而降低表达,由此初步提示miR‐143‐3p 可能在肝癌进展中发挥作用。为证明这一观点,本研究首先对比了正常肝细胞株和肝癌细胞株中的miR‐143‐3p 的表达,发现体外培养的肝癌细胞中miR‐143‐3p 表达下调;进一步通过基因转染方式证明过表达miR‐143‐3p 可抑制肝癌细胞增殖、迁移与侵袭。结果表明miR‐143‐3p 在肝癌中可作为抑癌因子发挥作用。
我们进一步对miR‐143‐3p 在肝癌中的抑癌作用机制进行了探讨。miRNAs是通过与靶基因的3’UTR区的碱基序列通过互补配对模式结合来调节基因表达,进而发挥生物学效应[15]。用生物信息学预测发现integrin β1 基因ITGB1PB1是miR‐143‐3p 潜在的靶基因。integrin β1 被发现在多种癌中表达上调,可直接促进癌细胞与基底膜黏附[12‐13]。另外,integrin β1与配体结合可激活的表皮生长因子受体(epidermal growth factor receptor, EGFR)/EGF 信号促进癌细胞增殖[16],也可通过黏附激酶(focal adhesion kinase,FAK)激活下游比如丝裂原活化蛋白激酶(mitogen activated protein kinases, MAPK)[17]、磷脂酰肌醇‐3‐ 激 酶(phosphatidylinositol‐3‐kinase, PI3K)[18]、信号转导和转录激活因子(signal transduction and transcription activator, STAT)[19]等信号进而促进癌细胞的增殖、迁移与侵袭。在肝癌中也发现,integrin β1 表达上调,其和肝内转移相关,且上调integrin β1能促进肝癌细胞增殖与迁移[10‐11]。本研究结果显示integrin β1 在肝癌组织中表达上调,随T 分期而增高,这与前人研究一致。另外,本研究显示,miR‐143‐3p与integrin β1在肝癌中呈负相关,过表达miR‐143‐3p 能抑制integrin β1 表达,而过表达integrin β1能废除miR‐143‐3p 对肝癌细胞增殖、迁移与侵袭的抑制作用,这些结果说明miR‐143‐3p 是通过靶向integrin β1 进而发挥抑制肝癌细胞增殖、迁移与侵袭的作用。
综上,本研究表明,miR‐143‐3p 是肝癌的抑癌因子,其可通过靶向integrin β1 抑制肝癌细胞增殖、迁移与侵袭。

