分子动力学模拟解析脉冲电场对类PSE鸡肉肌球蛋白凝胶特性作用规律
郭雨晨,董铭,曾宪明,田惠鑫,尹家琪,侯钰柯,白云,唐长波,韩敏义,2✉,徐幸莲
1南京农业大学食品科技学院/江苏省肉类生产与加工质量安全控制协同创新中心/农业部肉品加工重点实验室,南京 210095;2温氏食品集团股份有限公司,广东云浮 527400
0 引言
【研究意义】过去几十年来,全球禽肉生产和加工行业进入了快速发展的时代,尤其是鸡肉占家禽市场需求的 90%以上[1],因其营养价值高、价格相对低廉、无宗教文化限制等优点而深受现代消费者的喜爱[2]。鸡肉生产与消费的主要国家和地区包括美国、中国、欧盟等,2021年,中国以1 989.1万t的产量位居世界第二[3]。为了满足鸡肉日益增长的消费需求,禽肉生产者通过基因品种选育和饲养促进鸡肉的生长速率,但也导致了一系列鸡肉品质下降的问题。其中,类PSE(pale, soft and exudative)鸡肉是目前发生率最高的异质肉,由于宰前热应激和宰后环境高温导致宰后糖酵解速率过高,肌原纤维蛋白变性,严重影响蛋白凝胶功能特性以及鸡肉制品的保水性[4]。据调查,巴西和斯里兰卡肉鸡的类PSE发生率分别为41.7%和70%,美国每年由于类PSE肉高发生率造成的经济损失高达2亿美元[5-7]。提高类PSE肉的品质能够有效降低生产中的经济损失,目前研究人员积极开发多种加工方式和技术手段以改善类PSE肉的品质,如添加磷酸盐、胶原蛋白、大豆分离蛋白等非肉成分[2]、酸碱处理[1]、非酶糖基化[8]和超声波处理[9]等,但是添加非肉成分并不是天然肉制品发展趋势,且超声波处理存在处理均一性较差的问题,在工业化应用存在一定的限制;并且目前对类PSE鸡肉肌原纤维蛋白改善作用蛋白质动态变化的过程尚不明确。因此,寻找一种可靠的新型高效、均一的处理技术用于改善类PSE鸡肉蛋白质功能特性,并在分子水平上揭示作用过程中肌球蛋白(肌原纤维蛋白主要成分)的动态变化非常必要。【前人研究进展】脉冲电场(pulsed electric field,PEF)是指在处理室中放置食品物料,处理室两端连有电极,通过较高的电场强度(1—80 kV·cm-1)和脉冲频率(0—1 000 Hz)产生持续的电压脉冲作用于电极,使食品物料在电场作用下发生变化,从而对食品品质进行改善与提高的一种新型非热加工技术[10-11]。与传统热加工相比,PEF表现出处理温度低、处理时间短等许多优点,可以在对食品样品处理的同时有效保留其原有的营养和感官特性[12]。在PEF对蛋白质影响的研究中,XIANG等[13]发现电场强度是决定大豆分离蛋白结构部分修饰的关键因素。金声琅等[14]研究发现35 kV·cm-1的PEF处理能够明显改善猪肉蛋白质凝胶的硬度和弹性;当电场强度继续增大时,猪肉蛋白质凝胶的硬度和弹性又降低。涂宗财等[15]研究表明25 kV·cm-1的PEF处理显著影响β-乳球蛋白的二、三级结构,长时间暴露在PEF中能降低β-乳球蛋白抗原性。这些研究证明了PEF改善肉类蛋白凝胶功能特性的可能性,且在后续对类PSE鸡肉蛋白质特性的研究中,DONG等[16]研究了0—28 kV·cm-1电场强度的脉冲电场对类PSE鸡肉肌原纤维蛋白质功能特性的影响,结果发现随着电场强度的增加,蛋白质的溶解性、表面疏水性和巯基含量均显著提高,在到达 18 kV·cm-1后下降,并影响其二级结构,但蛋白质一级结构并未受到影响。后续研究证实0—18 kV·cm-1的PEF处理提高了类PSE鸡肉肌原纤维蛋白凝胶的强度以及固定化水的比例,同样在电场强度高于18 kV·cm-1时降低[17]。【本研究切入点】目前对PEF处理改善凝胶功能特性过程中类PSE鸡肉蛋白体系的实时动态变化观察的研究尚未见报道。分子动力学模拟(molecular dynamics simulation,MDS)是利用计算机建模模拟分子在设定力场中分子或原子的物理学运动轨迹,提供关于蛋白质构象变化详细信息的一种工具[18],通过收集模拟过程中的构象变化、柔性变化等蛋白质分子信息并进行对比分析,从计算机动态模拟数据和理论试验结果两个角度验证PEF处理改善类PSE鸡肉蛋白的分子作用机制。【拟解决的关键问题】探讨不同脉冲电场强度对类 PSE鸡肉蛋白颗粒分布及凝胶性的影响,并对其进行PEF处理条件下的蛋白体系分子动力学模拟,以探索蛋白构象变化的作用机理,为改善异质禽肉的蛋白功能特性以及拓展PEF技术在食品行业中的应用范围提供理论依据。
1 材料与方法
试验于 2021年在南京农业大学国家肉品质量安全控制工程技术研究中心进行。
1.1 试验材料
每次取50只鸡的类PSE鸡胸肉(无骨、去皮胸大肌),取自江苏益客食品有限公司。原料为平均日龄(44±1.5)d,平均活重(2.02±0.43)kg的白羽肉鸡(标准化笼养AA肉鸡,经过静养、击晕、刺杀放血、净膛、预冷、分割、分拣得到样品)。基于宰后1 h的亮度值(L*)>53和pH<5.7进行初步筛选[9,19],测量位置应避开筋膜和脂肪。将样品放置在含冰泡沫箱中,2 h内运至实验室冷藏保存(0—4℃)。宰后24 h再次测定L*和pH,参考LI[9]的分类标准(L*>53,pH<5.7),确定类 PSE鸡肉样品。为消除样品个体差异性,将可见的结缔组织和脂肪剔除后分割成2 cm×2 cm×2 cm立方体,充分混合。最后,所有肉块装入聚乙烯袋中,为了保证原料的均一性,置于冰箱中冷冻贮藏(-20℃),并于两周内使用完,试验重复3次50只类PSE鸡胸肉肌原纤维蛋白的提取(n=3)。
1.2 主要试剂及仪器
1.2.1 主要试剂 氯化钠、氯化钾、氯化镁、磷酸二氢钾、磷酸氢二钾,南京化学试剂设备有限公司;Triton X-100,北京索莱宝科技有限公司;牛血清白蛋白,西格玛奥德里奇(上海)贸易有限公司;乙二醇双(2-氨基乙醚)四乙酸,阿拉丁试剂有限公司。以上试剂均为分析纯。
1.2.2 主要仪器设备 CR-400色差仪,日本柯尼卡美能达公司;便携式pH计,美国Orion 3-star公司;GM 200绞肉机,德国莱驰公司;Ultra Turrax T25高速匀浆机,德国莱卡公司;Avanti J-E高速冷冻离心机,美国贝克曼库尔特公司;DMC-200高压脉冲电源,大连鼎通科技发展有限公司;M2e多功能酶标仪,美国MD公司;稳定性分析仪,Turbiscan Tower,法国Formulaction公司;TA-XT plus质构仪,英国Stable Micro Systems公司;Physica MCR 301流变仪,奥地利安东帕公司。
1.3 试验方法
1.3.1 肌原纤维蛋白的提取 参考HAN等[20]的方法并稍加改进,环境温度为4℃。称取解冻12 h的类PSE鸡胸肉200 g,用预冷的绞肉机搅碎5次(4 s/次),加入 4倍体积的标准盐溶液(0.1 mol·L-1KCl、20 mmol·L-1K2HPO4/KH2PO4、2 mmol·L-1MgCl2、1 mmol·L-1EGTA,pH 7.0),7 000 r/min冰浴匀浆 30 s,双层纱布过滤,2 000×g离心10 min,重复洗脱3次,且第3次匀浆前加入0.5% Triton X-100溶液。所得沉淀加入4倍体积的0.1 mol·L-1KCl溶液,7 000 r/min冰浴匀浆30 s,双层纱布过滤,2 500×g离心10 min重复洗脱两次。所得沉淀即为类PSE鸡胸肉肌原纤维蛋白。将肌原纤维蛋白溶解于磷酸盐缓冲溶液(0.6 mmol·L-1KCl、20 mmol·L-1K2HPO4/KH2PO4,pH 7.0),使用双缩脲法,以牛血清白蛋白为标准蛋白,测定蛋白浓度。
1.3.2 PEF处理 PEF装置是由DMC-200高压脉冲电源、控制面板和电极板间距2.5 cm的平行式处理室等组成。该设备产生的脉冲波形为方波,电场强度是影响处理工艺有效性的主要因素。目前关于PEF处理对类PSE鸡肉蛋白凝胶功能特性影响相关研究较少,并且受限于仪器最大电场强度为 28 kV·cm-1和处理室容量。为保证本研究的代表性,需要选择较大的电场强度范围,再结合前期DONG等[16]考察电场强度对类PSE鸡胸肉蛋白凝胶特性和构象变化影响的研究基础,处理条件如下:电场强度为8、18和 28 kV·cm-1、频率为 800 Hz、占空比为 47%。PEF处理在 4℃条件下操作,用冰浴的去离子水清洗处理室内壁,将100 mL在1.3.1中提取的类PSE鸡胸肉肌原纤维蛋白小心倒入处理室。处理结束后测量样品溶液的温度,控制温升。处理后的蛋白溶液在 4℃的冷藏条件下保存。每个处理组均进行 3次重复处理。
1.4 不稳定动力学指数(turbiscan stability index,TSI)的测定
为了便于高浓度蛋白体系的颗粒粒径及动态分散稳定性进行比较,使用稳定性分析仪Turbiscan Tower测量。将18 mL未经处理和经不同条件PEF处理的类PSE鸡肉肌原纤维蛋白分别移取至圆柱形扫描玻璃管中,通过波长为880 nm脉冲式近红外光源自上而下每隔110 s扫描一次样品,测定温度为4℃,测定时间为180 min,利用两个同步光学检测器分别监测并采集以0°角度来自光源透过样品的透射光和135°角背散射光强度的数据。所得曲线描绘了后向散射现象的强度随时间的变化,基于曲线斜率评估TSI,TSI值越大,斜率越大,表明样品颗粒聚集程度越高,分散体系越不稳定[21]。测定均重复3次。
1.5 蛋白热诱导凝胶的制备
将未经处理和PEF处理后的类PSE鸡胸肉肌原纤维蛋白样品分别加至10 mL离心管,4℃下200×g离心1 min以去除样品内部气泡。然后置于水浴锅中,以1℃·min-1的升温速度从20℃水浴加热到80℃,并在80℃保温20 min,取出冷却至室温。最后将其置于4℃冰箱中冷藏24 h以完全形成凝胶,然后测量凝胶保水性。
1.6 凝胶保水性(water holding capacity,WHC)的测定
参照BIAN等[8]的方法并稍加改进,分别称取3 g制备的不同处理蛋白凝胶于10 mL离心管中,4℃下10 000×g离心10 min,用吸水纸将离心后蛋白凝胶表面的多余水分擦去,记录离心后凝胶质量。根据如下公式计算凝胶保水性,每组肌原纤维蛋白质样品重复称取并测定3次。
式中,m0:离心管质量(g);m1:离心前凝胶和离心管的质量(g);m2:离心除水后凝胶和离心管的质量(g)。
1.7 流变学特性的测定
参考DONG等[16]的方法并适当修改,使用Physica MCR 301动态流变仪测定未经处理和不同PEF处理后类PSE鸡肉肌原纤维蛋白样品的流变学特性。将45 mg·mL-1经不同电场强度PEF处理和未经处理的蛋白样品均匀涂抹在直径为50 mm的底部平板上,设定上下探测平行板的间距为 1 mm。在测量之前,擦去两平板间的多余样液,并在边缘滴加液体石蜡封锁,以防止加热过程中的水分蒸发。为了诱导凝胶形成,蛋白样品在20℃平衡3 min,然后以2℃·min-1的扫描速率升温至80℃,恒应变和频率分别为1%和0.1 Hz。在整个升温过程中,记录储能模量(G′)和损耗模量(G″),并对样品的流变学行为进行评估。测定均重复3次。
1.8 分子动力学模拟
1.8.1 同源建模 为了保证分子动力学模拟的科学性和准确性,对肌球蛋白的重链亚基(MHC)、碱性轻链亚基(MLC)和调节轻链亚基(RLC)分别进行了同源建模。通过比对结构覆盖率(query covery)以及序列相似程度(sequence identity),在数据库中选择与目标蛋白序列同源性较高的蛋白三维结构作为模板,即心肌肌球蛋白(5TBY):相似程度 80.95%、结构覆盖率99%和蛛肌肌球蛋白(3JBH):相似程度81.01%、结构覆盖率99%,对目标蛋白结构进行多模板同源模建,从而优化目标蛋白的三维结构。
1.8.2 分子动力学模拟过程 以 Gromacs v2018软件对肌球蛋白三维结构模型在水环境体系中进行 30 ns的分子动力学模拟。使用Gromos 53a6力场,水模型为SPC。为了再现PEF处理的环境条件,模拟体系的温度耦合采用“Berendsen thermostat”法,温度保持在4℃,压力耦合采用“Berendsen”方法,参照压力为1.0×105Pa。模拟体系采用标准立方盒包裹模型及其他分子,复合物置于盒子中心。在对模型进行完全自由的动力学模拟之前,先用最陡下降法对该复合物体系优化2 000步,以消除可能的原子碰撞。随后,对溶剂进行分子动力学模拟,时间为100 ps;然后分别限制蛋白主链、CA原子和配体,进行100 ps的模拟;最后,取消限制并优化100 ps,即完成了常规动力学的前处理。体系在y轴方向上增加电场强度为18 kV·cm-1的 PEF诱导条件,同时增加空白模拟组。在所有方向上采用周期性边界条件,模拟步长为2 fs,每1 ps输出一个构象。
1.8.3 轨迹分析 计算蛋白质总体构象变化及分子柔韧性等参数变化,并使用Gromacs工具进行轨迹分析,从而评估优化的PEF诱导条件对目标蛋白的分子作用。
1.9 数据处理
利用SAS 8.2数据分析软件(美国赛仕软件公司)对各指标的试验数据进行单因素方差分析(ANOVA),多重比较采用Duncan’s multiple range test法,差异显著性为P<0.05,并用Origin 8.0(美国Origin Lab公司)软件作图。
2 结果
2.1 蛋白体系分散稳定性
TSI是指通常用于表征蛋白体系分散稳定性的重要参数,基于仪器实时检测的背散射光和透射光信号,可以快速有效地评估不同PEF处理样品之间的稳定性差异[22]。图1为类PSE鸡胸肉蛋白在0、8、18和28 kV·cm-1PEF场强下TSI随时间变化的趋势图。对照组和PEF处理组蛋白溶液的TSI不稳定指数随扫描时间的延长均呈现增加趋势,但其斜率差异较大。但 TSI曲线在34 min时出现了一个转折点,随后对照组样品表现出比PEF处理组更高的TSI值,代表了对照组的蛋白溶液具有最不稳定的分散体系。具体地来说,不同PEF处理组蛋白的TSI曲线均表现出较好的分散稳定性能,其值均小于0.18。然而,随着PEF电场强度的进一步增加,相对于 8 kV·cm-1处理后的样品,18和28 kV·cm-1条件下蛋白体系的TSI曲线又呈现轻微的升高趋势,稳定性略微降低。
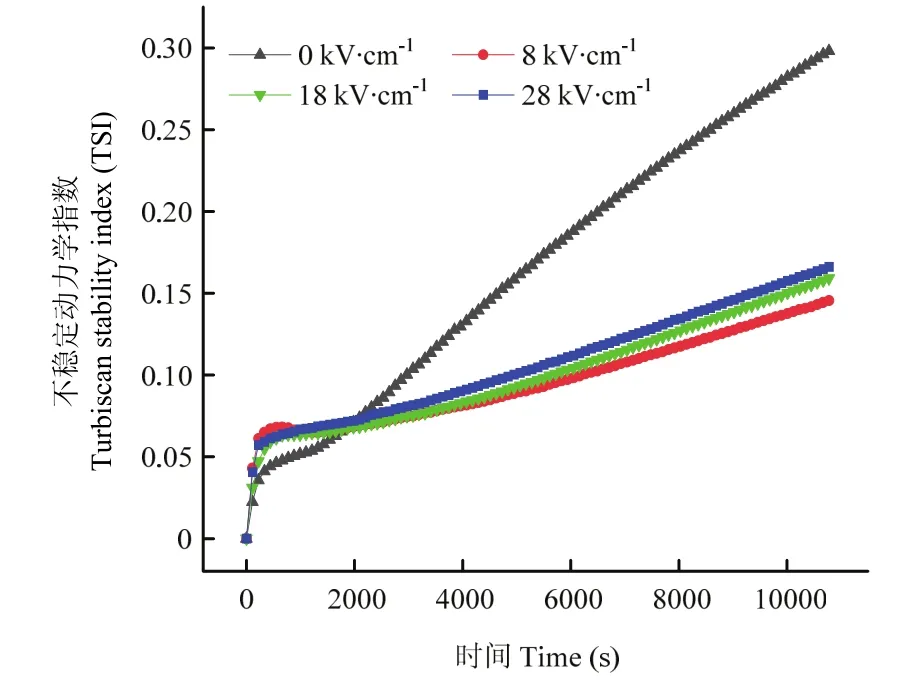
图1 不同PEF处理下类PSE鸡胸肉蛋白溶液的TSI值随时间变化曲线Fig.1 Variation of TSI values as a function of time in PSE-like chicken protein solutions at the different PEF treatments
2.2 凝胶保水性
对照组肌原纤维蛋白凝胶保水性最弱,为76.15%。PEF处理对蛋白凝胶保水性随电场强度增加呈现出不同程度的改善,且所有PEF处理组之间蛋白凝胶保水性无显著性差异。8 kV·cm-1的PEF处理时凝胶保水性为77.82%,并且随着电场强度的增加,蛋白凝胶保水性提高,并在18 kV·cm-1时达到最大值81.42%,此时凝胶保水性显著高于非PEF处理组。然而当电场强度进一步增加至28 kV·cm-1时,蛋白凝胶保水性下降到79%(图2)。

图2 PEF电场强度对类PSE鸡胸肉蛋白凝胶保水性的影响Fig.2 Effects of PEF intensity on the water holding capacity(WHC) of protein gels extracted from PSE-like chicken meat
2.3 流变特性
动态流变学测定有助于揭示PEF作用类PSE鸡胸肉蛋白的热诱导凝胶形成过程[23],其中储能模量(G′)表示蛋白流体黏弹行为中的弹性部分,可以衡量样品的凝胶强度,而损耗模量(G″)表示流体黏性大小[4]。由图 3可知,所有的蛋白样品都呈现出典型的流变学加热曲线,表明其从黏性蛋白流体到弹性凝胶网络的热转变趋势。在加热初期,未经PEF处理和 PEF处理的类 PSE肉样品的 G′变化不大,或略有下降。进一步加热时,G′出现不同程度的急剧增加,并在50℃左右达到峰值,表明此阶段开始形成弹性较弱的蛋白凝胶网状结构,这通常被认为是由肌球蛋白头部相互作用形成聚集所导致的结果[24]。然后,当温度从50℃升高至58℃时,肌球蛋白尾部变性以及流动性增加使初步形成的弱凝胶网络断裂[23],导致G′出现剧烈下降。随后继续加热至80℃,由于非共价键的交互作用增加了蛋白聚集的紧密程度,使G′出现大幅度的上升趋势,这意味着蛋白从黏性溶胶状态向弹性凝胶网络结构的转变。类似的黏弹性变化趋势也出现在高压静电场作用于牛肉肌原纤维蛋白体系中[24]。此外,未经处理和PEF处理的类PSE肉样品的G″变化趋势与G′基本一致,而且G″始终低于G′。
通过动态流变学观察,未经处理和PEF处理的类PSE肉样品在加热过程中的黏弹性变化趋势基本相似,且 G′越大,弹性凝胶形成程度越大。如图 3所示,对照组样品的G′最低,说明经热诱导的类PSE鸡胸肉蛋白凝胶弹性较差。相比于电场强度为8和28 kV·cm-1条件下,18 kV·cm-1的 PEF 处理使类 PSE鸡肉肌原纤维蛋白 G′明显上升,推测 18 kV·cm-1的PEF处理有助于类PSE鸡胸肉蛋白形成更具弹性的凝胶网络。

图3 PEF电场强度对类PSE鸡胸肉蛋白动态流变特性(G′)和(G″)的影响Fig.3 Effects of PEF intensity on the dynamic rheological properties (G′, G″) of proteins extracted from PSE-like chicken meat
2.4 分子动力学模拟
2.4.1 模型质量评估 采用 PROCHECK 对建好的模型结构进行评估,分析其多聚体结构的准确性和立体化学规则,其结果可通过Ramachandran plot进行显示。Ramachandran plot可以阐述蛋白质或肽立体结构中肽键内α碳原子和羰基碳原子间键的旋转度对α碳原子和氮原子间键的旋转度,并指明蛋白质或肽类中氨基酸残基的允许和不允许的构象。
由于 MHC蛋白结构尺寸较大,无法一次完成PROCHECK分析;因此,MHC链段分成两段结构(1—500残基链段及501—974残基链段)可以很好地模拟出MHC的分子变化,并对其进行评价。如图4所示,模型MHC A链1—500残基链段中85.6%的氨基酸位于核心区域,12.2%的氨基酸残基位于允许区域,0.9%的氨基酸残基位于最大允许区域,只有1.3%的氨基酸残基位于扭转角的禁止区域;501—974残基链段中 90.3%的氨基酸位于核心区域,8.6%的氨基酸残基位于允许区域,0.7%的氨基酸残基位于最大允许区域,只有0.5%的氨基酸残基位于扭转角的禁止区域。模型MHC B链1—500残基链段中85.1%的氨基酸位于核心区域,13.5%的氨基酸残基位于允许区域,0.4%的氨基酸残基位于最大允许区域,只有 0.9%的氨基酸残基位于扭转角的禁止区域;501—974残基链段中88.7%的氨基酸位于核心区域,7.4%的氨基酸残基位于允许区域,2.1%的氨基酸残基位于最大允许区域,只有1.9%的氨基酸残基位于扭转角的禁止区域。

图4 MHC A链模型1—500残基(A)、501—974残基(B)、B链模型1—500残基(C)、501—974残基(D)的Ramachandran plotFig.4 Ramachandran plot for the MHC chain A 1-500 residue (A), 501-974 residue (B), the MHC chain B 1-500 residue (C) and 501-974 residue (D)
由此得出蛋白整体符合立体化学能量规则,所构建的蛋白模型准确性较好,质量较高,可进行后续模拟试验。
2.4.2 蛋白总体构象变化 为了深入探究多聚体蛋白体系在30 ns分子动力学模拟过程中的构象相对变化,以初始蛋白结构为参考构象,计算均方根偏差(root mean square deviation,RMSD),以评估不同PEF作用对多聚体蛋白构象运动状况和平衡时刻的影响。RMSD是指蛋白体系中每个原子运动偏移的均值,反映蛋白整体相对于参考结构的构象偏差,是监测模拟体系的平衡过程并判断构象是否稳定的一个重要标准[25],可用以下公式计算[26]:
式中,rfinal(i):第i个构象的均方根偏差,rinitial(i):第i个参照构象的均方根偏差,N:构象数。
由图5-A发现,18 kV·cm-1电场模拟体系中多聚体蛋白复合物的 RMSD值波动相比于对照模拟体系更为剧烈。在7 ns之前的模拟起始阶段,蛋白体系初期的 RMSD值波动显著且均呈现快速直线上升的变化趋势,对照体系波动不太稳定是由于在初始平衡阶段蛋白体系对溶剂作用进行的调整和适应所导致的正常现象。随后,对照体系的RMSD曲线呈曲折上升,变化幅度较为缓慢,15 ns后处于较小波动范围,趋于稳定;而18 kV·cm-1电场模拟体系的RMSD曲线在7—20 ns保持上升,结构偏移程度较大,在15 ns时稍有下降趋势,但整体来看仍在增长,至最后10 ns变化相对平缓,体系RMSD值维持在0.85左右,便于后续分析。上述结果表明,18 kV·cm-1电场作用使模拟体系中蛋白质构象发生较大波动,随着模拟时间的延长,蛋白结构逐渐达到平衡状态,最终蛋白体系结构稳定性稍有下降。
为更加直观地观察模拟过程中电场作用下多聚体蛋白总体构象分布状态的变化情况,每10 ns提取一个分子模型的动力学轨迹进行作图分析。30 ns内电场模拟体系的蛋白三维结构如图5-B所示,观察到多聚体蛋白经分子模拟后有明显结构松散的趋势,即多聚体蛋白的豆芽状结构开始遭受破坏,豆芽秆开始松散和弯折,头部结构域螺旋链发生明显的解折叠(图中黑色圆圈部分)。同时,由于豆芽状头部结构域中大部分螺旋结构转化无规则卷曲结构,分子柔性相对于对照体系变大。其中,多聚体蛋白的MHC链结构在长螺旋链区发生了明显的解螺旋,MHC B链尤为明显,部分螺旋链几乎全解螺旋成为无规则卷曲状态;MLC C链端小螺旋在电场的作用下,大部分发生了解螺旋,Coil发生向内的分子链运动取向;两条RLC链也存在相同的现象,电场作用使RLC分子坍塌,Coil向蛋白结构域方向取向,解螺旋现象更为明显。因此,30 ns的动力学模拟后,在18 kV·cm-1的电场模拟环境中,蛋白分子发生较大涨幅,蛋白空间结构逐渐遭到破坏,变得松散,最终导致蛋白二级结构发生变化。

图5 0 kV·cm-1和18 kV·cm-1电场体系中蛋白骨架原子均方根偏差的变化(A)及18 kV·cm-1电场体系中蛋白三维结构随模拟时间的变化(B)Fig.5 RMSD of the protein backbone atoms in 0 kV·cm-1 and 18 kV·cm-1 electric field systems (A) and three-dimensional structures of proteins versus simulation times in the 18 kV·cm-1 pulsed electric fields (B)
2.4.3 蛋白分子柔性变化 均方根波动(root mean square fluctuation,RMSF)是指模拟体系最终原子位置同平均位置的比值,通过计算多聚体蛋白各个氨基酸残基相对于平均结构的位置偏差来表征蛋白质二级结构的变化程度[27]。在动力学模拟平衡后,对多聚体蛋白复合物中MHC、MLC及RLC每一条单链的RMSF值进一步分析,结果如图6所示。进一步对比有无电场模拟体系下RMSF变化发现,18 kV·cm-1电场模拟体系中蛋白 RMSF值的波动相比于对照体系更为显著,表明18 kV·cm-1电场作用下的多聚体蛋白分子比对照组蛋白表现出更高的柔韧性。
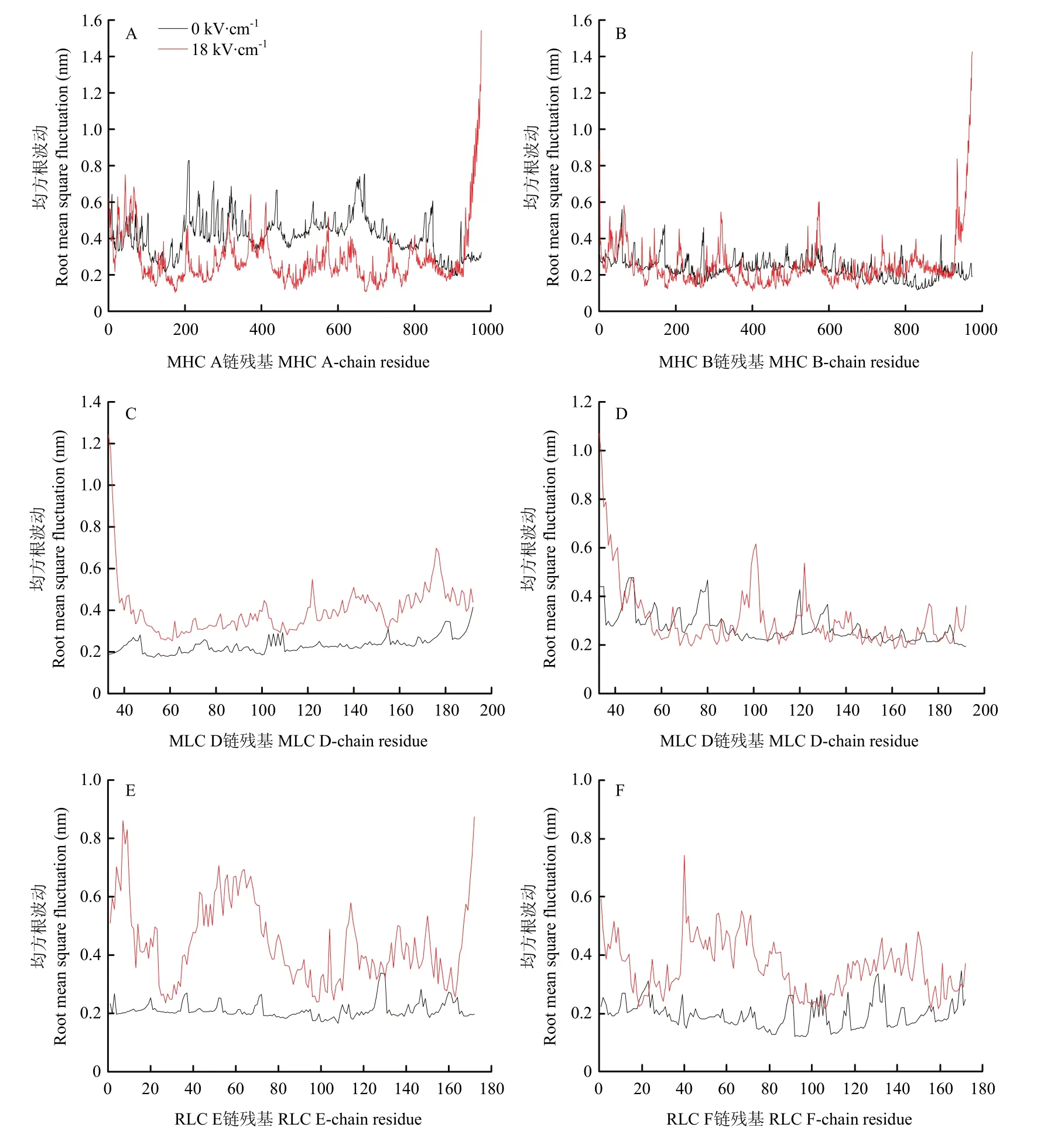
图6 有无电场体系中肌球蛋白多聚体均方根波动的变化Fig.6 RMSF of myosin multimer with and without electric field systems
MHC两条重链在电场作用下其RMSF存在一些差别:MHC A链在电场的作用下比在不加电场的作用下略小,但部分结构RMSF非常大;如残基935—973片段,其最大RMSF高达1.5 nm。这可能是由于其他亚基的空间限制和电场作用,导致其涨幅较小;而豆芽状的长螺旋链发生了解螺旋和弯折,其部分片段波动则较为明显。B链在电场的作用下,由于亚基的空间限制相对较小,其在电场的作用下波动比没有电场的条件下波动更大。两条相同的蛋白链段表现出的结构动力学行为差异的原因可能是由于A链同时受到MHC B、MLC C、RLC E链的空间限制所致。相比于对照模拟体系,MLC的C链在电场作用下发生了较大程度上的波动,且D链整体残基波动在有电场作用下更为明显,特别是端部Coil区。此外,与MHC链和MLC链相比,RLC两条链在18 kV·cm-1模拟体系条件下的RMSF值波动显著高于对照组。
3 讨论
3.1 脉冲电场影响肌球蛋白二级结构
本研究模拟了类 PSE鸡肉肌球蛋白分子在 18 kV·cm-1电场强度PEF下的结构变化。模拟结果显示,18 kV·cm-1的PEF会修饰原有的肌球蛋白二级结构,使肌球蛋白分子多聚体发生解螺旋和解折叠,大部分α-螺旋转变为无规则卷曲,导致其链段结构发生明显波动,表现为更高的 RMSD值,这可能归因于 PEF对蛋白质二级结构的破坏。ENGLISH等[28]进行的外加电场下溶菌酶分子动力学模拟表现出蛋白质变性及二级结构的显著变化,王丽娟[29]也观察到 25 kV的PEF诱导油菜籽蛋白变性,蛋白多肽链发生了解螺旋,α-螺旋含量显著降低,同时无规则卷曲含量显著升高,这与本研究的模拟结果一致。
而更剧烈的RMSF波动体现在蛋白质分子空间结构被破坏,多肽链的展开使更多的残基暴露,为蛋白质分子与蛋白质分子和其他水分子结合交联提供活性位点,促进新的蛋白聚集体的形成。热诱导凝胶是指蛋白质经加热变性后通过分子间的(非)共价键相互交联,形成的具有包埋水分子的三维网络结构[30],全面了解蛋白热诱导凝胶的功能特性对于能否获得产品品质好以及出品率高的类PSE肉制品至关重要。而凝胶结构的产生就是蛋白质之间适当的交联聚集的过程,因此,推断PEF处理通过影响蛋白质二级结构从而进一步改变类PSE鸡肉蛋白体系分散稳定性和凝胶特性(保水性及流变特性)。
3.2 脉冲电场影响肌球蛋白分子相互作用力
从分子相互作用力上来看,PEF作用影响了肌球蛋白分子之间的氢键、静电相互作用以及蛋白分子与水之间的结合。根据ZHAO等[31]的说法,PEF可以释放能量诱导蛋白质分子内部介电常数发生变化并产生分子极化现象,增强蛋白质分子之间的静电相互作用。PEF引起肌球蛋白展开使更多的残基暴露同样会引起新的氢键生成[17]。二者进一步诱导了类 PSE 鸡肉蛋白质的增溶,这与DONG等[16]观察18 kV·cm-1的PEF处理类PSE鸡肉蛋白溶解性变化结果相同。蛋白质溶解性的提高,促进了其稳定性的增强,这与34 min时PEF处理样品扫描结果显示出更高稳定性的结果一致。保水性是热诱导凝胶最重要的特征之一,反映了蛋白质在加工过程中吸收水分子的能力与蛋白质水合能力的强弱紧密相关[32]。残基的暴露也增强蛋白质与溶剂水的相互作用,同时水分子加速聚合使各个水分子之间的距离缩短变得更为紧密,从而提高蛋白凝胶的保水性能。
另外,保水性的提高还可能与PEF处理减小蛋白分子粒径尺寸有关,使其形成了颗粒较小且均匀的凝胶网状结构。AMIRI等[24]同样发现牛肉蛋白粒径大小与凝胶保水性呈反比关系,并指出减小蛋白颗粒尺寸使其凝胶结构具有良好的保水性。蛋白体系分散稳定性在扫描初期,PEF处理组蛋白体系的TSI值高于对照组即稳定性降低,类似的现象也出现在凝乳酶-山羊奶混合体系中[21],这可能是由于蛋白质分子介电常数的改变加速了蛋白颗粒在溶液中的布朗运动导致的。
据报道,展开的蛋白质分子间的静电吸引以及形成的氢键会发生广泛的分子间相互作用,从而形成更强的蛋白质弹性网络[33],氢键的存在同样会对蛋白质凝胶的黏性升高有促进作用[34]。这也解释了PEF处理后类PSE鸡肉蛋白凝胶相较于未处理样品表现出更高的黏弹性这一现象。
3.3 脉冲电场对肌球蛋白分子构象的影响
从肌球蛋白分子构象的角度来看,模拟中更强的RMSF波动则说明PEF处理诱导肌球蛋白分子极化以及水分子聚合后,打破了维持蛋白空间结构的非共价键和静电相互作用,部分展开的肌球蛋白分子之间相互折叠缠绕,通过空间位阻及蛋白质链内的相互摩擦提高黏度[33],展开后的蛋白质暴露出更多的亲水基团,在凝胶形成时能很好地与水结合,使蛋白质分子溶胀增加摩擦,即黏性的提高[35]。DONG等[16]发现经PEF处理后类PSE鸡肉蛋白表面巯基含量增加,可以推测电场作用下更多蛋白分子中外露的疏水基团可能会改变蛋白分子之间和蛋白质分子与水分子之间的相互作用力,使结构尺寸减小,对形成良好保水性的凝胶质地有一定贡献。ZHANG等[36]也观察到PEF处理后的油菜籽蛋白二级变化所引起的活性巯基和表面疏水性增加等构象的变化导致的保水性提高,这与本研究中模拟和保水性结果一致。
然而,高电场强度(28 kV·cm-1)处理则会对类PSE鸡肉蛋白凝胶水合能力和黏弹性产生负面影响。这可能是由于高电场强度的PEF处理对肌球蛋白去折叠作用增强,分子内部活性基团的过度暴露,破坏不同作用力之间的平衡状态,此时蛋白质-蛋白质之间的相互作用相较于蛋白质-水而言更强[1],高度暴露的巯基也可以通过氧化相邻蛋白质链上的两个半胱氨酸残基形成二硫键,蛋白质进一步聚集产生聚集体[16],使蛋白凝胶网络结构被破坏,导致凝胶网络结构束缚水分的能力下降,黏弹性降低。金声琅等[37]的研究也观察到相似的结果,其探究了PEF预处理对淀粉和猪肉蛋白混合凝胶保水性的影响,结果显示随PEF电场强度的增加,混合凝胶的保水性表现出先高后低的趋势。
4 结论
优化的PEF处理条件能够通过修饰蛋白分子构象发生转变,影响蛋白质与水分子的结合作用以及热诱导凝胶形成,从而有效改善类PSE鸡肉蛋白的凝胶特性。随着电场强度从0增加至28 kV·cm-1,类PSE鸡肉蛋白的凝胶保水性和流变特性(G′、G″)呈现先增大后减小的趋势。其中,18 kV·cm-1的PEF处理表现出更优的凝胶保水性和弹性网络结构,这归因于较小的颗粒尺寸和水的流动性。TSI结果证实,经PEF处理后蛋白粒径变小,且体系分散稳定性优于对照组。而分子动力学模拟结果显示,与对照组相比,优化的PEF条件(18 kV·cm-1)可以改变蛋白原有构象,螺旋结构发生解折叠,造成链段结构的波动,表现出更高的分子柔性。研究结果阐明了PEF技术提高类PSE鸡肉蛋白凝胶特性及构象修饰的机理,并为禽肉加工业解决异质禽肉提供了一种新的解决方法。

