壳寡糖浸种对马铃薯微型薯芽生长和内源激素含量的影响
冶楠,朱艳,赵元寿,朱建宁,门佳伟,陈富,孔德媛,张卫兵,宗元元,李永才
1甘肃农业大学食品科学与工程学院,兰州 730070;2兰州工业研究院食品工业研究室,兰州 730000;3甘肃省药品监督管理局审评认证中心,兰州 730070;4甘肃省农业科学院马铃薯研究所,兰州 730070
0 引言
【研究意义】我国是全球最大的马铃薯生产国,马铃薯作为重要的粮菜兼用农作物,其种植面积和产量分别约占世界的25%和19%[1]。为了提高马铃薯的产量,马铃薯播种前一般进行拌种催芽处理,以提高块茎发芽率、促进芽健壮生长、增加抗逆性,并控制土传病害对种薯的影响[2]。马铃薯生产中常用的拌种剂有化学农药、生物菌剂以及植物生长调节剂等[2-3]。然而,化学农药的不合理使用可导致农药残留和环境污染,生物菌剂也存在广谱性窄、效果不稳定、不易推广的局限性,因此,植物生长调节剂作为拌种剂具有较好的应用前景[1]。目前已有报道,赤霉素GA3、生长素 IAA、油菜素内酯 BR等可作为拌种剂改善植物种子的发芽,穆红梅等[4]报道,GA3和IAA浸种处理可提高多种植物种子的发芽率,促进萌发,调控植物的生长和发育。烯效唑浸种处理西瓜种子,增强西瓜幼苗的生长势,并有效控制西瓜“高脚苗”[5]。然而,植物生长调节剂的使用浓度控制不当易引起植物内源激素水平变化,导致异常苗形态。黄涛等[6]发现,GA和BR浸种处理不当可导致马铃薯内源GA含量升高,使细胞形态细长,苗细弱和疯长,抗逆性降低。棉花播种前,浸种处理不当导致“高脚苗”,幼苗子叶期茎长苗弱,苗生长势差,对低温等逆境胁迫的能力降低,最终影响产量[7]。因此,不合理的浸种处理可引起芽细长、疯长和抗逆能力降低。壳寡糖(chitosan oligosaccharides,COS)又称寡聚氨基葡萄糖,是天然产物壳聚糖降解后形成的聚合度在2—20个氨基葡萄糖的低聚糖,对生态环境无污染[8]。COS具有调节植物免疫及诱导植物抗逆性增强的作用,可用于浸种处理[9]。【前人研究进展】秦燕霞[10]研究发现,100 mg·L-1COS溶液浸种大麦种子,可使大麦发芽率提高12.82%,麦芽中淀粉酶和α-氨基氮的含量也被有效提高,使麦苗生长力增强。孙学花等[11]发现,COS浸种处理提高了小麦种子的萌发和生长能力以及麦苗的抗病能力。COS浸种和叶面喷施处理均可降低 20% PEG干旱胁迫下小麦体内的超氧阴离子和丙二醛含量,从而缓解PEG胁迫对小麦幼苗生长和种子萌发产生的抑制效应[12]。钟碧萍等[13]发现,COS溶液浸种水稻种子,可提高水稻幼苗抗冷能力,在低温下幼苗存活率提高了15.54%。低温胁迫前,‘赤霞珠’葡萄叶片喷施COS溶液,使低温胁迫后叶片中可溶性糖和脯氨酸的含量提高,降低了细胞的渗透势和冰点,增强葡萄叶片耐受低温的能力[14]。康云艳等[15]在菜薹中的研究发现,适宜浓度的COS浸种处理调节菜薹叶片内源IAA、ABA和乙烯的水平,并诱导菜薹获得系统抗性,降低了立枯病的发病率。【本研究切入点】尽管已有COS作为植物免疫生长调节剂,促进植物生长发育并诱导提高植物抗逆性的报道,但是COS处理对马铃薯块茎芽生长发育及内源植物激素的影响尚未有报道。【拟解决的关键问题】本试验通过 COS浸种处理马铃薯微型薯,以芽长和芽直径为指标,筛选有效促进微型薯块茎萌发的COS浓度,并测定该浓度下块茎萌发过程中顶芽分生组织细胞的形态、内源植物激素水平的变化,评价 COS浸种处理对马铃薯块茎芽生长的影响,为马铃薯浸种促芽提供理论依据。
1 材料与方法
试验于 2020年在甘肃农业大学食品科学与工程学院采后生物与技术实验室进行。
1.1 材料
供试‘费乌瑞它’马铃薯脱毒微型薯 (Solanum tuberosumL.cv.Favorita),于2020年9月购自甘肃省一航薯业科技有限公司。从脱毒微型薯种植大棚内采收,晾晒4 h后于24 h内低温运输至冷藏库存放待用,贮藏温度(4±1)℃、相对湿度(80±5)%。
供试壳寡糖(脱乙酰度≥90%),AR级,购自上海源叶生物科技有限公司;赤霉素 GA3(Gibberellin acid 3),BR级,纯度大于90.0%,购自索莱宝生物科技有限公司);石蜡(熔点范围:50.0—52.0℃),购自国药集团化学试剂有限公司;番红染液(沙黄)(番红浓度0.5%),购自索莱宝生物科技有限公司;植物内源激素检测用 ELASA试剂盒,购自上海恒远生物有限公司。
1.2 方法
1.2.1 溶液的配制 分别准确称取壳寡糖10、50和200 mg,用少量蒸馏水溶解后定容至1 000 mL,配制为10、50和200 mg·L-1(w/v)浓度的稳定溶液;称取GA3纯品15 mg,用少量蒸馏水溶解后定容至1 000 mL;配制为浓度15 mg·L-1(w/v)的溶液。溶液现用现配。
1.2.2 浸种处理 微型薯采收后置于相对湿度(80±5)%、贮藏温度(4±1)℃条件下黑暗贮藏,待休眠期解除后进行浸种处理[16-17]。选取外观整齐,大小一致,无病虫害,无机械损伤,无发芽的微型薯块茎,用自来水洗涤,并用 0.1%次氯酸钠溶液(v/v)浸泡消毒后,取出晾干。分别用浓度为10、50和200 mg·L-1的壳寡糖溶液浸泡15 min,自然晾干后于黑暗、常温条件下贮藏于湿润滤纸的保鲜盒内,定期测量马铃薯块茎发芽指标并取样。参照李海珀等[18]、郑顺林等[19]的方法并略作修改,以15 mg·L-1赤霉素(GA3)溶液浸泡15 min作为阳性对照,同时以蒸馏水浸泡处理为阴性对照。
1.2.3 生理指标测定
1.2.3.1 芽生长指标 浸种后定点间隔24 h,用游标卡尺测定芽直径、芽长。芽长为块茎最长芽的长度,芽直径为最长芽距块茎芽眼组织2 mm处的直径[20]。每组处理共21个块茎,随机将7个块茎分为1组,共3组,每组测定芽长和芽直径后取平均值,试验重复3次。
1.2.3.2 发芽率 参考王洁等[21]的方法测定处理后7 d内微型薯的发芽率,以块茎至少有一个芽长达 2 mm定义为发芽,重复3次。
根据以下公式计算:
1.2.3.3 发芽势 参考任艳芳等[22]的方法并略作修改,测定处理后微型薯5 d内的发芽势。根据以下公式计算:
1.2.4 内源激素含量测定 参考钟蕾等[23]的方法并修改,将浸种处理后微型薯块茎芽生长定义为4个时期:浸种处理前定义为处理前期(before treatment peroid,BT),微型薯芽长≤2 mm时期定义为萌发前期(before germination stage,BGS),微型薯芽长约2—10 mm定义为萌发期(germination stage,GS),微型薯芽长≥10 mm时期定义为伸长期(vigorous growth period,VG)。分别在4个时期取样,切取块茎顶芽分生组织及芽眼处深度5 mm以内的组织,液氮速冻后置于-80℃冰箱中保存,采用酶联免疫法进行内源激素含量的测定[24]。每个时期每个处理选取 70个大小重量相近((10±2)g)的块茎,随机以10个为1组作为1个生物学重复,共7个重复。
1.2.5 顶芽分生组织细胞形态结构观察 参照王茜茹等[25]的方法,并略作修改,采用常规石蜡切片法,经番红染色,用显微镜观察细胞形态并拍照。
1.2.5.1 包埋切片 切取GS期微型薯块茎幼芽顶端的分生组织(芽尖2—5 mm),浸入70% FAA固定液(5 mL 40%甲醛,5 mL冰醋酸,90 mL 70%乙醇)固定3 d。将固定后的样品分别用70%、80%、90%、100%浓度乙醇梯度脱水,采用无水乙醇及二甲苯透明,至二甲苯完全透明,以除尽乙醇。然后将样品浸蜡包埋,使用轮转式切片机切片(型号:KD-202),厚度约8 μm,将切好的蜡片在37℃左右的温水中展开铺平,用载玻片捞出,置于40℃烘箱中烘干备用。
1.2.5.2 染色观察 将干燥完全的蜡片浸于番红染液中染色2 h,无菌水冲洗3次,洗去染液,于40℃恒温干燥箱中干燥完全,显微镜观察并拍照。
1.2.5.3 分生组织细胞长度和厚度的量化 参照李宝军等[26]的方法,利用IS capture软件对马铃薯微型薯顶芽分生组织石蜡切片的染色结果进行细胞长度和厚度的量化。
1.3 数据分析
以上数据采用 Excel 2016计算平均值和标准误(±SE),采用SPSS 24.0进行Duncan’s显著性分析和Pearson相关性分析(P<0.05),采用Origin 2020绘图。
2 结果
2.1 壳寡糖浸种处理对马铃薯微型薯芽生长的影响
芽长和芽直径是反映植物细胞沿维管束纵向和径向方向生长速度的重要指标。不同浸种处理对马铃薯微型薯块茎的芽长和芽直径影响显著(图1-A—C)(P<0.05)。与阴性对照组(Con)相比,浓度分别为10、50和200 mg·L-1的 COS溶液浸泡处理均可促进马铃薯微型薯块茎的萌发。在BGS期,Con组织块茎芽眼未萌发,而COS处理组和阳性对照GA3处理组的块茎芽眼已启动萌发,以GA3组萌芽最长。浸种6 d后(GS期),微型薯块茎芽均萌发生长至2—10 mm,其中Con处理组芽粗短,GA3处理组芽最长,COS处理组以 50 mg·L-1浓度浸种处理芽生长速度最快。在VG期,COS和GA3浸种处理较Con组芽长增加显著,且 GA3处理芽长增加最显著,壳寡糖浸种处理以COS50处理组芽长最长,且芽较粗壮;不同浓度COS处理组与Con组相比,芽直径粗细无显著差异性,但GA3处理后芽直径显著低于Con及 COS处理,表现为芽细长。说明COS浸种处理有效促进了微型薯块茎芽的萌发及伸长,同时未出现阳性对照组GA3浸种处理后芽细长的现象,且以50 mg·L-1的壳寡糖处理效果较好。
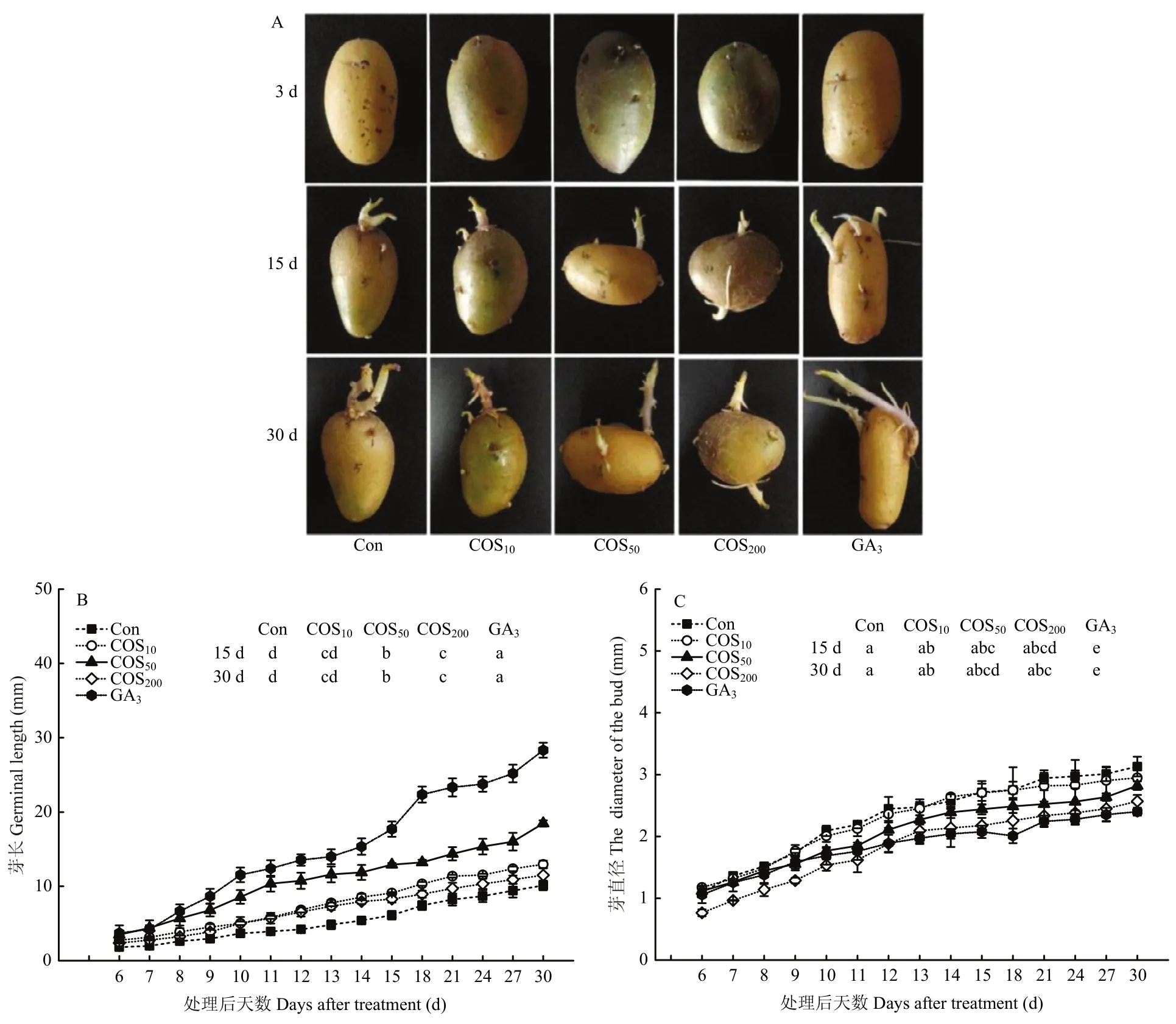
图1 不同浸种处理对芽生长状态的影响Fig.1 Effects of different seed soaking treatments on sprouts growth
2.2 浸种处理对微型薯发芽率及发芽势的影响
发芽率是衡量块茎发芽力的重要指标。不同浸种处理后,马铃薯微型薯块茎发芽率差异显著(图2-A)(P<0.05)。浸种处理第 2—5天,COS50处理微型薯发芽率显著高于GA3组和Con组,COS50处理组在浸种后第5天,所有块茎均发芽,发芽率达到100%,而Con组发芽率为90.0%,GA3组发芽率为95.0%,Con组发芽率最低,且COS处理组块茎芽长相近,出芽整齐。浸种处理第6天后,GA3组发芽率达到100%,Con组发芽率为96.7%。浸种处理第7天后,Con组块茎发芽率才达到 100%。上述结果表明,在浸种处理5 d内,COS50处理显著提高了微型薯的发芽率。
发芽势反映种子发芽的快慢程度,是衡量种子活力的重要参考。如图2-B所示,不同浸种处理后微型薯块茎的发芽势均随发芽时间的增加而提高,且各处理间发芽势差异显著(P<0.05)。浸种处理第5天时,微型薯发芽块茎数达到最大,COS50处理组微型薯发芽势显著高于GA3组和Con组,分别提高了28.6%和80.0%。说明COS50处理显著促进了马铃薯微型薯发芽势的提高,使种子活力增加,块茎出芽早且芽长势一致。

图2 不同浸种处理对微型薯发芽率及发芽势的影响Fig.2 Effects of different seed soaking treatments on the germination rate and energy of minitubers
2.3 浸种处理对微型薯萌发期间顶芽分生组织内源激素含量的影响
由图3可知,不同浸种处理的微型薯顶芽组织中内源激素含量差异明显。与Con组和GA3组相比,COS50处理组可有效控制块茎顶芽分生组织中内源GA以及ABA的稳定水平,调节CTK和IAA在块茎萌发过程中的含量变化,并显著增加内源PA的含量。赤霉素(GA)能促进细胞分裂伸长,从而引起苗增长。由图3-A可以看出,不同浸种处理后,内源GA含量随芽萌发过程呈上升趋势,且各个萌发期GA3处理组的内源GA含量显著高于其他处理组;在VG期,COS50处理组的块茎GA含量显著高于Con组(P<0.05),提高了2.5%,但比GA3组含量显著低2.0%(P<0.05)。上述结果表明,COS50和外源GA3浸种处理均可导致块茎萌发过程中GA含量的显著升高,但COS50处理未引起微型薯块茎芽萌发过程中内源GA浓度的显著激增。细胞分裂素(CTK)可调控植物细胞的分裂与分化,根茎的生长等。由图3-B可知,在浸种处理后微型薯块茎萌芽过程中,CTK含量逐渐升高,在BGS期,3种处理引起的 CTK含量未表现显著差异,在GS期和VG期,GA3浸种处理组CTK水平显著升高,分别高于COS50组7.5%和8.4%;而COS50处理组与Con相比,CTK含量分别提高了4.3%和2.7%。上述结果表明,COS50浸种处理促进了萌发芽组织中内源CTK的产生,但CTK含量的升高水平显著低于GA3处理组。生长素(IAA)具有促进植物细胞分化与伸长、侧根形成、生长发育的作用。由图3-C可看到,在BGS期,Con处理组块茎芽眼组织中IAA含量激增到较高水平后逐渐降低,伴随块茎芽的萌发和伸长COS50和GA3处理组的IAA含量整体呈上升趋势,在VG期,COS50及GA3处理组IAA含量显著高于Con处理组,分别提高了11.4%和17.1%,但COS50处理组芽组织的IAA含量显著低于GA3处理组5.1%,说明COS50浸种处理可调控微型薯芽伸长过程中IAA的含量,稳定内源 IAA的水平。多胺(PA)是生物体内的小分子含氮碱,具有调节植物生长发育、增强抗逆性的作用。从图3-D可以看出,不同浸种处理后块茎萌发过程中,马铃薯顶芽中PA含量总体呈现先上升后降低再升高的趋势,其中,COS50处理后内源PA含量显著增加,分别较GA3处理组与Con处理组提高了2.8%和7.0%,说明COS50浸种处理有利于微型薯块茎中PA的大量积累。脱落酸(ABA)是一种抑制植物生长的激素,具有促进马铃薯块茎形成、芽眼进入休眠状态等作用。由图3-E可知,不同浸种处理下微型薯块茎萌芽组织中 ABA含量整体均呈先下降后上升再下降的趋势。BT期时,微型薯处于休眠状态,ABA含量保持较高的水平。在GS期,COS50处理组块茎中ABA含量显著低于Con组和GA3处理组,分别低4.9%和6.1%。而VG期,COS50处理组与阳性对照组的 ABA含量没有显著差异,但均显著低于 Con组,COS50处理组ABA含量较Con组低3.2%,说明COS50浸种处理后降低了 ABA含量的水平。IAA与GA浓度之和与ABA浓度的比值常表示促生长激素和抑制生长的激素调控生长发育的平衡关系。从图 3-F可知,在萌发前期,不同浸种处理后马铃薯微型薯顶芽分生组织中(IAA+GA)/ABA的值呈现先上升后下降再上升的趋势。BGS期时,COS50处理后(IAA+GA)/ABA的比值显著低于GA3处理及Con处理,COS50处理有利于稳定马铃薯块茎芽萌发前内源促生长激素与抑制生长激素间的浓度平衡;GS期时,各处理中(IAA+GA)/ABA的比值差异性较小,且含量较低,顶芽生长缓慢;VG期时,顶芽生长速度加快,(IAA+GA)/ABA的值再次升高,COS50及GA3处理后(IAA+GA)/ABA的值较Con处理分别提高了1.1%和1.3%,说明COS50处理可平衡马铃薯微型薯在萌发过程中内源促生长激素与抑制生长激素的浓度,从而调控微型薯芽的萌发。
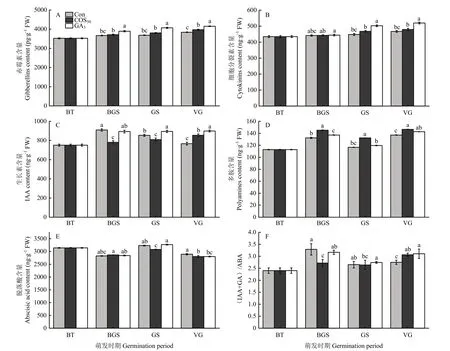
图3 不同浸种处理对微型薯顶芽组织中内源激素含量的影响Fig.3 Effects of different seed soaking treatments on the content of endogenous hormones in the terminal bud tissue of minitubers
2.4 马铃薯块茎顶芽分生组织细胞形态的差异
选择萌发期(GS)微型薯块茎顶芽分生组织进行石蜡切片染色观察。由图4可知,不同浸种处理对块茎顶芽分生组织的细胞形态影响较大。Con处理组顶芽细胞大小均匀,形状规则且排列紧密;COS50处理组的顶芽细胞较Con组细胞膨大较大、排列疏松;而GA3处理组顶芽细胞形态扁平细长。通过 IS capture量化微型薯顶芽分生组织的单细胞长度和厚度,结果表明,GA3处理的细胞长度最长,其次为COS50处理,阴性对照的细胞长度最短(图 5-A)。GA3处理的芽细胞扁长,表现为芽细长疯长;单细胞厚度的表现趋势与细胞长度相反(图 5-B);细胞长度和厚度均表现出显著差异(P<0.05),COS50处理后分生组织单细胞较大,表现为芽粗壮,未出现阳性对照GA3处理的块茎芽细长及疯长现象。
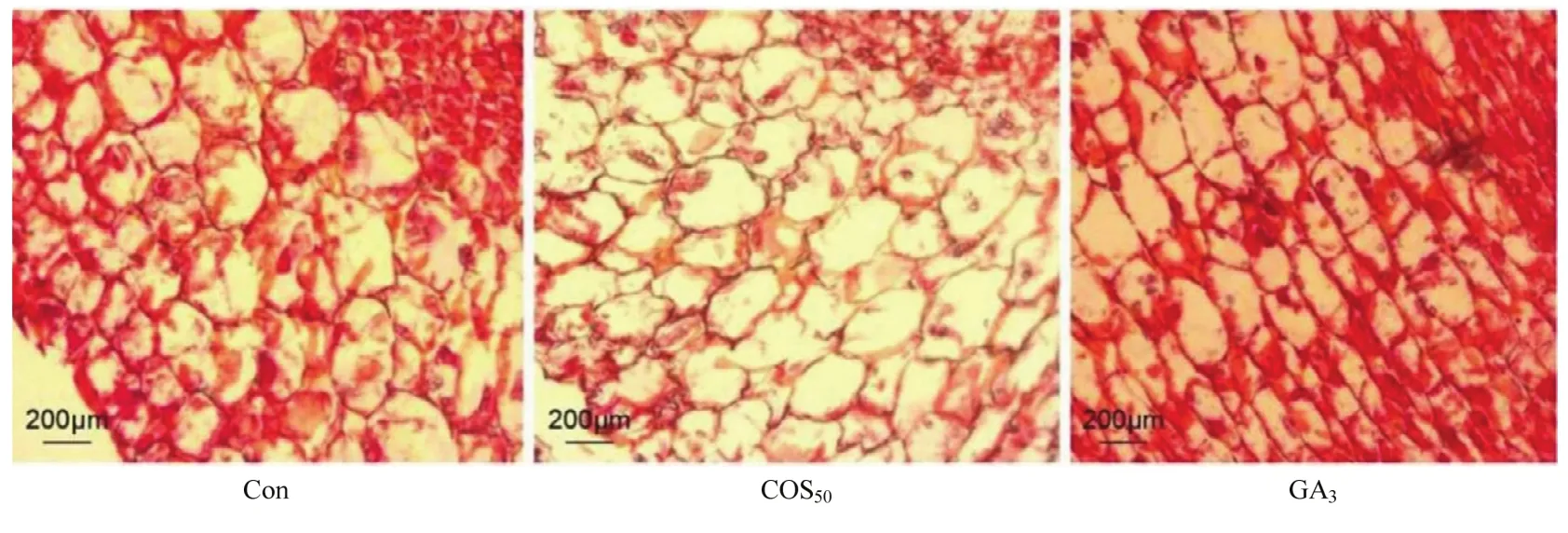
图4 不同浸种处理的微型薯顶芽分生组织细胞形态Fig.4 Sections of potato terminal bud tissue cells under different seed soaking treatments
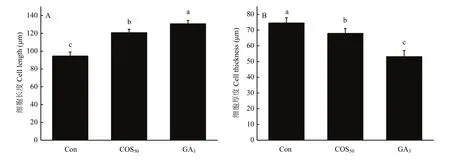
图5 不同浸种处理对马铃薯顶芽分生组织细胞大小的影响Fig.5 Effects of different seed soaking treatments on cell size of potato terminal buds
2.5 壳寡糖浸种处理引起的微型薯萌发与内源激素的相关性分析
表1相关性分析表明,COS50处理后,马铃薯微型薯的芽长与芽直径、发芽势、发芽率以及GA、CTK的含量均呈极显著正相关关系(P<0.01),相关系数分别为0.729、0.911、0.827、0.906、0.935,与PA含量呈显著正相关(r=0.674,P<0.05);同时,芽直径与发芽势呈显著正相关(P<0.05),与发芽率、GA、CTK均呈极显著正相关关系(P<0.01),相关系数分别为0.651、0.577、0.702。而内源激素ABA与PA之间存在较强的负相关性(r=-0.785,P<0.01)。以上结果说明马铃薯微型薯芽的增长、增粗、发芽率以及发芽势的提高与COS50处理诱导促生长激素GA、CTK、PA含量的升高正相关,因此,适当浓度的壳寡糖可以调控内源植物激素,以促进马铃薯微型薯的芽的生长及发芽势和发芽率。
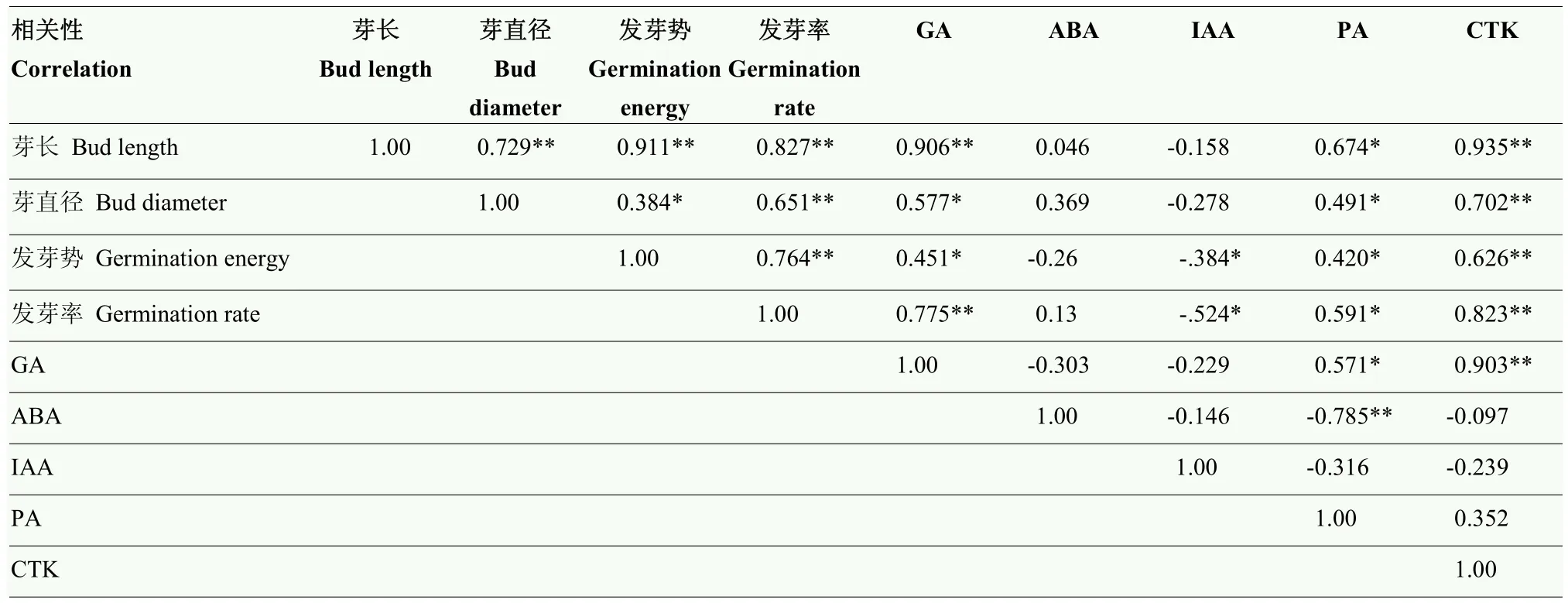
表1 COS50处理引起马铃薯微型薯块茎顶芽生长与内源激素水平变化的相关性分析Table 1 Correlation between terminal bud growth and hormones in potato minitubers under COS50 treatment
3 讨论
3.1 壳寡糖浸种处理影响马铃薯微型薯芽的生长及顶芽分生组织细胞形态
壳寡糖作为植物生长调节剂,可促进植物生长、提高产量、诱导抗逆、以及改善农产品品质等作用[27]。本研究结果也表明,不同浓度的壳寡糖浸种处理可促进‘费乌瑞它’马铃薯微型薯块茎的发芽、芽粗壮,加快芽生长速度,使出芽整齐,以50 mg·L-1浓度的壳寡糖溶液浸种处理效果最佳。这与COS拌种处理后引起亚麻种子、番茄种子及滇油杉种子萌发、生长的趋势相同[28-30]。
值得注意的是,有研究发现赤霉素处理可使具有休眠期的植物休眠期大大缩短,提早发芽,但内源赤霉素浓度过高易引起芽徒长,苗细弱而出现“高脚苗”[31]。本研究结果表明,15 mg·L-1的外源 GA3浸种处理引起了‘费乌瑞它’马铃薯微型薯块茎芽的细长和疯长,与上述研究结果相符。同时,通过石蜡切片染色发现,COS50处理的芽分生组织细胞均匀膨大,未表现GA3处理的芽细胞沿维管束方向纵向拉伸、细胞扁平细长的现象,说明COS50浸种处理可避免植株出现苗细弱的现象。
3.2 壳寡糖浸种处理影响马铃薯微型薯发芽过程中内源植物激素水平
外源植物生长调节剂可引起植株内源激素水平的改变,干扰植物内源激素的稳态平衡,从而达到调控植物生长的目的[32-33]。前人研究认为,马铃薯微型薯在萌芽过程中,促进生长的内源激素(如GA、CTK、IAA等)含量上升,抑制生长的激素(如ABA)含量下降[34],本研究用50 mg·L-1(w/v)的壳寡糖浸种处理可以促进马铃薯块茎发芽过程中 IAA、CTK、GA和PA的产生,促进马铃薯微型薯芽的萌发及生长,与前人研究结果相符。说明适宜浓度的壳寡糖浸种处理具有植物生长调节剂的作用,可调节马铃薯块茎发芽过程中内源植物激素的变化。
ABA作为抑制生长的植物生长调节激素,在马铃薯块茎休眠状态下含量最高,其浓度在块茎浸种处理前含量最高,伴随块茎休眠期的结束,在芽萌发前期,ABA激素水平显著降低,为萌发做准备。这表明在微型薯顶芽生长中,ABA激素水平显著降低,是块茎休眠解除的表现,但在芽萌发期时含量略有上升,这可能是因为 ABA与其他内源激素相互作用的关系,具体还有待进一步研究。
IAA的生理作用具有两重性,高浓度的IAA抑制生长,低浓度的IAA促进生长[35]。而本研究发现,在芽萌发初期,Con组和GA3处理组的内源IAA含量均显著高于COS50处理组,而在微型薯萌发早期,COS50处理可维持IAA含量在较为稳定的低浓度水平,而相关性分析表明COS50处理后的IAA水平也达到了与芽生长指标之间的负相关性,说明微型薯芽萌发过程中内源 IAA的含量达到了抑制芽生长的较高浓度,但COS50处理可调控IAA处于较低浓度稳态水平,调节芽的萌发。
PA是调节植物生长发育的含氮碱,是重要的潜在植物激素,且可增加生长组织的渗透压,从而提高芽的抗逆能力[36]。本研究结果表明,在微型薯芽萌发初期,COS50处理后的PA含量上升到最大,而此时的ABA含量降到了最低水平;芽萌发期时,ABA含量升高,PA含量表现一定程度的下降;而在芽快速伸长期时,ABA含量下降,PA含量显著上升,PA浓度增高刺激芽点细胞生长,且增强芽细胞的抗逆能力。同时,COS50处理后微型薯块茎在发芽过程中内源PA的含量均高于Con和GA3处理组,说明COS50处理有利于诱导增强抗逆性的PA含量显著增高。相关性分析表明,COS50诱导的芽萌发过程中 PA与ABA浓度呈极显著负相关(表1),PA可能与ABA拮抗,调控微型薯芽的萌发及芽细胞的抗逆能力。张灵等[37]报道,PA处理浸泡的种子可以显著提高种子的萌发能力,调节分生组织细胞的渗透压,从而增强幼苗在逆境下的生长能力。刘彦超等[38]也发现,PA处理能改善苹果幼苗的光合性能,促进糖类等有机物质的积累,增加渗透调节物质含量,增强吸水能力,从而提高幼苗的抗旱性;朱大恒等[39]的研究表明,外源施用IAA、GA和CTK均促进多胺的生物合成,这与本研究用COS50的处理引起PA含量增高的结果一致,说明COS处理可通过调节PA的水平来调控芽的生长能力及抗逆能力。一定浓度的赤霉素能促进生长素的合成和细胞分裂膨大,从而提高发芽势和发芽率[19]。在本研究中,15 mg·L-1的赤霉素处理显著提高了CTK及IAA的含量,这与前人研究结果相一致,但是该浓度引起了马铃薯微型薯芽的细长及疯长,这可能与外源 GA3处理引起块茎内源 GA的大量积累有关。
3.3 壳寡糖浸种处理影响马铃薯微型薯发芽过程中促生长激素与抑制生长的激素间平衡
内源激素在植物体内的平衡状况是植物营养生长和生殖生长的基础,通过调节植物激素的平衡状态,可以调控植物的生长与发育。马铃薯块茎萌芽并不是单一激素作用的结果,而是不同类型激素之间处于一种平衡状态时对其协同作用的结果[23],本研究中,不同处理下(IAA+GA)/ABA的值对马铃薯微型薯芽的影响存在差异。在萌发前期,阴性对照及外源GA处理后顶芽(IAA+GA)与ABA的比值较高,这可能与Con处理中高浓度的IAA有关,同时,外源GA也会促进内源GA的合成。由于IAA作为植物激素发挥作用具有浓度效应,推测此时马铃薯微型薯芽的生长势没有 COS50处理生长势好的原因,是由于高浓度的IAA抑制了芽的生长,而适当浓度的COS处理后可抑制IAA的高浓度效应,调控芽的生长状态。说明外源壳寡糖处理可调节马铃薯微型薯发芽过程中促生长激素与抑制生长的激素间平衡,最终调控马铃薯微型薯芽的萌发和生长。
4 结论
壳寡糖处理可提高马铃薯微型薯的发芽率、芽长、芽粗,以50 mg·L-1壳寡糖处理效果较好,可提高块茎芽眼及芽分生组织中CTK、IAA、PA及GA的含量,降低ABA的含量。同时,50 mg·L-1壳寡糖处理后,马铃薯微型薯块茎顶芽分生组织的细胞膨大均匀,未表现出GA3处理后细胞的扁平和细长状态。综上,50 mg·L-1的壳寡糖浸种处理可提高微型薯芽眼及芽分生组织中PA、GA、CTK、IAA含量的提高,促进马铃薯微型薯的发芽,芽长且粗壮,不细长及疯长,增加芽的生长势,降低块茎苗细弱而导致的马铃薯“高脚苗”现象。

