叉头框蛋白C2、淋巴管内皮透明质酸受体-1的表达与皮肤鳞状细胞癌生物学特性的相关性
孙秋悦, 曹宸, 杨细虎, 严志新
皮肤鳞状细胞癌(CSCC)是起源于表皮或附属器角质形成细胞的一类恶性肿瘤, CSCC的发病率在皮肤非黑色素恶性肿瘤中仅次于基底细胞癌, 约占所有皮肤癌的20%, 也是非黑色素皮肤肿瘤致死的首要原因[1-4]。现据统计, 有5%的CSCC可发生转移[5]。CSCC在发生、发展的过程中涉及众多的基因。叉头框蛋白C2(FoxC2)是淋巴管发育的重要蛋白, 在许多恶性肿瘤中均有表达, 但在CSCC中鲜有研究。淋巴管内皮透明质酸受体-1(LYVE-1)是淋巴管内皮细胞特异性标志物, 有研究发现LYVE-1的表达与口腔鳞状细胞癌、宫颈癌、子宫内膜癌的淋巴结转移密切相关[6-8]。但在CSCC淋巴结转移中的作用还没有相关报道, 因此本实验探讨了FoxC2、LYVE-1在CSCC发生、发展、淋巴结转移中可能的作用。本实验采用免疫组织化学S-P法, 应用抗FoxC2单抗对人CSCC中FoxC2抗原进行标记;应用抗LYVE-1单抗对淋巴管内皮细胞进行标记, LYVE-1表达水平用微淋巴管密度(MLVD)表示。半定量分析FoxC2表达情况, 定量分析肿瘤内MLVD, 探讨二者与CSCC生物学特性的关系。
1 资料与方法
1.1 一般资料选择2013年10月至2021年1月在江苏大学附属医院收治的44例原发性CSCC病人。筛选条件:①病人行原发性CSCC肿块切除手术, ②肿瘤原发灶蜡块保存完整, ③临床病理及病例资料完整。44例病人年龄范围为37~97岁。选取2例正常皮肤组织作为对照。本研究病人及近亲属对研究方案签署知情同意书, 符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 免疫组织化学试剂兔抗人FoxC2单抗(即用型)、兔抗人LYVE-1单抗(即用型)均来自Abcam;羊抗鼠/兔IgG聚合物(即用型)来自合肥泉晖医疗器械有限公司, 货号RQT100;DAB显色液由该院病理科提供。
1.3 染色方法采用免疫组织化学染色检测全部标本中FoxC2、LYVE-1水平, 操作如下:组织切片常规脱蜡至水, 在4%福尔马林溶液室温条件下固定24 h, 采用高温高压组织抗原修复, 抗原修复液采用浓度0.1 mol/L的乙二胺四乙酸二钠(EDTA)(pH 8.0), 修复条件为温度121 ℃、修复时间为喷气计时2.5 min, 灭活剂采用3%过氧化氢一抗稀释液采用磷酸缓冲盐溶液, FoxC2与LYVE-1的稀释比例分别为1∶200、1∶10 000, 孵育温度4 ℃, 过夜。二抗羊抗鼠/兔IgG聚合物(即用型), 在室温下孵育20 min, 显色液采用DAB, 显色时间5 min。苏木精复染30 s, 脱水, 中性树脂封片。
1.4 免疫组织化学结果判定观察FoxC2、LYVE-1在CSCC组织中的表达情况及与病理参数(年龄、性别、肿瘤长径、分化程度、淋巴结转移)的关系。LYVE-1采用MLVD表示, MLVD计数方式为[9]:一个淋巴管为棕黄色染色的单个内皮细胞或细胞簇, 先在低倍镜(40倍镜)下观察, 再选择高密度区在高倍镜下(200倍镜)随机选择5个视野内淋巴管进行计数, 记录平均值。FoxC2为细胞核或细胞质染色, 主要为细胞核染色。以同一显微镜倍数(×40)观察全片, 确定肿瘤浸润边缘, 然后选择5个高倍(×400)视野, 取所分析的5个不同视野染色细胞所占百分比及染色强度进行综合评分, 染色强度判分标准:细胞未着色为0分(-)、浅黄色为1分(+)、棕黄色为2分(++)、棕褐色为3分(+++)。阳性细胞所占百分比判分标准[10]:阳性细胞<1%为0分;1%~10%为1分、>10%~30%为2分;>30%~60%为3分;>60%为4分。以染色强度与阳性细胞百分比评分之和作为染色结果的判定, 阴性或低表达:0~3分;高表达:≥4分。0~3分为低表达组, ≥4分为高表达组。
1.5 统计学方法应用SPSS 21.0统计学软件对实验数据进行统计学分析。FoxC2的表达高低与病人临床病理特征的关系采用χ2检验。LYVE-1的表达情况用MLVD表示, MLVD值与病人临床病理特征的关系, 两组样本间比较符合正态分布且方差齐者采用两独立样本t检验, 反之则采用秩和检验。三组样本间比较先进行方差齐性检验, 方差齐且符合正态分布采用单因素方差分析, 反之则采用Kruskal-WallisH检验。FoxC2和LYVE-1的表达的相关性采用Pearson相关性分析。检验标准α=0.05。
2 结果
2.1 FoxC2表达和MLVD值与CSCC临床病理特征的关系2例正常皮肤组织中FoxC2表达阴性。44例CSCC中, FoxC2高表达率为52%(23/44), 有淋巴结转移组其高表达率为(88.88%), 明显高于无淋巴结转移组(42.85%)(P=0.036);中低分化组FoxC2高表达率为(88.88%), 明显高于高分化组(26.92%)(P<0.001);不同年龄、性别、肿瘤长径的CSCC组织中FoxC2表达水平差异无统计学意义(P>0.05)。
CSCC标本经免疫组织化学LYVE-1抗体染色后, 其淋巴管内皮细胞表现为棕黄色, 44例CSCC的MLVD为(9.62±5.07)个, 不同年龄、性别、肿瘤长径的CSCC组织中MLVD值差异无统计学意义(P>0.05), CSCC有淋巴结转移组、中低分化组的MLVD值分别高于无淋巴结转移组、高分化组(P<0.05)。具体情况见表1。
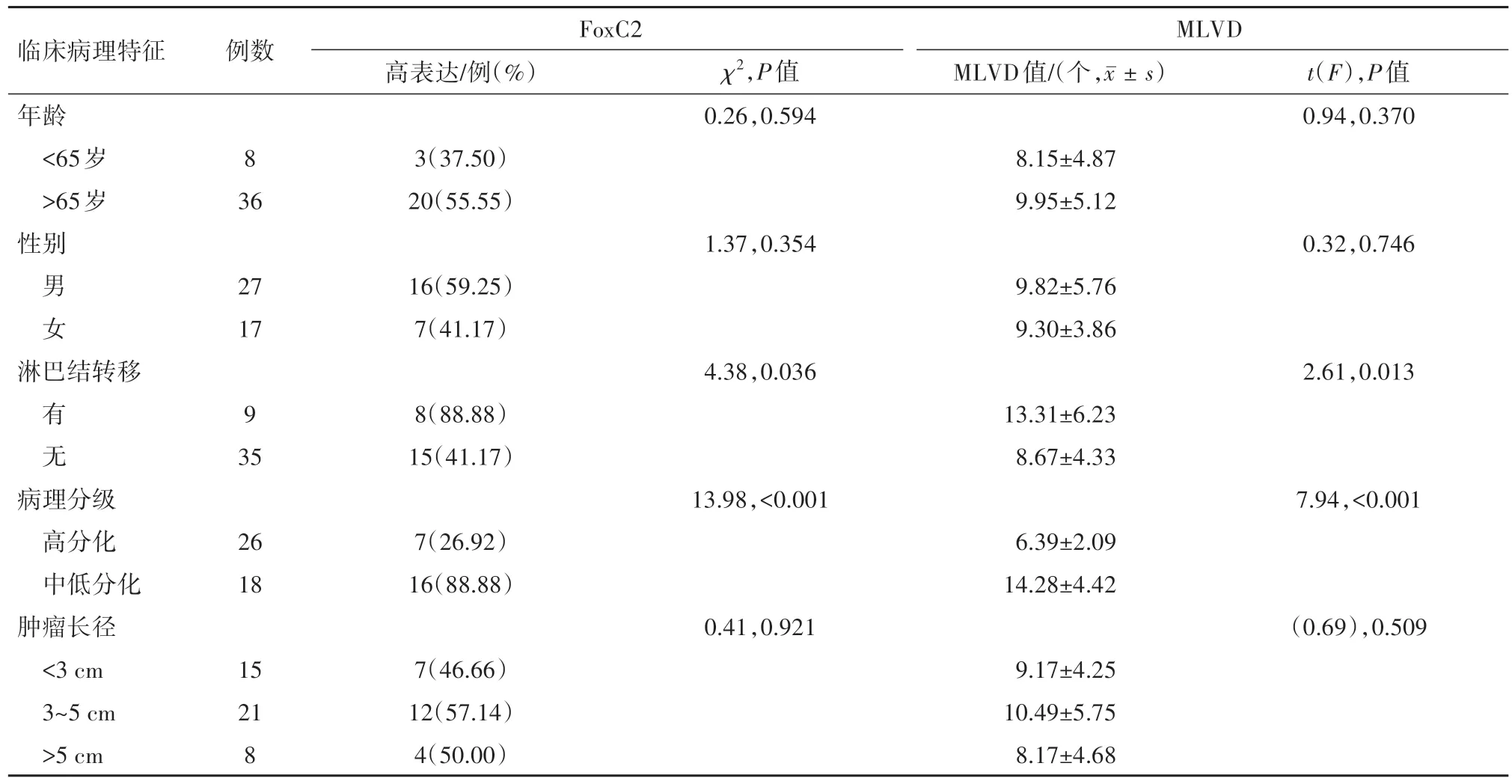
表1 原发性皮肤鳞状细胞癌44例癌组织中叉头框蛋白C2(FoxC2)表达和微淋巴管密度(MLVD)与其临床病理特征的关系
2.2 FoxC2表达水平与MLVD的相关性44例CSCC组织中, FoxC2高表达组MLVD为(12.24±4.86)个, 低表达组MLVD为(6.75±3.56)个, Pearson相关分析显示, FoxC2表达情况与MLVD值呈正相关(r=0.55,P<0.001), 即FoxC2高表达组的MLVD值高于FoxC2低表达组的MLVD值。
3 讨论
CSCC临床上的治疗手段主要以手术切除治疗为主, 我国仍然以传统肿块局部切除手术为主, 国外最常用的手术治疗为莫式显微描记手术, 此技术不仅仅可以切除皮肤肿块, 在充分考虑浸润深度的前提下, 可以将局部复发率降到最低, 但在我国还没有达到普及[11-12]。目前纳米光疗已经是治疗皮肤肿瘤的一种全新的技术, 但治疗效果仍然非常受限[13], 我国CSCC病人术后复发及转移风险依然很高, 一旦发生转移将会导致较差的预后。
FoxC2是调节血管及淋巴管发育的重要蛋白, 目前有17个Fox基因亚家族, 控制着一系列生物过程, 包括细胞生长、增殖、分化, 其突变与淋巴水肿密切相关, 同时也是肿瘤转移所必需的上皮-间充质转化过程的关键调节因子[14]。本研究结果显示, FoxC2在CSCC中低分化组、有淋巴结转移组中高表达, 提示FoxC2可能参与CSCC发生、发展及转移, 且FoxC2高表达组的MLVD值明显高于低表达组, 提示FoxC2促进肿瘤淋巴管新生, 与肿瘤淋巴结转移密切相关。FoxC2参与肿瘤淋巴管新生的原因可能有:①磷酸化的FoxC2和果蝇同源框蛋白1(Prox1)控制下游的连接蛋白37的表达[15], 从而阻碍淋巴管瓣膜的形成。FoxC2和连接蛋白37的缺失会导致淋巴管生长和重塑发生严重缺陷[16]。②淋巴管成熟需要流体剪切应力, 而FoxC2可以通过调节流体剪切应力来稳定新生的淋巴管系统, 帮助其存活[17]。因此FoxC2在淋巴系统中起到至关重要的作用。已有学者研究发现FoxC2在食管癌病人中高度表达, 其表达程度与肿瘤淋巴结转移呈正相关[18], 本研究结果与其相似。因此, 靶向阻断FoxC2的表达可能会在治疗CSCC及肿瘤淋巴转移有着广阔的前景。
LYVE-1是淋巴管内皮细胞特异性标志物, 用于区分淋巴管与血管, 对淋巴管有高度特异性, 在淋巴管新生中发挥重要的作用[19]。本研究结果显示, CSCC有淋巴结转移组、中低分化组的MLVD值分别高于无淋巴结转移组、高分化组, FoxC2高表达组MLVD值大于FoxC2低表达组, 提示LYVE-1的表达水平与CSCC的发展及淋巴结转移密切相关。因此, 靶向阻断LYVE-1的表达可能会为治疗CSCC提供新的方向。

