D-海藻糖联合氨基糖苷类抗生素杀菌效果分析
赖泽迎 吴泽源 杨晓乐 陈雅娟

赖泽迎,吴泽源,杨晓乐,等.D-海藻糖联合氨基糖苷类抗生素杀菌效果分析[J].福建农业科技,2023,54(11):36-43.
收稿日期:2023-09-10
作者简介:赖泽迎,男,1997年生,硕士研究生,主要从事细菌耐药研究。
*通信作者:陈雅娟,女,1979年生,博士,讲师,主要从事细胞逆境响应与代谢调控研究(E-mail:cyj288@fjnu.edu.cn)。
基金项目:福建省自然科学基金面上项目(2019J01278)。
摘 要:目前,开发抗生素佐剂以提高传统抗生素杀菌效果是解决细菌耐药的有效途径之一。为了寻找新的抗生素佐剂,通过外源添加D-海藻糖与三大类杀菌抗生素对大肠杆菌BW25113和金黄色葡萄球菌ATCC25923进行杀灭测试,并通过在 D-海藻糖与氨基糖苷类抗生素联合使用组中外源添加羰基氰化氯苯腙(CCCP),探究D-海藻糖联合氨基糖苷类抗生素潜在的杀菌机制。结果显示D-海藻糖联合氨基糖苷类抗生素对大肠杆菌和金黄色葡萄球菌的杀灭效果最佳,联合杀菌组中外源添加CCCP后,细菌可恢复耐受表型。表明D-海藻糖有望作为新的抗生素佐剂,提示其联合氨基糖苷类抗生素杀菌的机制与质子动力势有关。
关键词:D-海藻糖;氨基糖苷类抗生素;大肠杆菌;金黄色葡萄球菌
中图分类号:Q 93 文献标志码:A 文章编号:0253-2301(2023)11-0036-08
DOI: 10.13651/j.cnki.fjnykj.2023.11.006
Analysis of the Bactericidal Effect of D-trehalose Combined with Aminoglycoside Antibiotics
LAI Ze-ying, WU Ze-yuan, YANG Xiao-le, CHEN Ya-juan*
(Key Laboratory of Cellular Stress Response and Metabolic Regulation in Fujian Universities/College ofLife Science, Fujian Normal University, Fuzhou, Fujian 350108, China)
Abstract: At present, the development of antibiotic adjuvants to improve the bactericidal effect of traditional antibiotics is one of the effective ways to solve the bacterial resistance. In order to find the new antibiotic adjuvants, the killing tests of Escherichia coli BW25113 and Staphylococcus aureus ATCC25923 were carried out through the exogenous addition of D-trehalose and three major types of bactericidal antibiotics, and the potential bactericidal mechanism of D-trehalose combined with aminoglycoside antibiotics was explored by the exogenous addition of carbonyl cyanide m-chlorophenylhydrazone (CCCP) in the combined group of D-trehalose and aminoglycoside antibiotics. The results showed that D-trehalose combined with aminoglycoside antibiotics had the best killing efficacy on Escherichia coli and Staphylococcus aureus. After the exogenous addition of CCCP in the combined sterilization group, the bacteria could restore the tolerance phenotype. It was indicated that D-trehalose was expected to be used as a new antibiotic adjuvant, suggesting that the antibacterial mechanism of D-trehalose combined with aminoglycoside antibiotics was related to the proton motive force.Key words: D-trehalose; Aminoglycoside antibiotics; Escherichia coli; Staphylococcus aureus
自1928 年,Alexander Fleming 發现了青霉素这一真正意义上的抗生素至今已有了将近百年的时间[1]。人类将抗生素广泛运用于农林牧渔医各个领域。然而,随着抗生素的广泛应用,促进了耐药基因与耐药细菌的快速出现[2]。细菌在抵御抗生素侵袭时已经进化出了多种耐药机制。如细菌可通过主动外排[3]、产生钝化酶[4]、降低细胞外膜的通透性[5]、对抗生素杀菌的靶点进行修饰[6]等方法以抵抗抗生素的杀伤作用。为了解决细菌耐药问题,人类致力于开发新型抗生素和探索新的抗菌靶点。但是新型抗生素开发困难,研发周期长且成本高[7]。目前寻找抗生素佐剂以提高现有的传统抗生素的疗效是最主流的解决细菌耐药的方法之一。
在寻找抗生素佐剂的过程中,研究中者们发现了一些理想的抗菌佐剂。有研究发现葡萄糖与氨基糖苷类抗生素联合使用可很好地清除大肠杆菌的生物膜[8]。Hazel Gibson和Ayesha Rahman团队也发现了利用酸性氨基酸与环丙沙星联合用可有效地阻止金黄色葡萄球菌生物膜的形成[9]。此外,一些醇类、吲哚以及抗菌肽等代谢物也被报道可辅助氨基糖苷类抗生素杀灭致病性大肠杆菌[10-15]。与单独使用抗生素进行杀菌相比,外源添加佐剂杀菌的效果更优。因此,开发一系列抗生素佐剂对控制细菌耐药是种有效的手段之一。
本研究借鉴前人经验聚焦于与葡萄糖结构相类似的D-海藻糖上,对D-海藻糖联合氨基糖苷类抗生素杀菌效果进行分析,以期将D-海藻糖作为新的抗生素佐剂。本研究通过外源添加D-海藻糖与三大类杀菌抗生素对大肠杆菌BW25113和金黄色葡萄球菌ATCC25923进行杀灭测试,确定与D-海藻糖联用具有最佳杀菌效果的抗生素,并利用不同培养基对D-海藻糖联合氨基糖苷类抗生素进行杀菌测试,评估D-海藻糖联合氨基糖苷类抗生素在不同环境之中的杀菌效果,最后通过在 D-海藻糖与氨基糖苷类抗生素联合使用组中外源添加羰基氰化氯苯腙(CCCP),探究D-海藻糖联合氨基糖苷类抗生素潜在的杀菌机制。
1 材料与方法
1.1 试验材料
以大肠杆菌模式菌株BW25113和金黄色葡萄球菌ATCC25923为试验材料。氨基糖苷类抗生素:庆大霉素(Gentamycin,Genta)、链霉素(Streptomycin,Strep)、妥布霉素(Tobramycin,Tob)。喹诺酮类抗生素:氧氟沙星(Ofloxacin,Ofl)、环丙沙星(Ciprofloxacin,Cip)。β-内酰胺类抗生素:羧苄青霉素(Carbenicillin,Car)、氨苄青霉素(Ampicillin,Amp)。
培养基、缓冲液及化学试剂:LB培养基(Luria-Bertani)、M9培养基、0.01 mol·L-1磷酸盐缓冲液(PBS)、0.9%生理盐水、1 mol·L-1 D-海藻糖(D-Trehalose)溶液以及羰基氰化氯苯腙(CCCP)溶液。
1.2 试验方法
1.2.1 菌种活化与稀释滴板方法 取于-80℃存放的菌种按1∶100比例加入到1 mL的新鲜 LB液体培养基,于37℃摇床中过夜培养。取过夜活化好的菌液按1∶500比例接种于20 mL的新鲜LB培养基中,于37℃摇床中孵育24 h至平台期。
取经不同试验条件处理的50 μL平台期的菌液至1.5 mL EP管中,13000 r·min-1,离心2 min去除上清,再用100 μL PBS缓冲液重悬菌体,洗涤2次,最后加入50 μL PBS缓冲液重悬菌体,使其与原菌液体系相同。随后将菌悬液用 PBS缓冲液依次进行10倍梯度稀释,最后取4 μL稀释完的菌液滴于固体LB平板上。自然风干后,于37℃恒温培养箱中培养12 h,观察平板上存活的菌落数。
1.2.2 D-海藻糖联合庆大霉素杀灭平台期细菌的效果测试 取4根干净的摇菌管,分别编号1~4,再依次加入500 μL的平台期大肠杆菌菌液。1号管为空白对照组,2号管加入D-海藻糖(10 mmol· L-1),3号管加入庆大霉素(30 μg·mL-1),4号管为D-海藻糖和庆大霉素双处理组。最后将上述4个摇菌管放于37℃摇床中,220 r·min-1,处理3 h。
金黄色葡萄球菌试验组的D-海藻糖浓度设置为30 mmol·L-1,庆大霉素浓度设置为100 μg·mL-1。同样取平台期金黄色葡萄球菌菌液500 μL分别加入4个摇菌管中,分别编号5~8。其中5号管为空白对照组,6号管加入D-海藻糖(30 mmol·L-1),7号管加入庆大霉素(100 μg·mL-1),8号管为D-海藻糖和庆大霉素双处理组。最后将上述4个摇菌管放于37℃摇床中,220 r·min-1,处理3 h。
1.2.3 D-海藻糖联合庆大霉素杀灭平台期大肠杆菌的浓度梯度测试 取10根干净的摇菌管,分别编号1~10,再依次加入500 μL的平台期大肠杆菌菌液。1号管为空白对照组,2~5号管为海藻糖单处理组,依次设置海藻糖浓度为10、30、50、80 mmol·L-1,6号管为庆大霉素单处理组,加入庆大霉素(30 μg·mL-1),7~10号管为D-海藻糖和庆大霉素双处理组,按照预定的浓度顺序添加D-海藻糖,然后在每个管中额外添加庆大霉素(30 μg·mL-1)。最后将上述10个摇菌管放于37℃摇床中,220 r·min-1,处理3 h。
1.2.4 D-海藻糖联合庆大霉素杀灭平台期金黄色葡萄球菌的浓度梯度测试 取14根干净的摇菌管,分别编号1~14,再依次加入500 μL的平台期金黄色葡萄球菌菌液。1号管为空白对照组,2~7号管为海藻糖单处理组,依次设置海藻糖浓度为1、10、30、50、80、100 mmol· L-1,8号管为庆大霉素单处理组,加入庆大霉素(100 μg·mL-1),9~14号管为D-海藻糖和庆大霉素双处理组,按照预定的浓度顺序添加D-海藻糖,然后在每个管中额外添加庆大霉素(100 μg·mL-1)。最后将上述14个摇菌管放于37℃摇床中,220 r·min-1,处理3 h。
1.2.5 D-海藻糖联合杀菌型抗生素杀灭平台期细菌效果测试 取16根干净的摇菌管,分别编号1~16,再依次加入500 μL的平台期大肠杆菌菌液。1号管为空白对照组,2~7号管为抗生素单处理组,分别加入妥布霉素(50 μg·mL-1)、庆大霉素(30 μg·mL-1)、链霉素(200 μg·mL-1)、环丙沙星(10 μg·mL-1)、氧氟沙星(10 μg·mL-1)、氨芐青霉素(200 μg·mL-1)、羧苄青霉素(200 μg·mL-1),8号管加入D-海藻糖(10 mmol·L-1),9~16号管为D-海藻糖和抗生素双处理组,按照预定的浓度顺序添加抗生素,然后在每个管中额外添加D-海藻糖(10 mmol·L-1)。最后将上述16个摇菌管放于37℃摇床中,220 r·min-1,处理3 h。
金黄色葡萄球菌试验组,同样取16根干净的摇菌管,分别编号1~16,再依次加入500 μL的平台期金黄色葡萄球菌菌液。1号管为空白对照组,2~7号管为抗生素单处理组,分别加入链霉素(200 μg·mL-1)、庆大霉素(100 μg·mL-1)、妥布霉素(200 μg·mL-1)、环丙沙星(10 μg·mL-1)、氧氟沙星(10 μg·mL-1)、氨苄青霉素(200 μg·mL-1)、羧苄青霉素(200 μg·mL-1),8号管加入D-海藻糖(30 mmol· L-1),9~16号管为D-海藻糖和抗生素双处理组,按照预定的浓度顺序添加抗生素,然后在每个管中额外添加D-海藻糖(30 mmol·L-1)。最后将上述16个摇菌管放于37℃摇床中,220 r·min-1,处理3 h。
1.2.6 不同培养基中D-海藻糖联合氨基糖苷类抗生素杀灭平台期细菌效果测试 取平台期大肠杆菌菌液500 μL分别加入8个1.5 mL EP管中,13000 r·min-1,离心2分钟,去除上清,将菌体用500 μL的PBS缓冲液悬浮,进行两次洗涤。最后,再次用500 μL的PBS缓冲液悬浮菌体,以还原至原始菌液的体系。再将菌液分别转移至8个摇菌管中。1号管为空白对照组,2~4号管为抗生素单处理组,分别加入链霉素(200 μg·mL-1)、庆大霉素(30 μg·mL-1)、妥布霉素(50 μg·mL-1),5号管加入D-海藻糖(10 mmol·L-1),6~8号管为D-海藻糖和抗生素双处理组,按照预定的浓度顺序添加抗生素,然后在每个管中额外添加D-海藻糖(10 mmol· L-1)。最后将上述8个摇菌管放于37℃摇床中,220 r·min-1,处理3 h。
金黄色葡萄球菌试验组,取平台期金黄色葡萄球菌菌液500 μL分别加入8个1.5 mL EP管中,13000 r·min-1,离心2 min,去除上清,将菌体用500 μL的PBS缓冲液悬浮,进行两次洗涤。最后,再次用500 μL的PBS缓冲液悬浮菌体,以还原至原始菌液的体系。再将菌液分别转移至8个摇菌管中。1号管为空白对照组,2~4号管为抗生素单处理组,分别加入链霉素(200 μg·mL-1)、庆大霉素(100 μg·mL-1)、妥布霉素(200 μg·mL-1),5号管加入D-海藻糖(30 mmol·L-1),6~8号管为D-海藻糖和抗生素双处理组,按照预定的浓度顺序添加抗生素,然后在每个管中额外添加D-海藻糖(30 mmol·L-1)。最后将上述8个摇菌管放于37℃摇床中,220 r·min-1,处理3 h。
1.2.7 羰基氰化氯苯腙对D-海藻糖联合抗生素杀菌影响 取15根干净的摇菌管,分别编号1~15,再依次加入500 μL的平台期金黄色葡萄球菌菌液。1号管为空白对照组,2~6号管为单处理组,依次分别加入D-海藻糖(30 mmol· L-1)、妥布霉素(200 μg·mL-1)、链霉素(200 μg·mL-1)、庆大霉素(100 μg·mL-1)、CCCP(20 μmol·mL-1),7~9号管为D-海藻糖和抗生素双处理组,按照预定的浓度顺序添加抗生素,然后在每个管中额外添加D-海藻糖(30 mmol·L-1),10~12号管为抗生素与CCCP双处理组,按照预定的浓度顺序添加抗生素,然后在每个管中额外添加CCCP(20 μmol·mL-1)。13~15号管为抗生素、CCCP与D-海藻糖三处理组,按照预定的浓度顺序添加抗生素,然后在每个管中额外添加CCCP(20 μmol·mL-1)和D-海藻糖(30 mmol·L-1)。最后将上述15个摇菌管放于37℃摇床中,220 r·min-1,处理3 h。
2 结果与分析
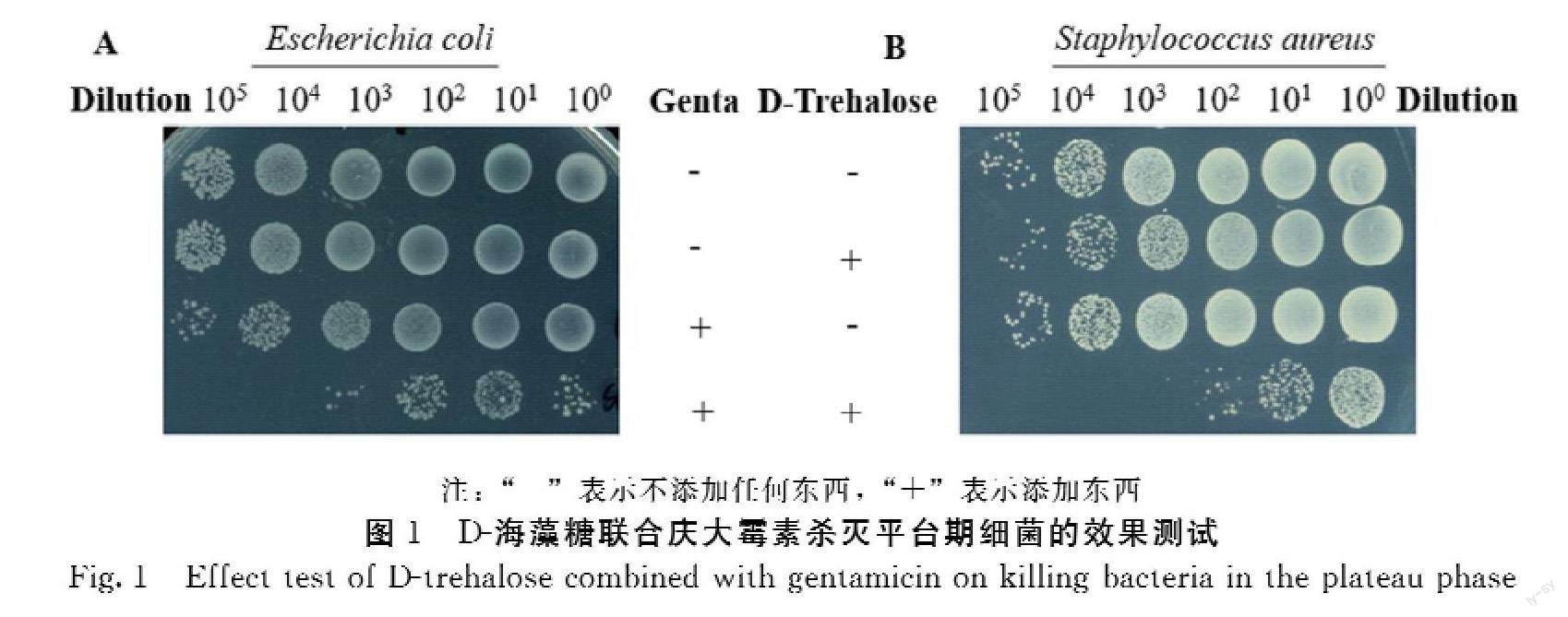
2.1 D-海藻糖联合庆大霉素杀灭平台期细菌的效果测试
由图1A可知,庆大霉素(30 μg·mL-1)单处理组、D-海藻糖(10 mmol·L-1)单处理组在
杀灭大肠杆菌的效果上与空白对照组相比无显著差异。而D-海藻糖与庆大霉素双处理组的杀菌效果与庆大霉素单处理组相比增强了约3个数量级。可见D-海藻糖联合庆大霉素杀菌效果更佳。
由图1B可知,庆大霉素(100 μg·mL-1)单处理组、D-海藻糖(30 mmol·L-1)单处理组在杀灭金黄色葡萄球菌的效果上与空白对照组相比无显著差异。D-海藻糖和庆大霉素的联合处理组,在杀灭金黄色葡萄球菌的效果上相較于仅使用庆大霉素的处理组提高了大约3个数量级。证明D-海藻糖联合庆大霉素可很好杀灭平台期金黄色葡萄球菌。综上所述,D-海藻糖联合庆大霉素既可以杀灭革兰氏阴性菌又可以杀灭革兰氏阳性菌。
2.2 D-海藻糖联合庆大霉素杀灭平台期细菌的浓度梯度测试
由图2 A可知,在0~80 mmol·mL-1的浓度范围内,D-海藻糖的单独处理未观察到显著的抗菌效果,而D-海藻糖与庆大霉素双处理中,D-海藻糖在浓度为10 mmol·mL-1时开始显示出与庆大霉素相辅相成的杀菌效果,但与浓度为30 mmol·mL-1时的杀菌效果相比,二者之间无显著差异。所以,后续试验将D-海藻糖浓度定为10 mmol·mL-1与抗生素联合去杀灭大肠杆菌。
由图2 B可知,在浓度范围从0~100 mmol·mL-1的梯度内,D-海藻糖的单独处理未观察到显著的抗菌效果。然而,在D-海藻糖与庆大霉素联合处理中,即使在极低的浓度1 mmol·mL-1下,也观察到了其辅助庆大霉素杀菌的现象,而当D-海藻糖浓度达到30 mmol·mL-1杀菌效果是最佳的。因此,后续研究将D-海藻糖浓度定为30 mmol·mL-1与抗生素联合去杀灭金黄色葡萄球菌。
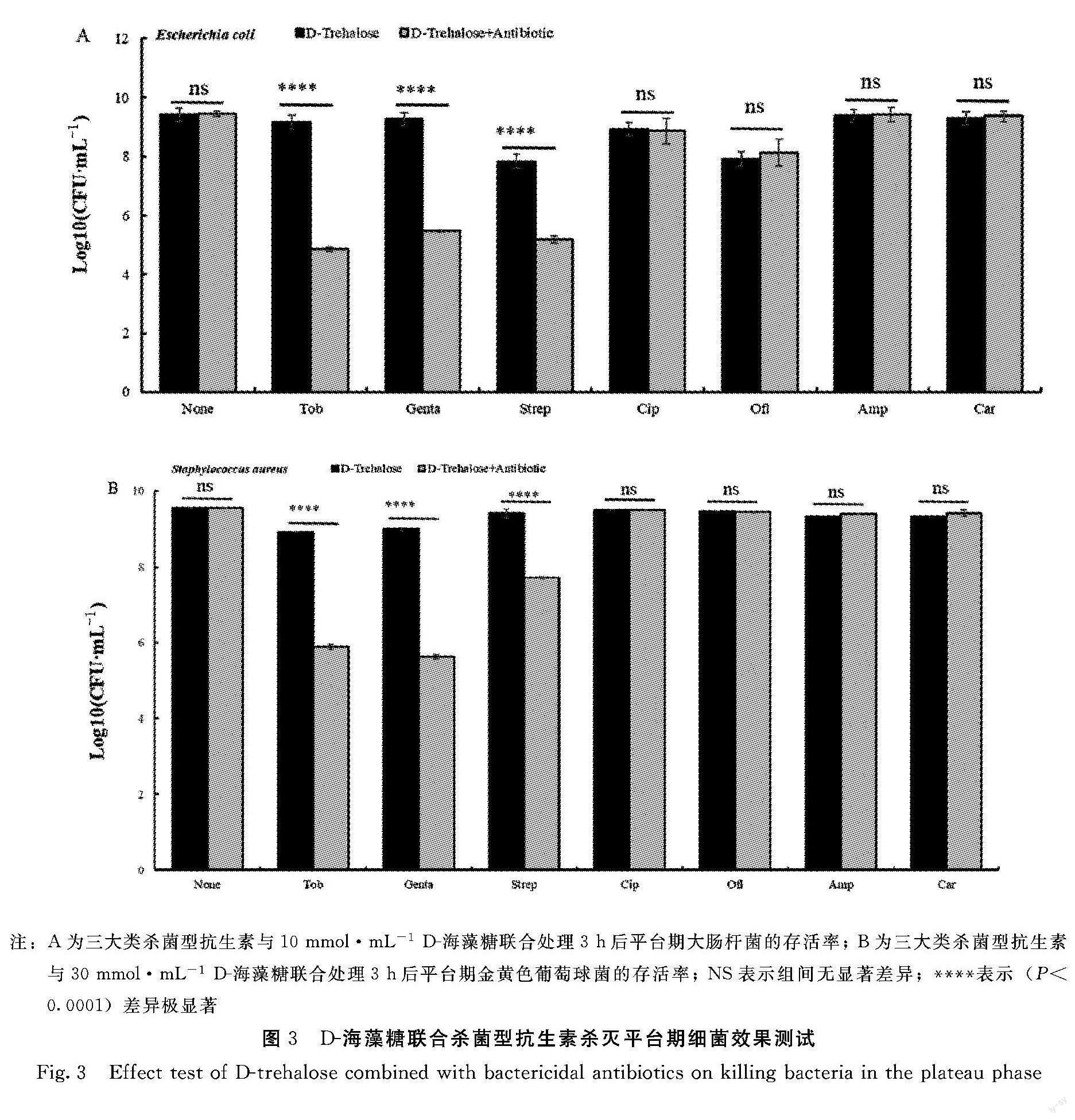
2.3 D-海藻糖联合杀菌型抗生素杀灭平台期细菌效果测试
由圖3A和图3B可知,D-海藻糖与妥布霉素、庆大霉素和链霉素这3种氨基糖苷类抗生素联合使用对平台期的大肠杆菌和金黄色葡萄球菌的杀灭表现出显著的效果。然而,通过统计学分析,在D-海藻糖与环丙沙星以及氧氟沙星这两种喹诺酮类抗生素的联合处理中,并未观察到在辅助杀菌效果方面存在显著性差异。D-海藻糖与氨苄西林和羧苄青霉素这2种β-内酰胺类抗生素联合使用对大肠杆菌和金黄色葡萄球菌的杀灭也没有表现出显著的差异。所以,D-海藻糖只有与氨基糖苷类抗生素联合使用才具有辅助杀菌的功能。
2.4 不同培养基中D-海藻糖联合氨基糖苷类抗生素杀灭平台期细菌效果测试
由图4A~C可知,D-海藻糖分别与妥布霉素、庆大霉素和链霉素联合使用在M9、PBS和Nacl等培养基中对大肠杆菌杀菌效果效果明显,组间差异极显著(P<0.0001)。由图4D~4E可知,在M9和PBS培养基中D-海藻糖辅助3种氨基糖苷类抗生素杀灭金黄色葡萄球菌效果显著。但于Nacl培养基中,D-海藻糖联合妥布霉素杀菌效果明显。而当D-海藻糖和庆大霉素、链霉素联用之时,D-海藻糖均无辅助杀菌的效果。D-海藻糖联合氨基糖苷类抗生素在不同培养基中的杀菌效果不同可能是由不同培养基的离子浓度不同导致的。此外,D-海藻糖联合妥布霉素在不同的培养基当中杀菌效果都较好。因此,在临床应用时可多考虑使用妥布霉素与D-海藻糖联用杀菌。
2.5 羰基氰化氯苯腙对D-海藻糖联合抗生素杀菌影响
图5C结果显示CCCP与抗生素双处理可以很好地杀灭金黄色葡萄球菌,这与李中燕等人发现CCCP联合氨基糖苷类抗生素可以很好地杀灭多种病原菌结果相符合[16]。由5图D可知,在D-海藻糖与抗生素双处理组之中外源添加CCCP,细菌可恢复耐受表型。由此可以猜测,D-海藻糖促进氨基糖苷类抗生素杀菌可能是由于D-海藻糖提升了细菌体内的质子动力势(PMF),从而促进了细菌对抗生素的摄取而造成细菌的死亡。
3 结论与讨论
随着时间的推移,全球范围内抗生素应用范围越来越广,细菌对于抗生素的耐药性也越来越强,细菌耐药危机已经出现[17]。细菌耐药不仅对农林牧渔业生产造成严重影响,也对人类的生命健康构成了巨大的威胁。细菌感染会不断地增加国家医疗支出,对国家和民众造成很大的负担。这也会造成不发达国家和地区贫富差距进一步拉大[18]。目前世界各国科学家都在积极寻找有效杀灭和抑制耐药菌的策略。其中最有效且实用的策略便是寻找抗生素增效剂,增强传统抗生素的杀菌效果。
本研究通过一系列试验证实了联合使用D-海藻糖和氨基糖苷类抗生素可以有效消灭平台期大肠杆菌和金黄色葡萄球菌。而且发现在不同培养基中D-海藻糖联合妥布霉素的杀菌效果均良好。此外,在 D-海藻糖与氨基糖苷类抗生素联合使用组中外源添加CCCP,发现细菌可以恢复耐受表型。此试验结果提示,D-海藻糖促进氨基糖苷类抗生素杀菌可能是由于D-海藻糖提升了细菌体内的PMF,从而促进了细菌对抗生素的摄取而造成细菌的死亡。至于D-海藻糖是否还可以通过其他途径增强氨基糖苷类抗生素杀菌,后续还需对其杀菌机制进行进一步的研究。
本研究所使用的D-海藻糖是一种生物代谢物。许多生物代谢物都是无毒无害的,本实验室致力于对生物代谢物抗菌这方面的研究,期望寻找到一些新的、有效的抗菌代谢物并进行大量生产应用于医药、工业、农业以及食品等领域,切实地解决细菌耐药难题。
参考文献:
[1]R H.New light on the history of penicillin[J].Med Hist, 1982, 26: 1-24.
[2]WRIGHT G D.Antibiotic resistance in the environment: a link to the clinic?[J].Curr Opin Microbiol, 2010, 13(5): 589-594.
[3]LI X Z, PLESIAT P, NIKAIDO H.The challenge of efflux-mediated antibiotic resistance in Gram-negative bacteria[J].Clin Microbiol Rev, 2015, 28(2): 337-418.
[4]DE ANGELIS G, DEL GIACOMO P, POSTERARO B, et al.Molecular Mechanisms, Epidemiology, and Clinical Importance of β-Lactam Resistance in Enterobacteriaceae[J].International Journal of Molecular Sciences, 2020, 21(14):5090.
[5]CUI L M H, KUWAHARA-ARAI K.Contribution of a thickened cell wall and its glutamine nonamidated component to the vancomycin resistance expressed by Staphylococcus aureus Mu50[J].Antimicrobial Agents and Chemotherapy, 2000, 44:2276-2285.
[6]ZAPUN A, CONTRERAS-MARTEL C, VERNET T.Penicillin-binding proteins and beta-lactam resistance[J].FEMS Microbiol Rev, 2008, 32(2): 361-385.
[7]BHARDWAJ S, MEHRA P, DHANJAL D S, et al.Antibiotics and Antibiotic Resistance-Flipsides of the Same Coin[J].Current pharmaceutical design, 2022,28:2312-2329.
[8]ALLISON K R, BRYNILDSEN M P, COLLINS J J.Metabolite-enabled eradication of bacterial persisters by aminoglycosides[J].Nature, 2011, 473(7346): 216-220.
[9]WARRAICH A A, MOHAMMED A R, PERRIE Y, et al.Evaluation of anti-biofilm activity of acidic amino acids and synergy with ciprofloxacin on Staphylococcus aureus biofilms[J].Sci Rep, 2020, 10(1): 9021.
[10]馮荆城,庄彬彬,李中燕,等.1,2-丁二醇辅助氨基糖苷类抗生素杀灭大肠杆菌效果分析[J].福建农业科技, 2022, 53(7): 27-34.
[11]石舒婷,王妍.细胞穿透肽增强氨基糖苷类抗生素杀菌作用的方法[J].福建农业科技, 2022, 53(1): 12-17.
[12]LV B, BIAN M, HUANG X, et al.n-Butanol Potentiates Subinhibitory Aminoglycosides against Bacterial Persisters and Multidrug-Resistant MRSA by Rapidly Enhancing Antibiotic Uptake[J].ACS Infect Dis, 2022, 8(2): 373-386.
[13]SUN F, BIAN M, LI Z, et al.5-Methylindole Potentiates Aminoglycoside Against Gram-Positive Bacteria Including Staphylococcus aureus Persisters Under Hypoionic Conditions[J].Front Cell Infect Microbiol, 2020, 10: 84.
[14]卞蒙蒙.正丁醇/甘油增强氨基糖苷类抗生素杀灭耐受菌及其机制研究[D].福州:福建师范大学, 2021.
[15]孙凤琪.吲哚及其衍生物配合氨基糖苷类抗生素杀灭革兰氏阳性菌[D].福州:福建师范大学, 2021.
[16]LI Z, WU L, HUANG Z, et al.CCCP Facilitates Aminoglycoside to Kill Late Stationary-Phase Escherichia coli by Elevating Hydroxyl Radical[J].ACS Infect Dis, 2023, 9(4): 801-814.
[17]HUTCHINGS M I, TRUMAN A W, WILKINSON B.Antibiotics: past, present and future[J].Curr Opin Microbiol, 2019, 51: 72-80.
[18]AHMAD M, KHAN A U.Global economic impact of antibiotic resistance: A review[J].J Glob Antimicrob Resist, 2019, 19: 313-316.
(责任编辑:柯文辉)

