芹菜素磷脂复合物纳米混悬剂制备及其体内药动学研究
宋文颖,于雅琴
(珠海科技学院,广东 珠海 519041)
芹菜素属于黄酮类化合物,大量存在于橘子、洋葱、欧芹、柑橘等植物中[1],具有抗肿瘤、抗氧化、抗炎、抗菌、抗病毒、降血压、心肌保护等活性[1-3],开发价值大,但该成分溶解度仅为1.35 μg/mL[4],并且溶出度低,体内易受胃肠道酶、pH 值的影响[5],导致其口服吸收困难。目前,已有关于芹菜素固体分散体[4]、磷脂复合物[4]、固体脂质纳米粒[6]等方面的研究,但固体分散体或磷脂复合物改善吸收程度有限[4],而固体脂质纳米粒往往存在载药量较低等问题。
纳米混悬剂可提高难溶性药物的溶解度、溶出度、生物利用度等参数[7-9],应用潜力较大,于世龙[10]采用二甲基亚砜(DMSO)作为溶剂制备芹菜素纳米混悬剂,但它难以除去,而且具有一定毒性[11],影响了推广价值。本实验采用磷脂复合物增加芹菜素在有机溶剂(如乙醇)中的溶解度,可为后续其纳米混悬剂的制备奠定基础[4,12],并且磷脂复合物一般存在黏性大、溶出度低、生物利用度提高程度受限等问题[13-14],而将其进一步制成纳米混悬剂后可有效解决这些缺陷,能为后续相关研究提供新思路。
1 材料
SQP 型电子天平[赛多利斯科学仪器(北京)有限公司];08-2G 型恒温加热磁力搅拌器(上海梅颖浦仪器仪表制造有限公司);安捷伦1200 型高效液相色谱仪(美国安捷伦公司);Master-sizer 型粒度分析仪(英国马尔文仪器有限公司);ATS 型均质机(加拿大SEEKER 公司);MIX-2500 型涡旋混合器(常州金坛良友仪器有限公司);HNDK400 型氮气吹扫仪(上海达洛科学仪器有限公司);BCD-206TAS 型冰箱(青岛海尔股份有限公司)。
芹菜素对照品(批号191105,纯度98%,南京青泽医药科技开发有限公司);芹菜素原料药(批号Y190915,纯度96.5%,山东永信中和生物科技有限公司)。磷脂酰胆碱(批号20191012,上海辅必成医药科技有限公司);十二烷基硫酸钠(SDS,批号20200124,国药集团化学试剂有限公司);聚乙烯吡咯烷酮K30(PVP K30,批号250015427,美国Ashland 公司)。
清洁级SD 大鼠,体质量(240±20)g,雌雄兼具,购于河南省动物实验中心,动物生产许可证号SCXK(豫)2016-0001。
2 方法与结果
2.1 纳米混悬剂制备 参考文献[12,14]报道,采用高压均质法。取芹菜素原料药100 mg、磷脂300 mg,置于烧杯中(摩尔比约1∶1),加入50 mL 乙酸乙酯制成混悬液,50 ℃水浴磁力搅拌至溶液澄清(约2.5 h),减压旋蒸除去乙酸乙酯,加入5 mL 无水乙醇复溶,作为有机相;称取处方量PVP K30、泊洛沙姆188,溶于100 mL 蒸馏水中,加热至50 ℃,作为水相,将有机相加到水相中,减压旋蒸10 min 后在一定压力下循环均质数次,蒸馏水定容至100 mL,过0.45 μm 微孔滤膜,即得。
2.2 HPLC 法测定芹菜素含量
2.2.1 色谱条件 Agilent-C18色谱柱(4.6 mm×250 mm,5 μm);体积流量水-甲醇(70∶30);体积流量1.0 mL/min;柱温30 ℃;检测波长340 nm;进样量20 μL。理论塔板数以芹菜素计,不低于6 500。
2.2.2 线性关系考察 精密称取芹菜素对照品适量,甲醇制成每1 mL 含100 μg 该成分的对照品溶液,流动相依次稀释至20、10、5、0.5、0.1、0.05 μg/mL,在“2.2.1” 项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=24.147 2X-9.425 7(r=0.999 9),在0.05~20 μg/mL 范围内线性关系良好。
2.2.3 供试品溶液制备 取1 mL 纳米混悬剂,置于100 mL 量瓶中,甲醇超声溶解并定容,过0.45 μm 微孔滤膜,即得。
2.2.4 方法学考察 取供试品溶液适量,室温下于0、4、8、12、24、48 h 在“2.2.1” 项色谱条件下进样测定,测得芹菜素峰面积RSD 为0.19%,表明溶液在48 h 内稳定性良好。取20、5、0.05 μg/mL 对照品溶液适量,在“2.2.1” 项色谱条件下进样测定6 次,测得芹菜素含量RSD 分别为0.24%、0.31%、0.23%,表明仪器精密度良好。取纳米混悬剂适量,按“2.2.3” 项下方法平行制备6 份供试品溶液,在“2.2.1” 项色谱条件下进样测定,测得芹菜素含量RSD 为1.40%,表明该方法重复性良好。取0.5 mL 纳米混悬剂,置于100 mL 量瓶中,平行9 份,分为高、中、低3 组,分别加入对照品溶液(100 μg/mL)6、5、4 mL,再加入甲醇超声溶解并定容,过0.45 μm 微孔滤膜,在“2.2.1” 项色谱条件下进样测定,测得芹菜素平均加样回收率分别为100.87%、99.46%、99.03%,RSD 分别为0.74%、1.19%、0.63%。
2.3 粒径、PDI、Zeta 电位测定 取纳米混悬剂0.5 mL,蒸馏水稀释30 倍,混匀后取适量至比色皿中,在粒度分析仪上测定。
2.4 单因素试验
2.4.1 稳定剂用量 固定PVP K30 与泊洛沙姆188 比例为1∶1,均质压力为100 MPa,均质次数为8 次,考察稳定剂用量50、100、150、200 mg对粒径、PDI、Zeta 电位的影响,结果见表1。由此可知,当稳定剂用量较小时,粒径、PDI 较高,Zeta 电位绝对值较低;随着用量增加,粒径、PDI逐渐降低,Zeta 电位绝对值逐渐升高,但过大时粒径、PDI 反而又有升高趋势。最终,选择稳定剂用量为150 mg。
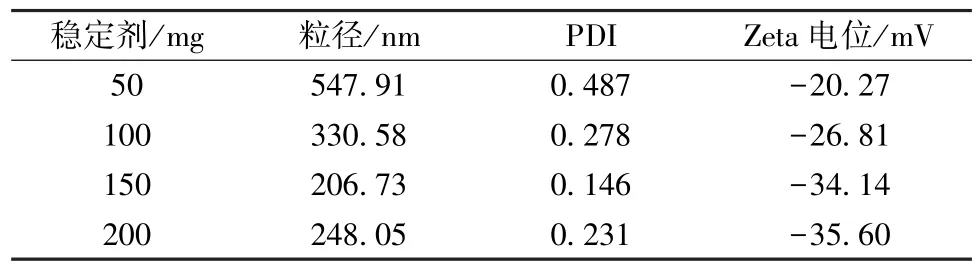
表1 稳定剂用量对粒径、PDI、Zeta 电位的影响(n=3)Tab.1 Effects of stabilizer consumption on particle size,PDI and Zeta potential(n=3)
2.4.2 PVP K30 与泊洛沙姆188 比例 固定稳定剂用量为150 mg,均质压力为100 MPa,均质次数为8 次,考察PVP K30 与泊洛沙姆188 比例对粒径、PDI、Zeta 电位的影响,结果见表2。由此可知,当PVP K30 用量逐渐增加时,粒径、PDI 先降低后升高;当两者比例为1∶2 时,粒径、PDI较低,Zeta 电位绝对值较高。最终,选择PVP K30与泊洛沙姆188 比例为1∶2。

表2 PVP K30 与泊洛沙姆188 比例对粒径、PDI、Zeta电位的影响(n=3)Tab.2 Effects of PVP K30-Poloxamer 188 ratio on particle size,PDI and Zeta potential(n=3)
2.4.3 均质压力 固定稳定剂用量为150 mg,PVP K30 与泊洛沙姆188 比例为1∶2,均质次数为8 次,考察均质压力对粒径、PDI、Zeta 电位的影响,结果见表3。由此可知,随着均质压力增加,粒径、PDI 先降低后升高;当均质压力为110 MPa 时,PDI、Zeta 电位绝对值与100 MPa 时相比差异不大,但粒径低于200 nm。最终,选择均质压力为110 MPa。

表3 均质压力对粒径、PDI、Zeta 电位的影响(n=3)Tab.3 Effects of homogenization pressure on particle size,PDI and Zeta potential(n=3)
2.4.4 均质次数 固定稳定剂用量为150 mg,PVP K30 与泊洛沙姆188 比例为1∶2,均质压力为110 MPa,考察均质次数对粒径、PDI、Zeta 电位的影响,结果见表4。由此可知,随着均质次数增加,粒径、PDI 先降低后升高;当均质次数为10 次时,粒径、PDI 较低,Zeta 电位绝对值较高。最终,选择均质次数为10 次。
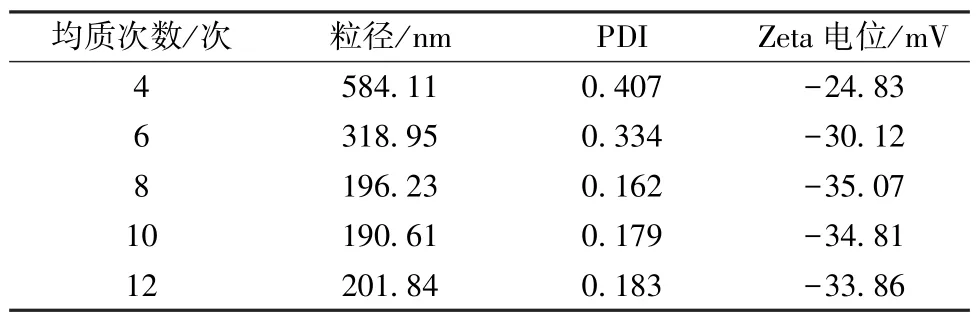
表4 均质次数对粒径、PDI、Zeta 电位的影响(n=3)Tab.4 Effects of homogenization frequency on particle size,PDI and Zeta potential(n=3)
2.5 验证试验 根据单因素试验结果,确定最优制备工艺为取芹菜素100 mg、磷脂酰胆碱300 mg,置于烧杯中,加入50 mL 乙酸乙酯制成混悬液,50 ℃水浴磁力搅拌至溶液澄清(约2.5 h),减压旋蒸除去乙酸乙酯得熔融液,加入5 mL 无水乙醇复溶,作为有机相;以PVP K30 与泊洛沙姆188比例为1∶2 共取150 mg,溶于100 mL 蒸馏水中,加热至50 ℃后加到熔融液中,立即在110 MPa 均质压力下循环均质10 次,过0.45 μm 微孔滤膜,即得。平行制备3 批样品,按“2.3” 项下方法测得平均粒径为193.51 nm(图1),PDI 为0.172,Zeta 电位为-36.48 mV(图2)。

图1 芹菜素磷脂复合物纳米混悬剂Zeta 电位Fig.1 Zeta potential of nanosuspensions of apigenin phospholipids complex
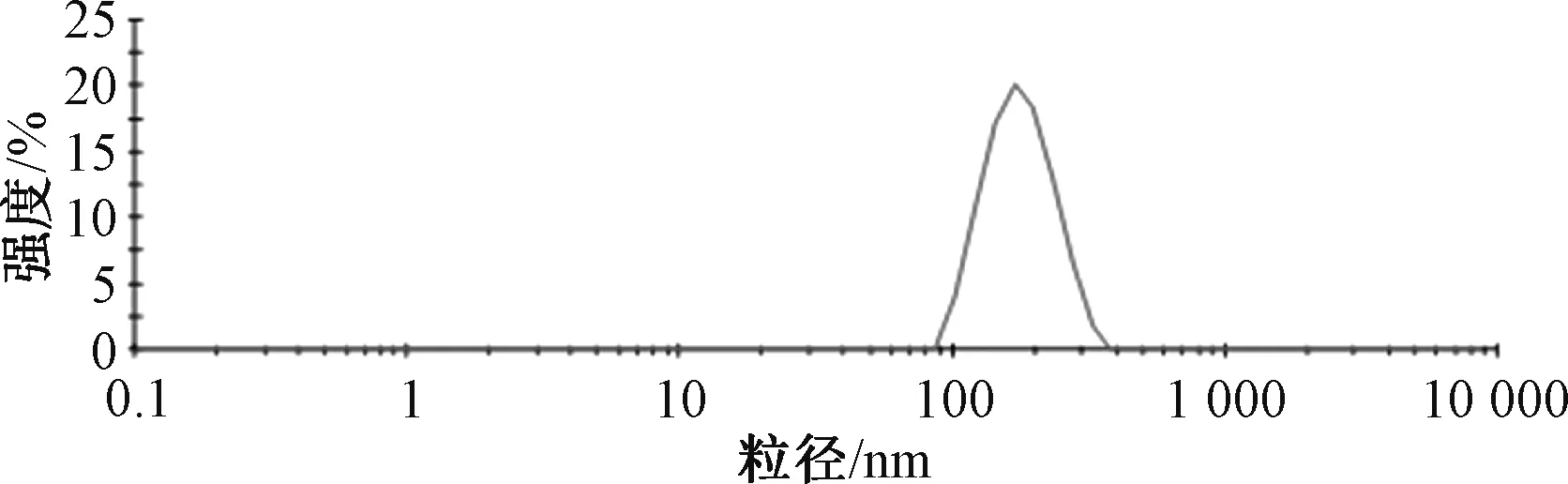
图2 芹菜素磷脂复合物纳米混悬剂粒径分布Fig.2 Particle size of nanosuspensions of apigenin phospholipids complex
2.6 载药量测定 取1 mL 纳米混悬剂至100 mL量瓶中,甲醇超声溶解并定容,过0.45 μm 微孔滤膜,在“2.2.1” 项色谱条件下进样测定,计算芹菜素含量M1;取1 mL 纳米混悬剂,在-30 ℃下预冻2 d 后在-20 ℃下真空冷冻干燥1 d,称定粉末质量M0,计算载药量,公式为载药量=(M2/M1)×100%。结果,3 批样品平均载药量为18.02%。
2.7 冻干粉制备 课题组前期考察了不同冻干保护剂(甘露醇、乳糖、蔗糖)、用量(4%、5%、6%、7%)对粒径、外观的影响,发现以6%甘露醇为冻干保护剂时粒径增加程度最小,外观饱满。取纳米混悬剂混悬液适量,加入6% 甘露醇,在-30 ℃下预冻2 d 后在-20 ℃下真空冷冻干燥1 d,于3 h 内将温度缓慢升高至25 ℃,取出,即得,外观见图3,蒸馏水复溶后,测得其平均粒径为257.23 nm,PDI 为0.240,Zeta 电位为-31.75 mV。

图3 冻干粉外观Fig.3 Appearance of lyophilized powder
2.8 稳定性考察 取纳米混悬剂及其冻干粉适量,置于恒温恒湿箱中(温度25 ℃,相对湿度60%),于0、5、10、15、30、45、60 d 取样,测定冻干前后粒径、Zeta 电位,结果见表5。由此可知,纳米混悬剂放置60 d 后粒径变大,Zeta 电位绝对值变小,而将其制成冻干粉后两者变化趋势明显变缓,表明冻干有助于提高其稳定性。
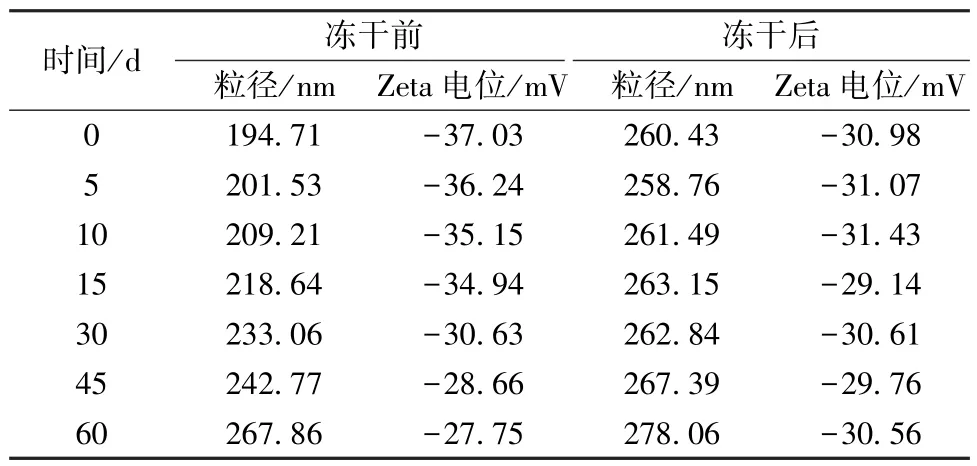
表5 稳定性考察结果(n=3)Tab.5 Results of stability investigation(n=3)
2.9 体外释药研究 取原料药、磷脂复合物、纳米混悬剂、物理混合物(比例同纳米混悬剂)粉末适量(芹菜素含量均为4 mg),加入5 mL 1%SDS 溶液制成混悬液[15],置于活化后透析袋中(截留分子量8 000~14 000 Da),细尼龙绳扎紧两端,以1 000 mL 1.5% SDS 溶液为介质,在温度(37±1)℃、转速100 r/min 下于0、0.15、0.3、0.5、0.45、1、1.5、2、4、6、8、10、12 h 各取样3 mL,并补加3 mL 空白溶出介质,0.45 μm 微孔滤膜过滤,在“2.2.1” 项色谱条件下进样测定,计算累积溶出度,结果见图4。由此可知,原料药12 h 内累积溶出度为21.84%,而磷脂复合物提高至42.16%,纳米混悬剂更达94.53%,表明虽然物理混合物累积溶出度有所提高,但仍明显低于纳米混悬剂。
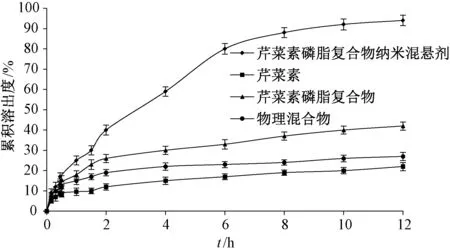
图4 芹菜素体外释药曲线(n=3)Fig.4 In vitro drug release curves for apigenin(n=3)
2.10 体内药动学研究
2.10.1 灌胃液制备 取原料药、磷脂复合物、纳米混悬剂冻干粉适量,0.5%CMC-Na 溶液制成混悬液,即得(以芹菜素计,质量浓度为8 mg/mL)。
2.10.2 分组、给药与采血 18 只大鼠禁食12 h后随机分为3 组,每组6 只,按60 mg/kg 剂量给予“2.10.1” 项下灌胃液,原料药、磷脂复合物组于0.5、1、1.5、2、3、4、6、8、10 h 眼眶静脉丛取血各约0.3 mL 至肝素化离心管中,纳米混悬剂组增加12 h 取血点,取血期间补充适量生理盐水,全血3 000 r/min 离心2 min,取上层血浆至空白离心管中,标记后密封,置于-20 ℃冰箱中。
2.10.3 血浆处理 参考文献[4]报道,血浆室温缓慢解冻后吸取0.1 mL,置于离心管中,依次加入10 μL 冰醋酸、1.5 mL 甲醇,涡旋振荡3 min,6 000 r/min 离心6 min,吸取上清液,45 ℃氮气缓慢吹除有机溶剂得残留物,加入0.1 mL 甲醇涡旋复溶,6 000 r/min 离心6 min,进样分析。
2.10.4 血浆对照品溶液制备及线性关系考察 取芹菜素对照品适量,甲醇制成8、4、1、0.5、0.1、0.05 μg/mL 溶液,分别精密取0.1 mL,45 ℃氮气缓慢吹除甲醇,残留物加入0.1 mL 空白血浆,即得血浆对照品溶液,按“2.10.3” 项下方法处理,在“2.2.1” 项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=0.452 7X-2.361 4(r=0.993 4),在0.05~8 μg/mL 范围内线性关系良好。
2.10.5 方法学考察 取空白血浆、血浆对照品溶液(0.05 μg/mL)、磷脂复合物灌胃给药10 h 后的血浆样品适量,在“2.2.1” 项色谱条件下进样测定,结果见图5,可知色谱峰分离度理想,方法专属性良好。制备0.5 μg/mL 血浆样品,于0、3、6、12、18、24 h 在“2.2.1” 项色谱条件下进样测定,测得芹菜素峰面积RSD 为1.94%,表明样品在24 h 内稳定性良好。取高(8 μg/mL)、中(1 μg/mL)、低(0.05 μg/mL)质量浓度血浆对照品溶液,分别在“2.2.1” 项色谱条件下进样测定6 次,测得芹菜素峰面积RSD 分别为7.52%、10.61%、8.04%,表明仪器精密度良好。取空白血浆适量,甲醇制成8、1、0.05 μg/mL 溶液,在“2.2.1” 项色谱条件下进样测定,并与配制时的质量浓度进行比较,即为方法回收率,结果分别为90.07%、91.24%、93.19%,RSD 分别为7.11%、3.08%、5.93%。取8、1、0.05 μg/mL 血浆对照品溶液及相同质量浓度的对照品溶液适量,在“2.2.1” 项色谱条件下进样测定,计算两者峰面积比值,即为萃取回收率,结果分别为96.33%、93.07%、94.26%,RSD 分别为7.02%、4.73%、6.65%。
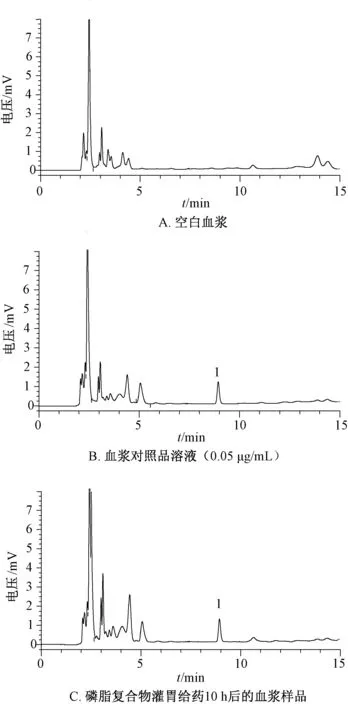
图5 芹菜素HPLC 色谱图Fig.5 HPLC chromatograms of apigenin
2.10.6 结果分析 绘制血药浓度-时间曲线,再采用3P97 程序统计矩模型计算主要药动学参数(tmax、t1/2采用非参数法秩和检验,Cmax、AUC 经对数转换后采用t检验),结果见图6、表6。由此可知,与原料药比较,磷脂复合物t1/2延长(P<0.05),Cmax、AUC0~t、AUC0~∞升高(P<0.01),相对生物利用度提高至1.73 倍;与原料药、磷脂复合物比较,纳米混悬剂tmax缩短(P<0.05),t1/2延 长(P<0.01),Cmax、AUC0~t、AUC0~∞升 高(P<0.01),相对生物利用度增加至4.88 倍。
表6 芹菜素主要药动学参数(±s, n=6)Tab.6 Main pharmacokinetic parameters for apigenin(±s, n=6)
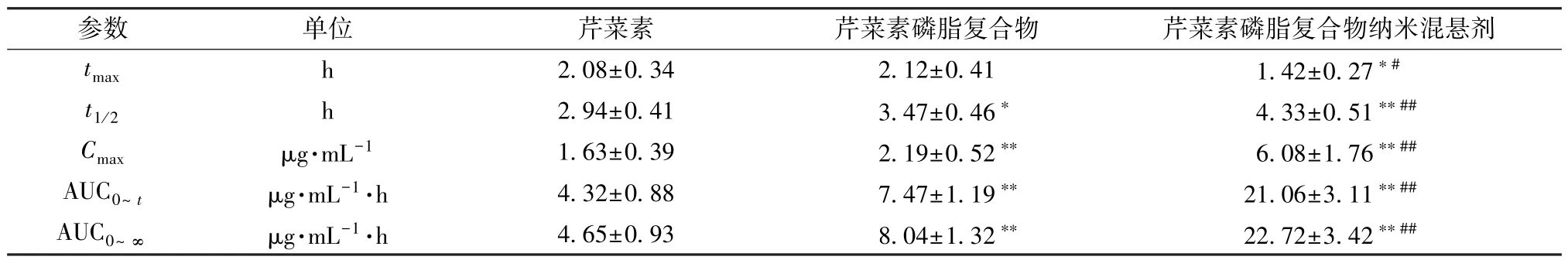
表6 芹菜素主要药动学参数(±s, n=6)Tab.6 Main pharmacokinetic parameters for apigenin(±s, n=6)
注:与芹菜素比较,*P<0.05,**P<0.01;与芹菜素磷脂复合物比较,#P<0.05,##P<0.01。
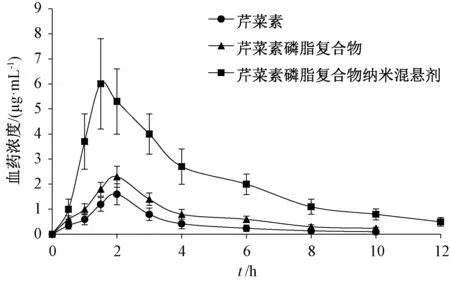
图6 芹菜素血药浓度-时间曲线(n=6)Fig.6 Plasma concentration-time curves for apigenin(n=6)
3 讨论
前期考察发现,单独采用某一种稳定剂时纳米混悬剂粒径一般在300 nm 以上,分布范围较大;将PVP K30 与SDS 联用后,纳米混悬剂粒径较小,可能是由于前者分子链较长,伸展后可形成较大的空间阻力[16-17],而后者是表面活性剂,有助于降低纳米混悬剂粒径,而且也可提供空间位阻作用[18]。于世龙[10]采用DMSO 作为溶剂,制备的芹菜素纳米混悬剂在31 d 内粒径增加了2 倍多(冻干前),可能是由于纳米混悬剂中DMSO(难以除去)影响了制剂稳定性所致。本实验引入磷脂复合物后,提高了芹菜素在无水乙醇中的溶解度[4],无需使用DMSO 即可制成纳米混悬剂,并且冻干前放置60 d 后其粒径仅增加了37.57%。
结果显示,芹菜素磷脂复合物纳米混悬剂tmax显著延长,可能是由于纳米混悬剂加快了药物释放,缩短了入血时间;累积释放度大大增加,从而使Cmax显著升高;相对生物利用度增加至4.88 倍,除了与纳米混悬剂促进药物释放、提高累积溶出度有关外,还可能涉及纳米混悬剂增强药物对肠道黏膜的黏附性、间接促进吸收、纳米药物经淋巴循环等途径进入血液循环等因素[19],从而使药动学参数发生很大变化[20]。但最终纳米混悬剂中芹菜素是以磷脂复合物的形式存在,还是以游离芹菜素的形式存在,或是两者兼有尚不明确,仍需进一步研究,并且后续还要继续完善其质量标准、注射药动学、药效评价等方面的考察。

