2022年高考电化学真题剖析
陈建托
(首都师范大学附属中学)
2022年高考电化学试题大多结合科技发展的趋势和前沿,选取真实素材,合理创设情境,设置新颖的呈现方式和设问方式,注重理论与实际的结合,彰显化学学科价值.考题稳中求进,从基础性、综合性、应用性和创新性4 个维度,对学生所表现出的必备知识、关键能力、学科素养进行综合考查.
1 2022年高考电化学试题概况
本文研究对象为2022年高考理综全国甲卷、全国乙卷等10套试卷14道考题,如表1所示.

表1
图1为各情境类型占比,很明显,新型电池以及电解原理的实际应用已成为命题主流.图2为各水平考题数量占比,电化学考题学业质量水平集中在水平3、水平4,可见高考对电化学的考查保持在较高要求和较高难度.
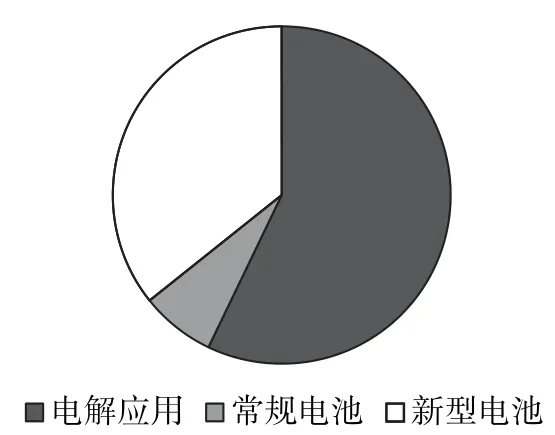
图1
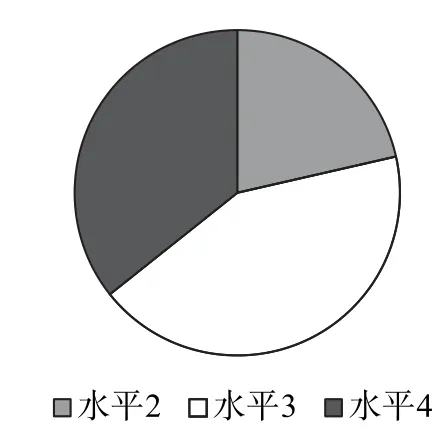
图2
2 考点剖析
无论题目情境如何新颖,其考点主要集中在电极方程式书写、离子移动、守恒计算等核心问题方面.2022年电化学考题考点汇总如表2所示.
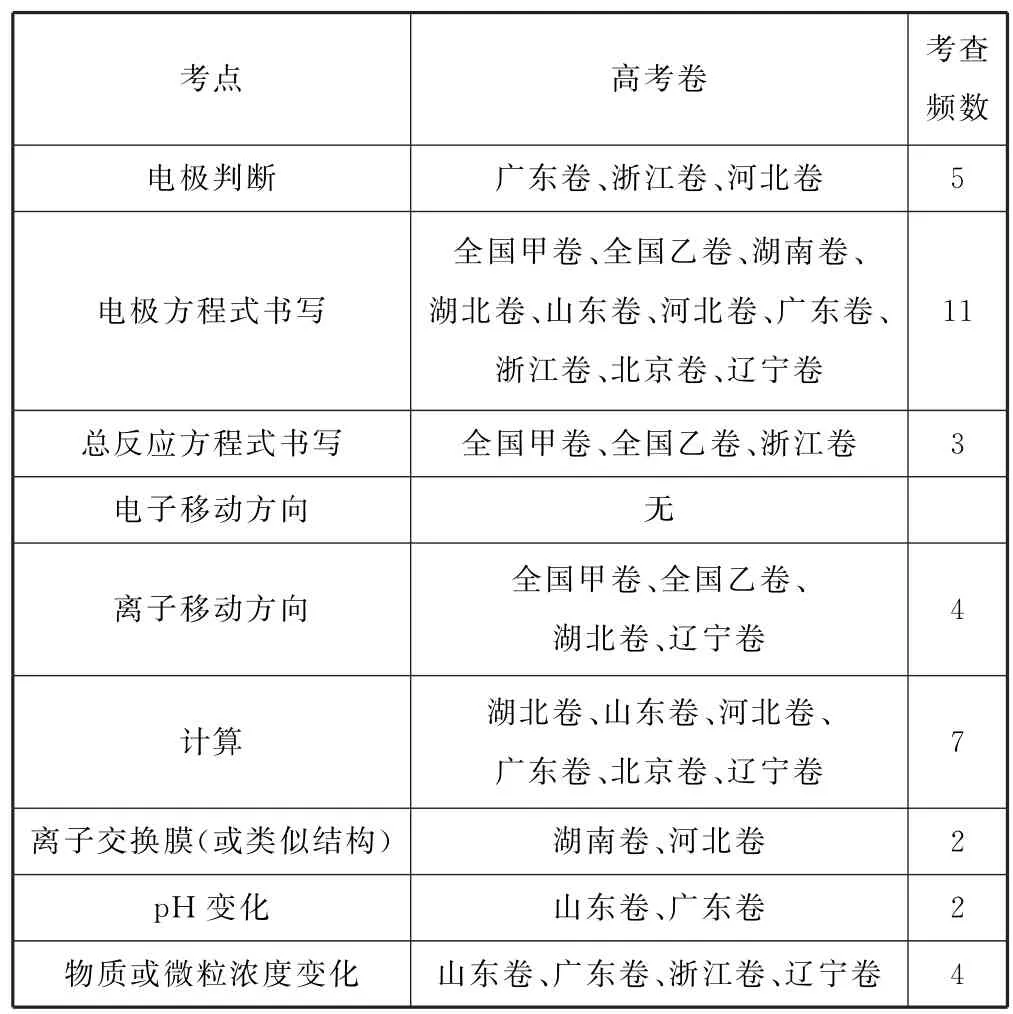
表2
电化学考查形式相对成熟,考点也比较稳定,90%的题目考查电极方程式的书写,50%的题目考查基于得失电子守恒的计算.结合图3,可以清晰看到考点分布.

图3
3 解题方法
无论是哪种题型,解题方法都万变不离其宗.明确电极是“根”,分析电极反应是“魂”,解题首先需要厘清“根”与“魂”,再由“根”与“魂”延伸至其他方面.电化学考题分析思路如图4所示.

图4
3.1 电极反应式书写
电极反应式一般可按表3所示步骤书写.

表3
基于电荷守恒补充离子,需要根据离子导体种类确定,一般补充H+、OH-、CO2-3、O2-等.基于原子守恒补充并配平其他微粒,一般需要补充H2O 以配平H、O 原子.
选择题电极反应式的正误判断一般集中在如下两个问题:得失电子的判断是否准确(或物质转化是否准确);H+、OH-等离子的选择是否准确.如2022年湖北卷第14题选项B:阴极上的电极反应为P4+8CN--4e-=4[P(CN)2]-.但阴极电极反应得电子,故该选项错误.再如2022年山东卷第13题选项C(原题见例2):乙室电极反应式为LiCoO2+2H2O+e-=Li++Co2++4OH-.由题图可知乙室电解质溶液为酸性,反应式出现OH-不合理,故该选项错误.
3.2 离子移动方向
原电池和电解池中离子移动方向取决于闭合回路中的电流方向.在离子导体中,阳离子移动方向与电流方向一致,阴离子移动方向与电流方向相反,如表4所示.

表4
3.3 pH 的变化
对于电极附近pH 的变化,可以结合电极反应式确定H+或OH-的变化来判断.对于某电极区pH 的变化则需要综合考虑电极反应式和H+迁移情况(一般装置中有质子交换膜).
3.4 计算
电化学计算的核心是抓住整个电路中得失电子守恒,基于得失电子守恒找准相关物质之间的比例关系,以2022年广东卷和山东卷为例进行分析.
例1(2022年广东卷)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图5).充电时电极a的反应为NaTi2(PO4)3+2Na++2e-=Na3Ti2(PO4)3.下列说法正确的是( ).
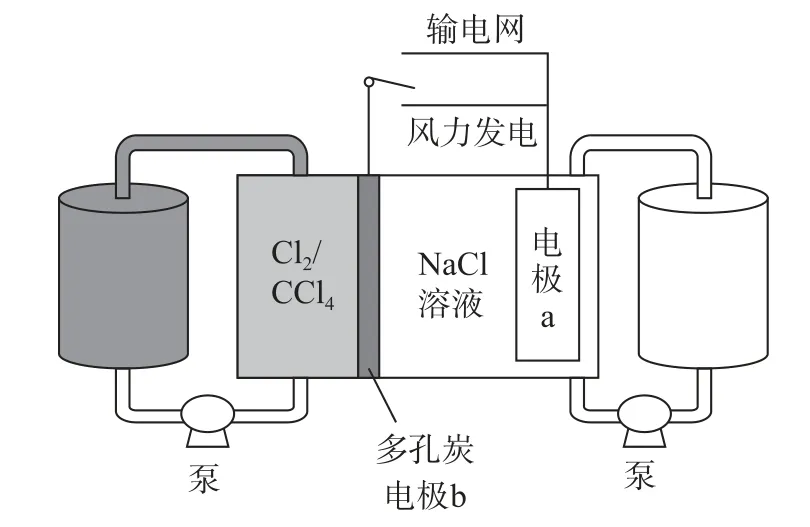
图5
A.充电时电极b是阴极
B.放电时NaCl溶液的pH 减小
C.放电时NaCl溶液的浓度增大
D.每生成1 molCl2,电极a 质量理论上增加23g
分析充电时阳极反应为2Cl--2e-=Cl2↑,阴极反应为NaTi2(PO4)3+2Na++2e-=Na3Ti2(PO4)3,由得失电子守恒可知,1Cl2~2e-~Na3Ti2(PO4)3~增重2Na+,即每生成1molCl2,电极a理论上质量增加46g,选项D 错误.分析其他选项后可知本题答案为C.
例2(2022年山东卷)设计如图6所示装置回收金属钴.保持细菌所在环境pH 稳定,借助其降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCoO2(s)转化为Co2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室.已知电极材料均为石墨材质,右侧装置为原电池.下列说法正确的是( ).
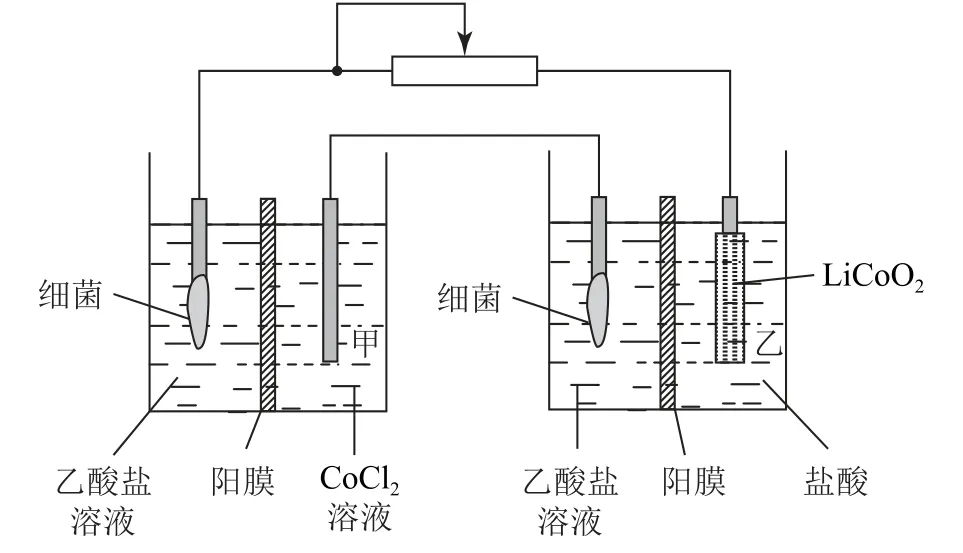
图6
A.装置工作时,甲室溶液的pH 逐渐增大
B.装置工作一段时间后,乙室应补充盐酸
C.乙室电极反应式为LiCoO2+2H2O+e-=Li++Co2++4OH
D.若甲室Co2+减少200 mg,乙室Co2+增加300mg,则此时已进行过溶液转移
分析右侧装置为原电池,左侧装置为电解池,乙室电极LiCoO2转化为Co2+,为正极,则从左至右4个电极分别为阳极、阴极、负极、正极.甲室阴极电极反应式为Co2++2e-=Co,乙室正极电极反应式为LiCoO2+e-+4H+=Li++Co2++2H2O(选项C 错误).若甲室Co2+减少200 mg,则转移电子物质的量为;若乙室Co2+增加300mg,则转移电子的物质的量为0.0051mol,转移电子的物质的量不相等,说明此时已进行过溶液转移,即已将乙室部分溶液转移至甲室,选项D 正确.答案为B、D.
4 考题剖析
例3(多选)(2022年河北卷)科学家研制了一种能在较低电压下获得氧气和氢气的电化学装置,工作原理示意图如图7所示.下列说法正确的是( ).

图7
A.电极b为阳极
B.隔膜为阴离子交换膜
C.生成气体M 与N 的物质的量之比为2∶1
D.反应器Ⅰ中反应的离子方程式为
分析由图可知,电极a上[Fe(CN)6]4-转化为[Fe(CN)6]3-,为阳极,则电极b为阴极,DHPS转化为DHPS-2H(得氢发生还原反应),选项A 错误.阳极室、阴极室电解质溶液均为NaOH 溶液,工作中OH-通过交换膜由阴极室向阳极室移动,则隔膜为阴离子交换膜,选项B正确.结合题干信息“一种能在较低电压下获得氧气和氢气的电化学装置”,可知M、N 为氧气或氢气,反应器Ⅰ中[Fe(CN)6]3-转化为[Fe(CN)6]4-,铁元素得电子,则M 为氧气(失电子产物),反应器Ⅱ中N 为氢气.基于得失电子数目守恒可知M 与N 的物质的量之比为1∶2,选项C 错误.反应器Ⅰ中[Fe(CN)6]3-与OH-反应生成[Fe(CN)6]4-和O2,离子方程式为,选项D 正确.答案为B、D.
例4(2022 年全国甲卷)一种水性电解液Zn-MnO2离子选择双隔膜电池如图8所示[KOH 溶液中,Zn2+以Zn(OH)2-4存在].电池放电时,下列叙述错误的是( ).

图8
例5(2022年全国乙卷)Li-O2电池比能量高,在汽车、航天等领域具有良好的应用前景.近年来科学家研究了一种光照充电Li-O2电池(如图9).光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-=Li)和阳极反应(Li2O2+2h+=2Li++O2)对电池进行充电.下列叙述错误的是( ).
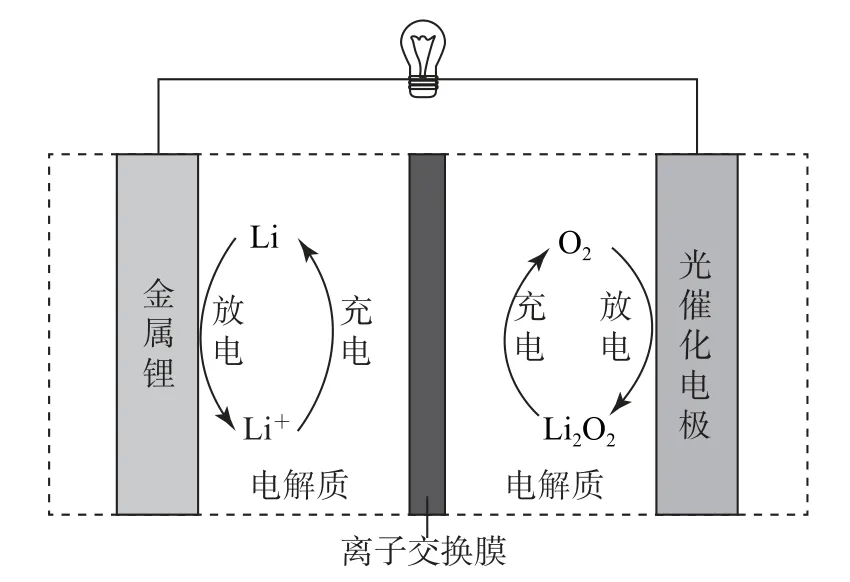
图9
A.充电时,电池的总反应为Li2O2=2Li+O2↑
B.充电效率与光照产生的电子和空穴量有关
C.放电时,Li+从正极穿过离子交换膜向负极迁移
D.放电时,正极发生反应:
分析充电时,阴、阳极反应相加得到总反应:Li2O2=2Li+O2↑,选项A 叙述正确.充电时,阴极反应和阳极反应分别需要电子(e-)和空穴(h+)驱动,所以充电效率与光照产生的电子和空穴量有关,选项B叙述正确.放电时,Li+向正极迁移,选项C 叙述错误.可充电电池电极对应关系:充电阳极(失电子)~放电正极(得电子),充电阴极(得电子)~放电负极(失电子).放电时正极反应对应充电时阳极反应反向进行,得正极反应为O2+2Li++2e-=Li2O2,选项D 叙述正确.答案为C.
例6(2022年湖南卷)海水电池在海洋能源领域备受关注,一种锂海水电池构造示意图如图10所示.下列说法错误的是( ).
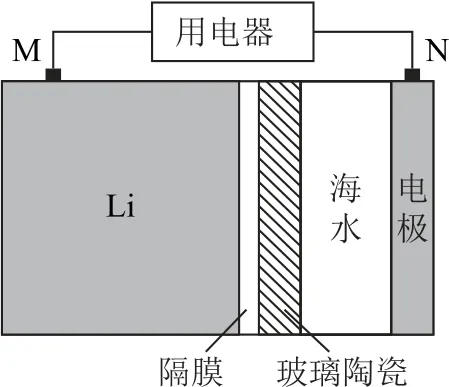
图10
A.海水起电解质溶液作用
B.N 极仅发生的电极反应:2H2O +2e-=2OH-+H2↑
C.玻璃陶瓷具有传导离子和防水的功能
D.该锂海水电池属于一次电池
分析海水中含有NaCl、MgCl2等,可作为电解质溶液,选项A 正确.M 极Li失电子为负极,N 极为正极,H2O 在N 极得电子生成H2,同时氧气也可以在N 极得电子,即还存在电极反应:O2+4e-+2H2O=4OH-,选项B错误.Li为活泼金属,可以与水反应,玻璃陶瓷不仅传导离子还可以防止水和Li反应,选项C正确.观察电池构造示意图,该电池不可充电,属于一次电池,选项D 正确.答案为B.
未来高考电化学命题会延续以化学学科核心素养为导向、以真实情境为载体的形式.教师要注重情境化教学,引导学生解决实际问题,从认识模型向问题解决模型转化,促进学生学科核心素养的发展.
(完)

