基于Box-Behnken响应面法优化紫苏叶挥发油提取工艺的研究
陶晓倩,张强,付慧敏,张纯刚,2,3*,程岚*(. 辽宁中医药大学药学院,辽宁 大连 6620;2. 长治医学院药学系,山西 长治 046000;3. 祈蒙股份有限公司,内蒙古 赤峰 024330)
紫苏叶为唇形科植物紫苏Perilla frutescens(L.)Britt.的干燥叶(或带嫩枝)[1],是我国的传统中药材,是卫生部颁布的首批既是食品又是药品的60种中药之一[2]。紫苏叶中含有丰富的挥发油,主要包括紫苏酮、紫苏醛、紫苏烯、石竹烯、α-法尼烯等31种成分,可分为紫苏酮(PK)型、紫苏醛(PA)型、芳香族化合物(PP)型、香薷酮(EK)型、紫苏烯(PL)型五个化学型[3],其中以紫苏酮含量较多的PK型和以紫苏醛及柠檬烯含量较多的PA型为主流化学型[4]。紫苏叶挥发油(以下简称紫苏叶油)具有多种生物活性,包括抗氧化、抗菌、抗过敏、抗抑郁、抗炎、抗肿瘤、神经保护等[5]。研究表明,紫苏叶油中的紫苏醛是重要的活性成分,具有治疗口咽念珠菌病的抗真菌作用[6];治疗结肠炎小鼠模型的抗炎活性[7];治疗与氧化应激有关疾病的潜在抗氧化作用[8]等。
水蒸气蒸馏法是最经典、最常用的挥发油提取方法,具有操作简单、设备要求不高、成本低廉、适合工业化生产等特点[9],多年来仍为挥发油提取的国标方法[10]。紫苏醛作为紫苏叶油中重要的有效成分,以其为评价指标优化紫苏叶油的提取工艺尚未见报道。本研究在单因素试验的基础上,以紫苏叶油提取率与紫苏醛含量为评价指标,以料液比、浸泡时间、加热时间为考察因素,利用Box-Behnken响应面法优化紫苏叶油的提取工艺,以期为紫苏叶的开发利用及深入研究提供参考。
1 材料
1.1 试药
紫苏叶购自安徽亳州药材市场,经辽宁中医药大学许亮教授鉴定为唇形科紫苏Perilla frutescens(L.)Britt.的干燥叶(或带嫩枝)。紫苏醛对照品(中国食品药品检定研究院,批号:111806-201806,纯度:95.7%),甲醇(瑞典欧森巴克化学公司,色谱纯),甲醇(天津市科密欧化学试剂有限公司,分析纯),纯净水(杭州娃哈哈集团有限公司)。
1.2 仪器
LC-1100高效液相色谱仪(美国安捷伦公司,包括四元泵,VWD可变波长扫描紫外检测器,Chemstations化学工作站),CP225D十万分之一电子天平[赛多利斯科学仪器(北京)有限公司],SG3300H超声波清洗器(上海冠特超声仪器有限公司),TGL-16G高速离心机(上海安亭科学仪器厂),DZTW调温电热套(北京市永光明医疗仪器有限公司),高速多功能粉碎机(永康市铂欧五金制品有限公司),挥发油提取器(太原三益生物有限公司)。
2 方法与结果
2.1 紫苏叶油提取
参考《中国药典》2020年版(四部)通则2204挥发油测定法[11],取剪碎的紫苏叶适量,置于烧瓶中,加水适量,摇匀混合后,浸泡一定时间,连接挥发油测定器与回流冷凝管。自冷凝管上端加水,使充满挥发油测定器的刻度部分并溢流入烧瓶时为止。置电热套中缓缓加热至沸,从冷凝管中回流下第一滴油水混合物时开始计时,保持微沸,一定时间后停止加热,放置1 h,吸取油层,12 000 r·min-1离心3 min,吸取油层,减重法得紫苏叶油质量(m油),其与紫苏叶的质量(m叶)百分比即为紫苏叶油提取率(m紫苏叶油)。
m紫苏叶油(%)=m油/m叶×100%
2.2 紫苏醛含量测定
2.2.1 色谱条件 色谱柱:ChromCore AR C18(4.6 mm×150 mm,5 μm);预柱:Phenomenex C18(2.0 mm×4.0 mm,5 μm);流动相:甲醇-水(75∶25,V/V);流速:1 mL·min-1;检测器:紫外检测器;检测波长:230 nm;柱温:30℃;进样量:20 μL。
2.2.2 对照品溶液制备 精密称量4.70 mg紫苏醛对照品于10 mL量瓶中,加适量甲醇,超声10 min,放至室温,定容后摇匀,得450 μg·mL-1的紫苏醛对照品储备液。准确移取0.2 mL紫苏醛对照品储备液于100 mL量瓶中,甲醇定容,即得0.90 μg·mL-1紫苏醛对照品溶液。
2.2.3 供试品溶液制备 精密称量5.00 mg紫苏叶油于10 mL量瓶中,加适量甲醇,超声10 min,放至室温,定容后摇匀。准确移取1 mL至10 mL量瓶中,定容,摇匀,过0.2 μm有机滤膜,供高效液相色谱分析用。
2.2.4 线性关系考察 精密吸取1 mL紫苏醛对照品储备液于10 mL量瓶中,甲醇定容,得45 μg·mL-1的紫苏醛对照品溶液。采用逐级稀释的方法,将上述紫苏醛对照品溶液稀释成各质量浓度为0.11、0.23、0.45、0.90、2.25、4.50、11.25、22.5 μg·mL-1的标准系列溶液。进样测定紫苏醛含量,以对照品紫苏醛的质量浓度X(μg·mL-1)和峰面积Y绘制回归曲线,得回归方程Y=86.62X-6.437(R2=0.9999),表明紫苏醛在0.11~22.5 μg·mL-1与峰面积线性关系良好。
2.2.5 专属性试验 分别取甲醇(阴性样品)、紫苏醛对照品溶液及紫苏叶油供试品溶液,进样测定,色谱图见图1。紫苏醛色谱峰与其他组分峰可达基线分离,紫苏叶油供试品与紫苏醛对照品在相同时间点出现同一色谱峰,阴性对照品无干扰,紫苏醛保留时间为5.241min。

图1 阴性样品(A)、紫苏醛对照品(B)及紫苏叶油供试品(C)的高效液相色谱图Fig 1 HPLC chromatogram of negative sample(A),perillaldehyde control substance(B)and volatile oil from perillae folium test sample(C)
2.2.6 精密度试验 取同一紫苏叶油供试品溶液,连续进样测定6次,记录紫苏醛峰面积,计算紫苏醛含量分别为1.9%、1.6%、1.6%、1.6%、1.6%、1.6%,RSD<2%(n=6),表明仪器精密度良好。
2.2.7 重复性试验 取同一批号的紫苏叶,按“2.1”项下紫苏叶油提取方法提取紫苏叶油样品6份,按 “2.2.3”项下方法制备紫苏油供试品溶液,进样测定,记录紫苏醛峰面积,计算紫苏醛含量分别为1.6%、1.6%、1.6%、1.6%、1.6%、1.6%,RSD<1%(n=6),表明方法重复性良好。
2.2.8 稳定性试验 同一紫苏叶油供试品溶液,在0、2、4、6、8、12、24 h按“2.2.1”项下色谱方法进样测定,记录紫苏醛峰面积,计算紫苏油中紫苏醛的含量分别为1.7%、1.6%、1.6%、1.7%、1.7%、1.6%、1.7%,RSD<2%,表明紫苏油供试品溶液在24 h内稳定性良好。
2.2.9 加样回收试验 向6份1 mL已知浓度的紫苏叶油样品溶液中分别加入1 mL相同浓度的紫苏醛对照品溶液,进样测定,计算加样回收率,测得平均加样回收率为99.42%,RSD<2%。表明测定方法符合要求。
2.2.10 紫苏叶油中紫苏醛含量测定 精密称量紫苏叶油适量,按“2.2.3”项下方法制备供试品溶液,进样测定,采用外标一点法计算紫苏醛含量。
m紫苏醛(%)=A2C1/A1C2×100%
其中,m紫苏醛为紫苏叶油中紫苏醛的含量,A1为紫苏醛对照品的峰面积,A2为紫苏叶油供试品的峰面积,C1为紫苏醛对照品浓度,C2为紫苏叶油浓度。
2.3 数据处理
采用Origin 2019b作图,Design-Expert 8.0.6进行响应面分析,GraphPad Prism 9进行统计学分析,P<0.05认为差异具有统计学意义。
2.4 单因素试验
2.4.1 紫苏叶前处理方式 以紫苏叶粉碎与剪碎两种前处理方式处理紫苏叶。取适量紫苏叶,分别粉碎过60目筛、剪碎,以料液比(g/mL)为1∶20加水,浸泡0.75 h,加热3 h,进样测定,比较紫苏叶油提取率及紫苏醛含量。
由图2可知,当其他试验条件相同时,紫苏叶经粉碎后挥发油含量明显降低,可能是由于粉碎过程中粉碎机运作时的产热作用,导致紫苏叶油的挥发,使紫苏叶油的含量明显降低;而剪碎与粉碎得到的紫苏醛含量相差不大,故选择前处理方式为剪碎。
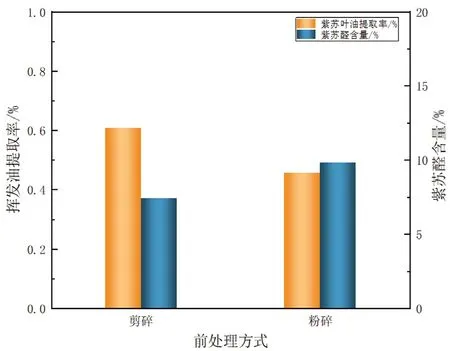
图2 前处理方式对紫苏叶油提取率及紫苏醛含量的影响Fig 2 Effect of pretreatment on the extraction yield of volatile oil from perillae folium and perillaldehyde content
2.4.2 料液比 取适量紫苏叶,剪碎,分别以料液比1∶10、1∶12、1∶15、1∶20、1∶25加水,浸泡0.75 h,加热3 h,进样测定,比较紫苏叶油提取率及紫苏醛含量。
随着加水量的增加,紫苏叶油提取率与紫苏醛含量均显著增加,当料液比为1∶20时,紫苏叶油提取率达到最高(0.607%),而当料液比为1∶12时紫苏醛含量达到最大(10.332%),之后紫苏叶油提取率与紫苏醛含量均随加水量的增加而显著降低。当加水量增大时,有利于紫苏叶油及紫苏醛在水蒸气中的扩散和溶解;但是当加水量过大时,加热时间相对延长,相同加热时间内生成的紫苏叶油及紫苏醛含量减少,且易造成资源浪费。因此选择料液比1∶12、1∶16、1∶20三个水平进行响应面优化。
2.4.3 浸泡时间 取适量紫苏叶,剪碎,以料液比1∶20加水,分别浸泡0、0.5、0.75、1、2 h,加热3 h,进样测定,比较紫苏叶油提取率及紫苏醛含量。
随着浸泡时间的增加紫苏叶油提取率显著升高,当浸泡时间达到0.75 h时,紫苏叶油提取率达到最大值(0.607%)。而紫苏醛含量随浸泡时间的增加呈显著下降趋势,综合选择0.5、0.75、1 h进行响应面优化。
2.4.4 加热时间 取适量紫苏叶,剪碎,以料液比1∶20加水,浸泡0.75 h,加热1、1.5、2、3、4 h,进样测定,比较紫苏叶油提取率及紫苏醛含量。
随着加热时间的增加紫苏叶油提取率显著升高,当加热时间达到3 h时,紫苏叶油提取率达到最大值。随着加热时间的增加紫苏醛含量下降,综合考虑选择加热2、3、4 h进行响应面试验考察。
2.5 响应面优化试验设计
2.5.1 响应面试验设计及结果 根据Design-Expert 8.0.6软件的Box-Behnken试验设计原理,综合单因素影响试验结果,以料液比(A)、浸泡时间(B)、加热时间(C)为考察因素,进行三因素三水平试验,因素与水平设计见表1。
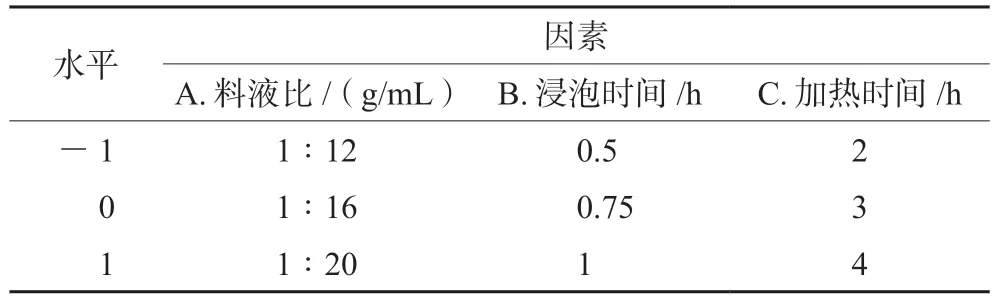
表1 Box-Behnken设计因素与水平表Tab 1 Factor and level of Box-Behnken design
根据Design-Expert 8.0.6软件设计条件进行试验,测定不同条件下紫苏叶油的提取率及紫苏醛含量,试验设计及结果见表2。
2.5.2 回归模型的建立和方差分析 以紫苏叶油提取率为响应值,利用Design-Expert 8.0.6软件对表2中的试验结果进行分析,得到紫苏叶油提取率的多元二次回归方程为R=0.51+0.048A+0.033B+0.038C-6.725×10-3AB-0.024AC-1.750×10-3BC-0.046A2-0.028B2-6.902×10-3C2。由表3回归模型方差分析表可知,一次项A、B、C和二次项A2对提取得到的紫苏叶油提取率影响极显著,交互项AC和二次项B2对提取得到的紫苏叶油提取率影响显著,其他因素影响不显著。影响紫苏叶油提取率的因素顺序为:A>C>B,即料液比>加热时间>浸泡时间。此模型的P=0.0005,响应面回归模型达到了显著水平(P<0.01),失拟项(P=0.2985>0.05)不显著,变异系数3.93%(<10%),说明非试验因素对结果影响不大,模型具有较好的试验稳定性。模型相关系数R2为0.9578,说明实际试验中约95.78%的结果可以通过拟合模型进行解释,拟合效果较好,试验误差较小。校正后的决定系数为0.9035,说明该模型能解释响应值变化的90.35%,因此该方程能很好地预测和解释紫苏叶油提取率随各个影响因素变化的规律。

表2 响应面试验设计及结果Tab 2 Response surface test design and results
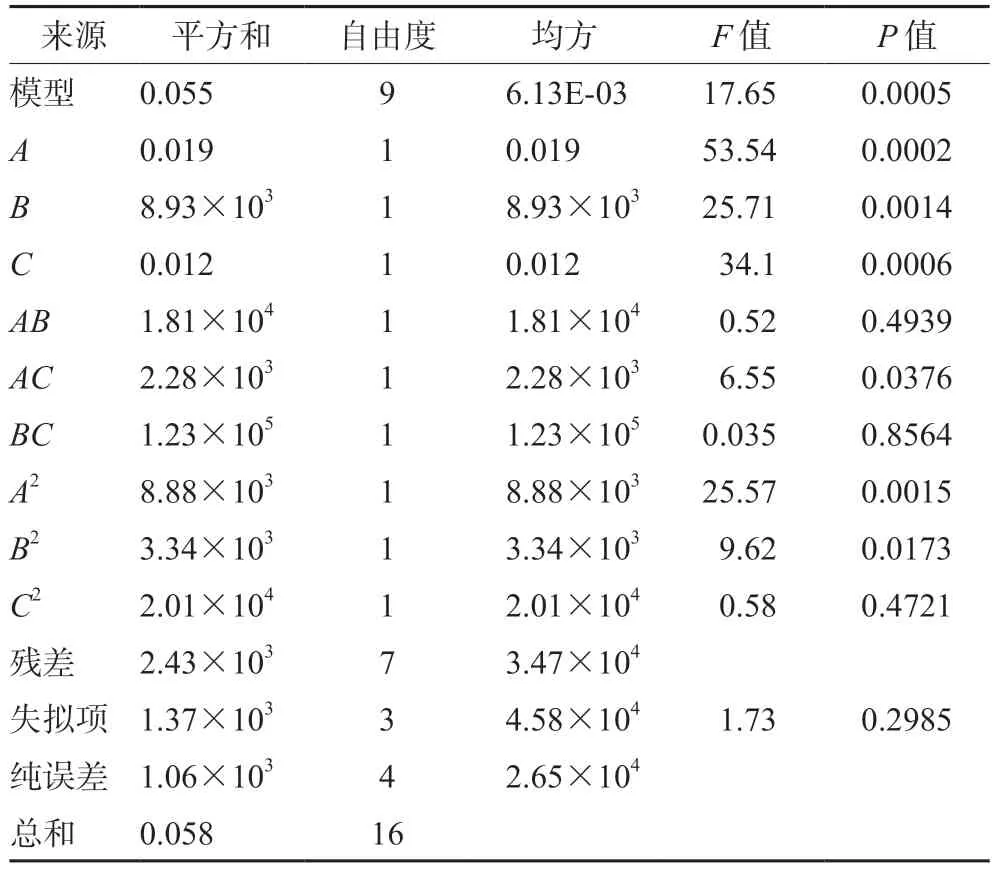
表3 回归模型方差分析Tab 3 Variance analysis for the regression model
以紫苏醛含量为响应值,利用Design-Expert 8.0.6软件对表2中的试验结果进行分析,得到紫苏醛含量的多元二次回归方程为R=9.54-0.089A-0.47B-0.99C-0.29AB-0.039AC+0.23BC-1.53A2+0.17B2+0.38C2。由表4回归模型方差分析表可知,一次项B、C和二次项A2对提取得到的紫苏醛含量影响极显著,二次项C2对提取得到的紫苏醛含量影响显著,其他因素影响不显著。影响紫苏醛含量的因素顺序为:C>B>A,即加热时间>浸泡时间>料液比。此模型的P<0.0001,响应面回归模型达到了极显著水平(P<0.01),失拟项(P=0.9858>0.05)不显著,变异系数3.01%(<10%),说明非试验因素对结果影响不大,模型具有较好的试验稳定性。模型相关系数R2为0.9751,说明实际试验中约97.51%的结果可以通过拟合模型进行解释,拟合效果较好,试验误差较小。校正后的决定系数为0.9432,说明该模型能解释响应值变化的94.32%,因此该方程能很好地预测和解释紫苏醛含量随各个影响因素变化的规律。
2.5.3 Box-Behnken响应面分析交互作用 在回归模型方差分析结果的基础上,采用Design-Expert 8.0.6软件依据回归方程绘制等高线图及响应面图,分析料液比、浸泡时间、加热时间对紫苏叶油提取率的影响,结果见图3。等高线图与响应面图能直观反应交互作用对响应值的影响程度,曲面越陡,等高线越密集,表示影响越显著[12-15]。由图3可知,紫苏叶油提取率随料液比、浸泡时间和加热时间的升高变化幅度不同,但均呈现先增大后降低的变化趋势。料液比与加热时间的响应面曲线较弯曲且等高线呈椭圆形,表明料液比与加热时间的交互作用对紫苏叶油提取率的影响显著(P>0.05),料液比与浸泡时间的交互作用对紫苏叶油提取率的影响次之,浸泡时间与加热时间等高线趋于圆形,表明两者的交互作用对紫苏叶油的提取率影响最小。
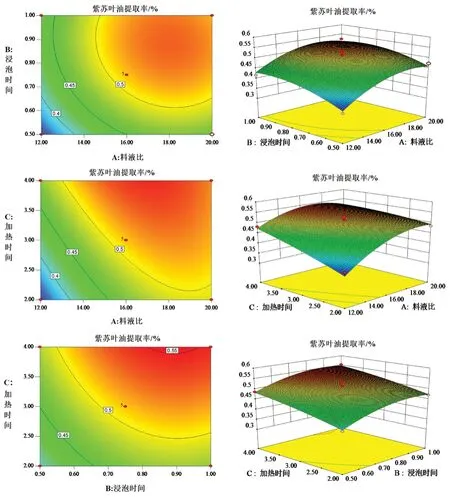
图3 各因素交互作用对紫苏叶油提取率的影响Fig 3 Effect of interaction of various factors on extraction yield of volatile oil from perillae folium
根据表4,在回归模型方差分析结果的基础上,固定料液比、浸泡时间、提取时间3个因素中的其中一个因素,其他两个因素间的交互作用对紫苏醛含量的影响可通过绘制等高线图与响应面图来表示,结果见图4。料液比与浸泡时间的交互作用对紫苏醛含量的影响最大,浸泡时间与加热时间的交互作用对紫苏醛含量的影响次之,料液比与加热时间的交互作用对紫苏醛含量的影响最小,但其交互作用对紫苏醛含量的影响均不显著。
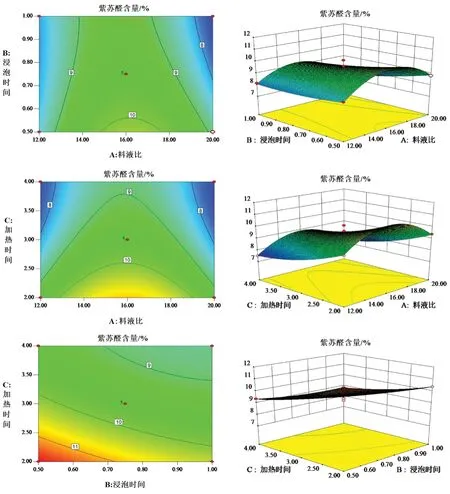
图4 各因素交互作用对紫苏醛含量的影响Fig 4 Effects of interaction of various factors on perillaldehyde content
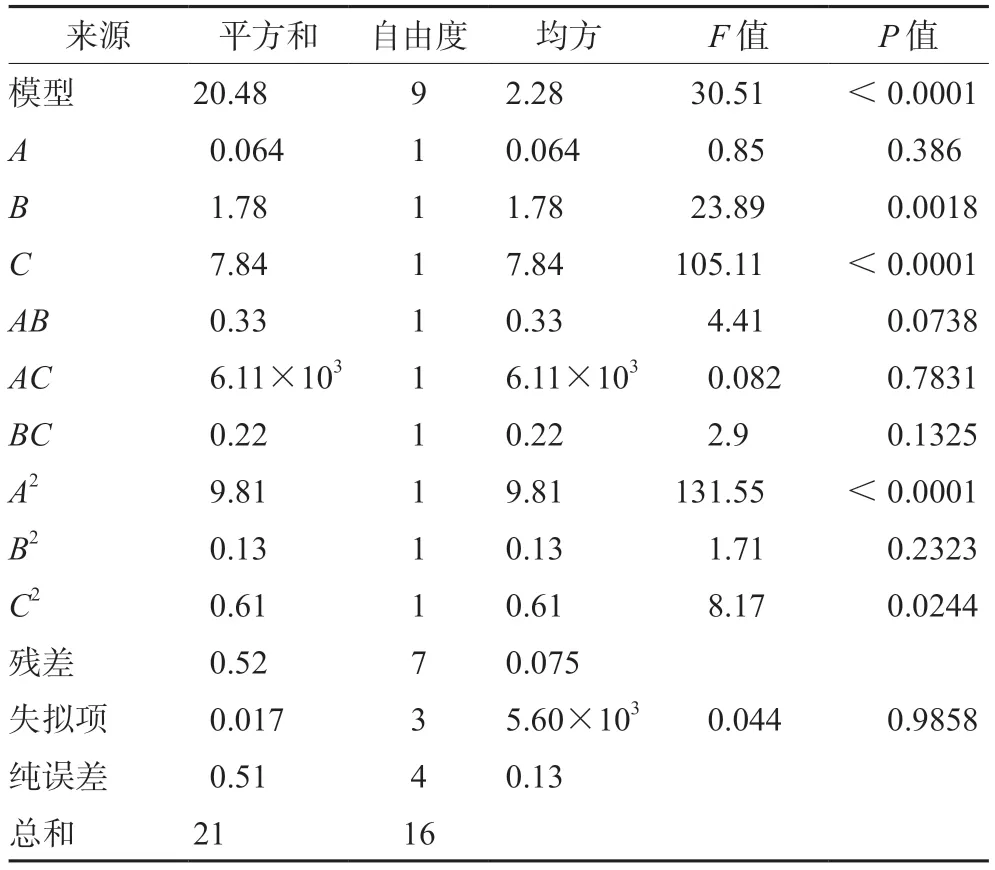
表4 回归模型方差分析Tab 4 Variance analysis for the regression model
2.6 优化工艺及验证试验
根据响应面分析软件得到紫苏叶油提取的理论最佳工艺条件为:料液比1∶17.12,浸泡时间0.68 h,加热时间2 h。且在此条件下预测的紫苏叶油提取率为0.473%,紫苏醛含量为11%。结合试验条件及实际操作的可能性,确定最佳工艺条件为:料液比1∶17,浸泡时间0.70 h,加热时间2 h。在此条件下重复3次试验,得到紫苏叶油平均提取率为0.468%,紫苏醛平均含量为10.65%。与预测值基本一致,表明该提取条件可靠,能较好地预测与分析紫苏叶油的提取工艺,具有实际应用价值。
3 结论
紫苏叶油的市场潜力巨大,可作为应用于香水中的天然香料,作为芳香疗法中的芳香药物,作为食物中的调味剂和防腐剂,作为调理人体机能的保健品,作为治疗人类疾病的新型消炎抗菌药物、抗肿瘤药物、抗抑郁药物等[10]。本研究建立了有效测定紫苏叶油中紫苏醛含量的高效液相色谱方法,并在单因素试验的基础上利用Box-Behnken响应面法对紫苏叶油的提取工艺进行了优化,得到了紫苏叶油提取率与紫苏醛含量的两个多元二次回归模型,回归模型拟合好,能很好地预测与分析紫苏叶油的提取工艺。
本研究采用紫苏叶油提取率与紫苏醛含量两个指标优化紫苏叶油的提取工艺,相较于单一地使用其中任意一个指标具有显著优势,为获得较高的紫苏叶油与紫苏醛的工业化生产提供理论及技术支持,为紫苏叶油的深入研究提供较优的工艺参数,为紫苏叶的质量控制标准提供参考。

