基于“变化观”培养的教学设计
李晶晶 徐玲
摘要:以傅兴春编写,福建教育出版社出版的《化学学科思想》作为“變化观”的理论依据,梳理了“变化观”的内涵并探讨了其教育价值,整理了 2019 年人教版高中化学教材中涉及“变化观”的核心概念,以“氧化还原反应”概念教学为例,设计促进“变化观”培养的教学活动,将“变化观”与化学学科核心素养贯穿于整个课堂教学。
关键词:氧化还原反应;变化观;化学学科核心素养;教学设计
文章编号:1008-0546(2023)07-0050-05 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2023.07.009
化学学科思想会影响学生分析和解决实际问题的价值取向和行为方式。[1]“变化观”作为化学学科思想的重要组成部分,对知识的理解及化学学科核心素养发展起着举足轻重的作用。
一、 “变化观”的内涵及价值
1. “变化观”的内涵
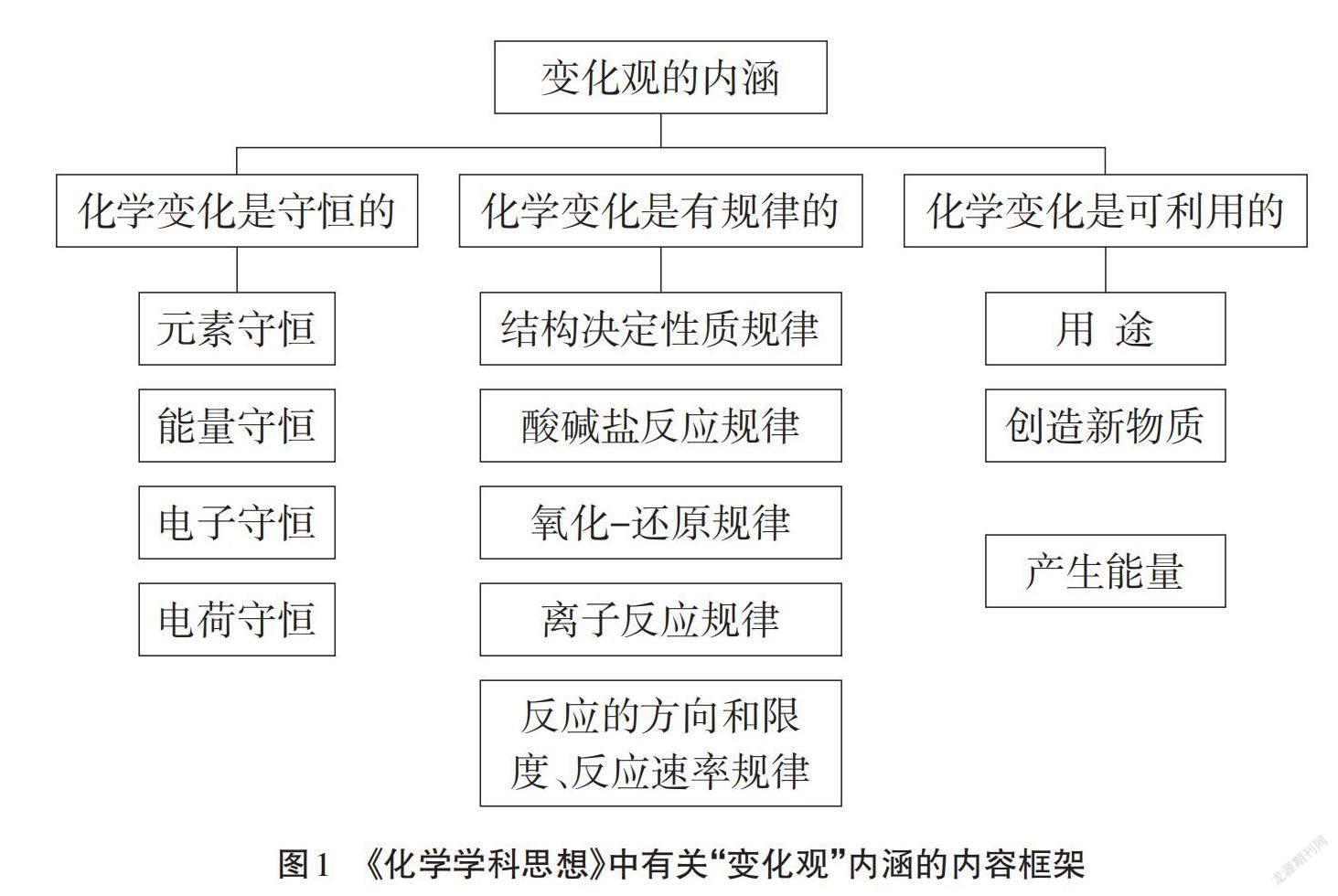
“变化观”包含三个层次内容:化学变化是守恒的、有规律的、可利用的,[1] 具体内容结构如图1所示。
2. “变化观”的教育价值
知识是基础,化学思想是灵魂。[2] 化学学科思想是促进学生学会分析和解决化学问题应具备的思维能力。 “变化观”作为化学观念体系中的重要组成部分,可以让学生实质性地理解化学变化,运用变化观念理解、分析、解决问题。促进“变化观”培养的化学教学有利于学生“变化观念与平衡思想”素养的发展。教师在教学中通过以知识为载体进行化学学科思想的培养,促进学生具备能适应终身发展和社会发展需要的必备品格。
二、教材中有关“变化观”涉及的核心概念
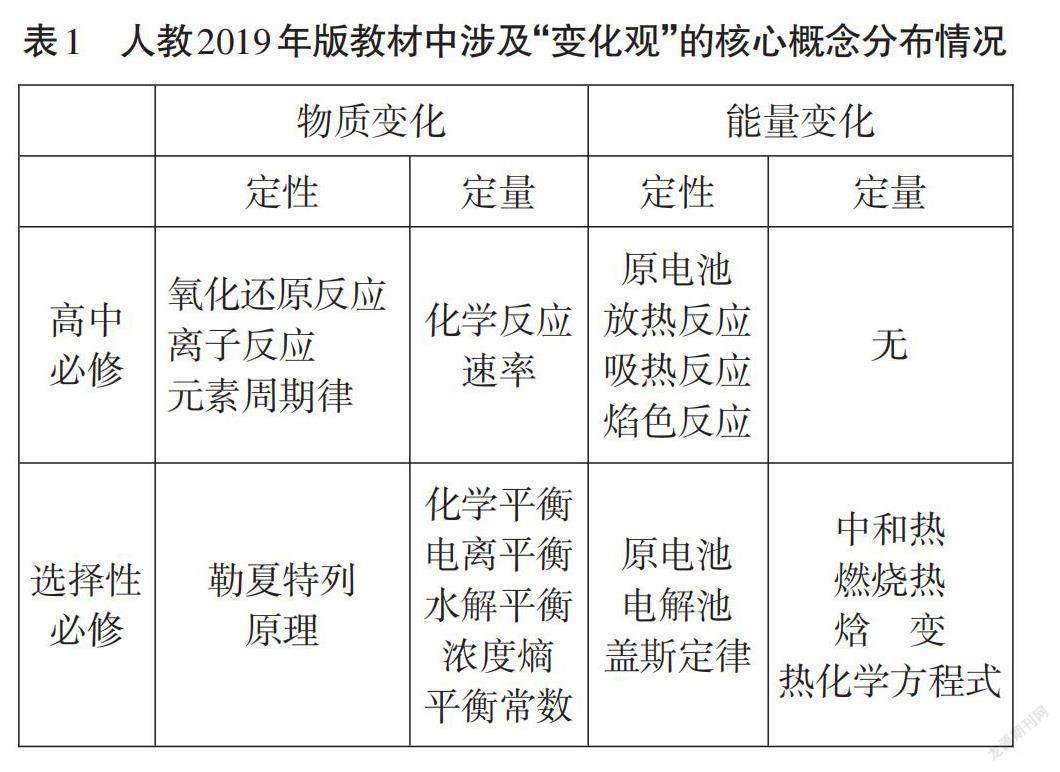
“变化观”涉及的内容贯穿整个高中阶段。以2019 年人教版教材为例,将“变化观”有关的核心概念进行整理,具体内容如表1所示。
教材中“变化观”主要从物质变化和能量变化两个一级维度来安排,其中每个一级维度又从定性和定量两个角度安排,具体内容的编排具有进阶性。[3] 高中化学必修阶段,是在初中认识化学反应基础上,对化学反应的认识编排从宏观现象阶段进入到微观认识阶段。例如:氧化还原反应的实质是电子转移、离子反应实质是有离子的参与等。此外,解释了化学反应不仅有物质变化还有能量变化,从而引入吸热反应、放热反应和原电池等概念。高中选择性必修阶段,从热力学和动力学两个角度具体从化学反应速率、限度的角度定性认识化学变化,引入化学平衡、电离平衡、化学平衡常数、焓变等核心概念并运用勒夏特列原理解释化学平衡移动。这样呈进阶式的编排,有利于学生逐步形成高中阶段的化学“变化观”。
三、 “氧化还原反应”概念教学中蕴含的“变化观”
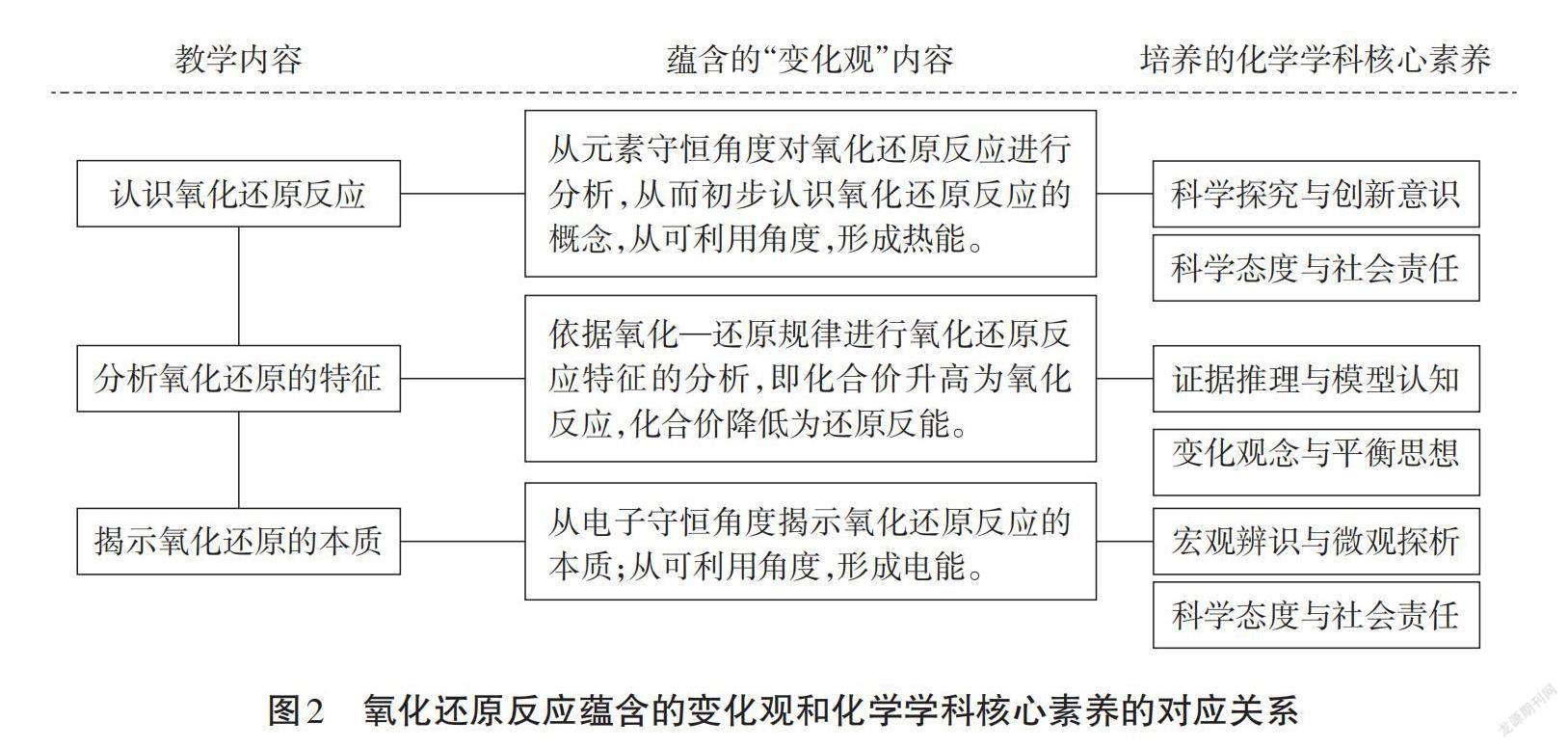
“氧化还原反应”是中学化学的核心概念,在教学中不仅要帮助学生顺利理解核心概念,还要挖掘出该概念教学中蕴含的“变化观”, “氧化还原反应”中蕴含的变化观内容及其对应培养的化学学科核心素养如图2所示。
该节课蕴含着“元素守恒”和“电子守恒”两个守恒观念,从中可以挖掘出氧化-还原的规律,从应用层面挖掘能量的可利用性,这些核心知识的教学中可以逐步培养学生的“变化观”。
四、基于“变化观”培养的“氧化还原反应”教学设计
化学科学思维是伴随着化学科学实践活动和问题解决而产生和发展的,[4] 教学中以知识和活动为载体,让学生通过学习活动理解概念的同时形成“变化观”,让“变化观”建构贯穿于整个教学过程。
1. 教学整体思路设计
本节课依据化学反应具有可利用性,将氧化还原反应产生的热能、电能作为出发点,选择“自发热鞋垫” “电动车电池”两个真实情境,设置若干个问题链,引导学生进行活动探究,探究后进行汇报、展示思维过程,再从学生汇报内容中选择恰当的反应作为探究案例,继续追问,层层递进,学生在一次次的问题解决中逐步培养变化观念,具体教学思路如图3所示。
2. 教学目标与评价目标定位
(1)教学目标
①通过对氧化还原反应现象的认识,了解氧化还原反应的概念,初步形成基于元素守恒的“变化观”。
②通过对元素化合价分析以及其与核外电子的关系,理解氧化还原的特征、实质,巩固形成基于电子守恒的“变化观”,促进学生“变化观念与平衡思想”“证据推理与模型认知” “宏观辨识和微观探析”素养发展。
③通过对生活实例进行实验探究,提高学生分析能力、探究能力,促进“科学探究与创新意识” “科学态度与社会责任”素养发展。
(2)评价目标
①通过对氧化还原反应的特征的辨识与实质的分析,诊断并发展学生“变化观”以及“变化观念与平衡思想” “证据推理与模型认知” “宏观辨识和微观探析”素养。
②通过“自发热鞋垫” “电动车电池”案例的探究,诊断并发展学生“科学探究与创新意识” “科学态度与社会责任”素养。
(3)教学活动设计
板块1:从得失氧角度了解氧化还原反应概念。
该环节让学生认识氧化还原反应概念并从质量守恒和元素守恒两个角度分析氧化还原反应,形成基于守恒的“变化观”。诊断并发展学生的实验探究能力,能从元素守恒角度分析化学变化。
教学流程:
【教师】冬天来了,我们经常会用到“暖宝宝” “自发热鞋垫”, “自发热鞋垫”中的热量是如何产生的?又发生的是什么反应?
具体的原理是怎样的?根据“自发热鞋垫”中成分说明,该反应中产生的热量来自于“碳粉”的反应还是“铁粉”反应?
【学生】进行猜想:猜想1:碳粉发生反应了氧化反应。猜想2:铁粉发生反应了氧化反应。
【教师】如何证明你的猜想?请根据大家手中现有的资源进行小组探究。
【学生】实验预测汇报:
预测1:将反应后的粉末进行称量,质量若增加,则证明反应的是铁粉,如果质量减少证明反应的是碳粉。
预测2:将粉末放入稀盐酸中后,如果粉末不溶解,不产生气泡,过滤后滤液为黄色,说明反应的是铁粉。涉及反应为:Fe 2 O 3 +6HCl = 2FeCl 3 +3H 2 O。
预测3:将粉末放入稀盐酸中后,如果粉末出现溶解现象,并产生气泡,过滤后溶液为浅绿色,说明反应的是铁粉。涉及反应为:Fe+2HCl = FeCl 2 +H 2 ↑
【学生】分组实验:实验用品及药品: “自发热鞋垫”、稀盐酸、烧杯、玻璃棒、漏斗、托盘天平、烧杯等。
【学生】实验汇报并解释:汇报1组:当鞋垫不再发热时,拆开包装,进行称量,质量有所增加,说明猜想2正确,是铁粉参加反应。汇报2组:当鞋垫不再发热时,拆开包装,发现粉末中出现有红棕色,初步判断为氧化铁,为了证明进行实验验证,根据预测进行实验验证猜想2正确,是铁粉发生了氧化反应释放了热量。
【教师】追问1:生成的Fe 2 O 3 如何还原呢?这个反应又是什么反应?
【学生】小组讨论:根据初中学过的赤铁矿炼铁,来分析反应中的得氧失氧情况,并进行小组汇报。
【教师】追问2:Fe 2 O 3 +3CO = 2Fe+3CO 2这个反应中仅仅有还原反应吗?
【学生】回答如图4。
【教师】追问3:如何定义氧化还原反应?
【学生】氧化还原反应是氧化和还原同时发生的反应。即既有得氧又有失氧的反应。
设计意图:通过“自发热鞋垫”创设真实的情境,符合建构主义理论。通过问题解决的方式,巧妙设计问题,调动学生初中已有的知识,学生从原有认知出发,根据初中学习过质量守恒、元素守恒对实际产生的问题进行初步猜想、预测、验证,诊断并发展了学生的实验探究能力。通过继续追问的方式让学生独立思考,联想初中赤铁矿炼铁的知识,从学生原有知识出发,更能调动学生主动学习的热情。通过让学生进行小组讨论,感受氧化还原反应的存在和认识氧化还原反应的概念。从化学反应可利用角度,感知氧化还原反应的应用之一是提供热量,通过真实情境创设、问题解决方式,学生在解决问题中形成“变化观”。与此同时,通过学生汇报形式的教学,让学生展示思维过程,该过程既可以锻炼学生口语表达能力又可以在学生头脑中形成解决问题的模型,同时,发展学生“科学探究与创新意识”素养。
板块2:从化合价角度识别氧化还原反应。
该环节让学生理解化合价变化是氧化还原反应的特征,并会依据化合价进行氧化还原反应的判断,从元素化合价变化角度形成氧化-还原规律。诊断并发展学生对氧化还原反应特征的认识水平以及对化学变化规律的掌握程度。
教学流程:
【教师】追问: “Fe 2 O 3 +6HCl = 2FeCl 3 +3H 2 O”是否为氧化还原反应?
【学生】Fe 2 O 3 +6HCl = 2FeCl 3 +3H 2 O无化合价变化,所以不是氧化还原反应。
【教师】反应“Fe+2HCl = FeCl 2 +H 2 ↑ 是否为氧化还原反应?你的依据是什么?
【学生】自主分析教材P 35 思考与交流的三个反应中元素的化合价,观察它们化合价在反应前后有无变化,如何变化。归纳化合价变化与氧化、还原反应的对应关系。
【学生】小组汇报:Fe+2HCl = FeCl 2 +H 2 ↑该反应为氧化还原反应。因为有化合价的变化。
【教师】追问1:Fe发生了什么反应?HCl发生了什么反应?
【学生】Fe发生了氧化反应,HCl 发生了还原反应。因为Fe化合价升高,HCl中Cl化合价降低。得出结论:氧化反应为元素化合价升高的反应;还原反应为元素化合价降低的反应。
设计意图:选择学生上一环节实验探究中涉及的反应Fe+2HCl = FeCl 2 +H 2 ↑,巧妙设置问题,环环紧扣,学生依据元素守恒规律,从化合价变化角度进行分析,学生通过对课本内容的分析、讨论,揭示氧化还原反应的特征并能以化合价作为判据判断化学反应是否为氧化还原反应,形成化合价升降与氧化-还原对应关系的规律,得出氧化—还原规律,促进“变化观”的形成。与此同时,通过让学生汇报,展示分析过程,锻炼学生根据已有条件进行分析并将知识进行迁移的能力,发展学生“证据推理与模型认知” “变化观念与平衡思想”素养。
板块3:从电子得失角度分析氧化还原反应。
该环节让学生以 NaCl、HCl的形成过程为例,从电子守恒角度分析氧化还原反应的实质,形成基于守恒规律的“变化观”。诊断并发展学生能从电子守恒角度分析化学变化。
教学流程:
【教师】家里用的电动车,电池工作时会产生电流,我们知道电流的产生是因为电子的定向移动,电动车电池中发生的反应为:
根据“电动车电池”反应原理,判断电子的转移和化合价变化的关系是怎样的?该电池涉及的反应是否为氧化还原反应呢?
【学生】小组合作寻找模型:以教材中NaCl、HCl的形成过程分析化合价变化的原因。得出结论:失去电子,化合价升高。得到电子,化合价降低。小组汇报:电池放电过程中发生了氧化还原反应,因为化合价发生了变化。
【教师】追问1:你从“自发热鞋垫”和“电动车电池”两个反应中可以得出氧化还原反应具体应用是什么?
【学生】举例说明:氧化还原反应过程中可以产生热能也可以产生电能。
【教师】发生氧化还原反应过程中可以产生热能同时也可以产生电能,我们可以利用氧化还原反应的这个性质来综合利用氧化还原反应。
设计意图:以电子守恒为依据,以具体元素原子結构特点展开分析,以具体物质生成过程帮助理解,搭建台阶引导学生对氧化还原的认识从宏观过渡到微观,理清电子的得失与化合价升降的对应关系,促进学生从宏微结合角度认识化学变化,自然而然形成“变化观”。与此同时,从电子转移会产生电流的角度出发,让学生认识化学变化的另一个应用是产生电能。在整个探究过程中发展学生“宏观辨识与微观探析” “科学态度与社会责任”素养。
五、教学反思
本节课从元素守恒、电子守恒、能量守恒三个角度出发,分别设置了不同梯度的问题,通过问题引导学生进行实验探究、积极思考、在小组讨论中从本质上了解概念的本质。本节课的创新点是不仅向学生介绍了概念,还从应用层面出发,让学生感受到氧化还原反应的应用,这符合新课标发展学生学科核心素养的要求。通过创设真实的问题情境,让学生通过解答具有挑战性的学习任务,解决真实的问题,在解决问题中培养学生的质疑精神、解决问题的能力。
著名物理学家劳厄曾说过,教育所给予人们的无非是当一切已学过的东西都忘记后所剩下来的东西。化学教学要引导学生学习化学的基本原理和方法,形成化学学科的核心观念。[5]“变化观”作为化学核心观念,可以让学生深入理解化学核心概念、洞悉化学变化的本质,基于“变化观”养成的化学教学设计,可以让学生学会用“变化观”来理解化学变化,从而更好地创造物质。
参考文献
[1] 傅兴春. 化学学科思想[M]. 福州:福建教育出版社,2017.
[2] 王希俭. 基于化学学科观念培养的“铝”的教学[J]. 中学化学教学参考,2015(8):86-88.
[3] 吴晗清,王连琏. 化学观念体系及其教学研究—以变化观为例[J]. 化学教学,2022(1):3-7,26.
[4] 胡欣阳,毕华林. 化学科学思维的内涵及其发展路径—让学生像化学家一样思考[J]. 化学教育(中英文),2022,43(5):1-7.
[5] 中华人民共和国教育部. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京:人民教育出版社,2020.

