植物响应铀胁迫的防御机制研究进展
乔新燕,曹少飞,刘强强,王欣妮,原 寒
(中国辐射防护研究院 中核核环境模拟与评价技术重点实验室,山西 太原 030006)
在铀矿采冶和铀资源利用过程中,放射性核素(如铀、钍和镭)和一些相关重金属(如铅、砷、汞、镉)会释放到环境中,导致该区域土壤和水受到放射性和重金属污染[1-3]。铀具有放射性,其半衰期长,是一种典型的工业污染物[4-5]。土壤和水中的铀可通过食物链进入人体,在组织中被快速吸收和积累;铀在组织和细胞中可以释放α射线,过多的铀积累会对人体组织造成不可逆转的伤害[6-7]。因此急需治理土壤和水中的铀。
植物修复是利用植物提取和固定功能降低土壤和水介质中的铀浓度,具有成本低、环境友好、操作简单等特点,已成为热门研究领域之一[8][9]58[10]43。但铀作为一种植物非必需元素,易附着、累积在植物体内,当浓度超过阈值时,会抑制植物生长,甚至导致植物死亡[11]。植物已进化出一系列耐受铀胁迫的策略,可通过单独或联合作用减轻铀对植物的毒害症状[12]129[13]3520。对于铀耐受机制的研究有助于阐释植物对铀的吸收和转运机制,也有助于将植物修复应用于生产,实现更高的经济增长、更好的生态效益。
1 植物响应铀胁迫的功能区域化防御机制
1.1 细胞壁防御
用0~200 mg/L的UO2(NO3)2·6H2O溶液处理少根紫萍(Spirodelapunctata(G. Meyer) C. H. Thompson)发现,在根细胞亚细胞成分中,铀的积累量随溶液铀浓度的增加而增多,在处理组中铀积累最多的是细胞壁,其次是细胞器,最少的是胞质;当用200 mg/L的UO2(NO3)2·6H2O溶液处理120 h后,少根紫萍的细胞壁、细胞器、胞质中铀浓度比是8∶2∶1,但后期细胞壁中铀浓度的增加比例明显要小于细胞器和胞质中的铀浓度增加比例[12]122。这说明积累在根细胞壁中的铀超出了植物的耐受性,超出的铀会进入细胞内部对其造成损伤。
用0、100、200、400、600、800、1 000 μmol/L的UO2(NO3)2·6H2O溶液处理菜豆(PhaseolusvulgarisL.)7 d发现,随着溶液铀浓度的增加,亚细胞成分中积累的铀也增加,且主要积累在胞质和细胞壁中,仅有小部分铀贮存在细胞器中;同时随着溶液铀浓度的增加,分配到胞质中铀的比例逐渐减小,但细胞壁中铀的积累占比呈上升趋势,细胞器中铀的占比始终低于5%[14]1351。可见细胞壁作为抗铀胁迫的第1道屏障,使铀在细胞壁和液泡中区域化是植物细胞耐受铀和缓解铀对植物毒害的机制之一。
通过用不同铀质量浓度(0.5、1.0和3.0 mg/L)的废水对满江红-鱼腥藻进行水培15 d,发现满江红-鱼腥藻各组分中的铀含量分布从高到低依次为细胞壁、可溶性组分、细胞器,其中:细胞壁中铀占比高达87.9%~93.8%,可溶性组分中铀占比为5.5%~9.6%,而细胞器中铀占比仅为0.7%~2.5%[15]292。可见细胞壁固持是满江红-鱼腥藻降低铀胁迫的重要机制,而可溶性组分和细胞器中的铀分布较少,这降低了铀对满江红-鱼腥藻细胞正常代谢的影响。推测可能是细胞壁中固有的植酸、有机酸等与铀酰离子发生了界面反应,因此细胞壁通过阻止铀进入植物细胞内进而提高对铀的耐受性,也就是说细胞壁是积累铀的靶点[16]。
1.2 液泡防御
抗铀胁迫的另一道屏障是液泡,在一些植物细胞中液泡能占据90%的体积。将拟南芥(Arabidopsisthaliana(L.) Heynh.)种子在1/2 MS培养基上萌发48 h且垂直生长9 d后,转移到分别含0、2、50、500 μmol/L UO2(NO3)2的培养基生长5 d,利用纳米二次粒子质谱技术(NanoSIMS)分析发现,经高浓度铀(500 μmol/L)处理后,铀会优先积累在细胞壁中;利用透射电镜(TEM)和能量色散X射线光谱仪(EDX)对植株根尖组织微区的元素成分分析表明,铀进入根细胞后被隔离在液泡和细胞核中,且液泡中的铀从可溶性转为不溶性,减少了铀在细胞内的流动[17]361-362。
以上研究表明,功能区域化可使铀被限制于某一有限的区域,不能在胞质溶胶中进行自由循环,阻止铀从植物根部转运到地上部分,进而提高植物对铀的耐受性。
2 植物响应铀胁迫的植物螯合防御机制
2.1 植物螯合肽防御
植物螯合肽(PCs)是主要的金属螯合剂之一,其通式是(γ-Glu—Cys)n—X,n=2~11,X为不同的C端氨基酸,Cys中的巯基能与铀或其他重金属螯合形成复合物,由此减轻重金属对植物的毒害症状[18][19]25432,其原因主要是PC—重金属螯合物会在液泡中固定下来,功能区域化起到隔离作用,从而提高植物对重金属的耐受性[20-22]。
PC由植物螯合肽合酶催化还原性谷胱甘肽(GSH)合成,GSH是植物形成PC—U复合物的前体[23]170。拟南芥种子萌发3 d、水培种植18 d后,在25 mmol/L的238U溶液中继续生长3 d,发现其根中GSH含量明显增加,说明拟南芥可能是通过形成PC—U螯合物将铀固定下来,减少了细胞中游离的铀,从而增强对铀的耐受性[24]2130;田菁中U(Ⅵ)在胁迫条件下,接种从枝菌根,发现螯合肽合酶基因PCs3明显增加,并可能通过形成PC—U螯合物来减轻铀对植物的伤害[25]。
2.2 有机酸防御
在植物中形成有机酸—U复合物,也可提高植物对铀的耐受性。通过X射线吸收精细结构谱和SEM(扫描电子显微镜),结合蒸腾作用和新陈代谢试验,利用柠檬酸和乳酸作为添加剂,研究铀在印度芥菜(Brassicajunceavar.foliosa)根中的物种组成和根细胞中的分配,结果表明添加有机酸后,从根中转移到地上部分的铀明显增加。原因可能是:1)有机酸—U复合物减少了根中游离铀酰离子的含量;2)铀与有机酸形成复合物后,可通过质外体途径将其从根中转移到地上部分,进而提高植物对铀的耐受性[26]。
2.3 小结
以上研究表明植物螯合作用是植物通过形成PC—U复合物或有机酸—U复合物,将铀在液泡暂时储存或排出细胞加载到地上部分,减少植物体内的游离铀,从而缓减铀对细胞器的破坏和对代谢调节的影响。
3 植物响应铀胁迫的抗氧化防御机制
活性氧(ROS)在植物体内的产生和清除一般处于动态平衡状态,植物受到铀胁迫时,体内会产生过量ROS,如过氧化氢(H2O2)、超氧阴离子(O2·-)、羟基自由基(·OH)和一氧化氮(NO)[27-29]。这些ROS会对植物造成氧化胁迫,植物为了应对氧化胁迫,自身演化出了抗氧化系统,主要包括酶类和非酶类抗氧化系统。
3.1 酶类抗氧化系统
超氧化物歧化酶(SOD)是酶类抗氧化防御的第1道防线,在调节ROS平衡中起着重要的作用,植物会通过SOD催化过量超氧阴离子,并发生歧化反应生成氧和过氧化氢[30]。将在Hoagland营养液中驯化9 d的睡莲幼苗分别移植到含有5、30、55 mg/L的UO2(CH3COO)2·2H2O溶液中生长21 d,睡莲叶片中SOD的活性均明显增加。这说明植物可通过增加抗氧化活性来应对铀胁迫[10]46。
根据金属辅基的不同,植物中的SOD通常被分为3类:Cu/Zn-SOD、Fe-SOD、Mn-SOD。每一类都有细胞核的1个小基因家族编码,且亚细胞定位不同[31-32]。水培条件下用UO2(NO3)2溶液处理豌豆(PisumsativumL.)幼苗后,取地上部分样品利用PAGE(聚丙烯酰胺凝胶电泳)染色方法分析后发现,当溶液中UO2(NO3)2浓度为25 μmol/L时,均能看到Cu/Zn-SOD、Fe-SOD、Mn-SOD的电泳条带,且没有明显的变化;当溶液中UO2(NO3)2浓度为50 μmol/L时,只能看到Cu/Zn-SOD、Mn-SOD的电泳条带。这说明低浓度铀对SOD的活性没有影响,而超出一定的阈值,铀会使豌豆地上部分SOD的表达下调,抑制其活性[13]3517。
过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)会将H2O2进一步分解为H2O和O2。利用盆栽试验模拟铀污染土壤(铀污染水平18 mg/kg)的研究表明,2周大的博落回(Macleayacordata(Willd.) R. Br.)幼苗叶片中的SOD、CAT、POD和APX的活性均显著升高[9]64。将鬼针草(BidenspilosaL.)植株暴露在120 μmol/L的U(Ⅵ)溶液中,发现CAT和POD的活性均明显增加[33]。通过盆栽控制性试验研究了土壤不同浓度(0、25、50、100、200、400 mg/kg)铀胁迫对反枝苋(AmaranthusretroflexusL.)生理生化指标的影响,结果显示在中低浓度铀胁迫下,SOD、POD和CAT被激活,保持高活性水平,有效抵御了铀毒害;在高浓度铀胁迫下,3种酶活性均降低,且SOD活性低于对照值,ROS量超过了酶系统的清除能力,致使膜系统遭到破坏,而细胞质膜的损坏使细胞中积累了更多的铀[34]。
3.2 非酶类抗氧化防御系统
非酶类抗氧化防御体系主要包括一些抗氧化剂,比如GSH、非蛋白巯基(NPT)、半胱氨酸(Cys)等。
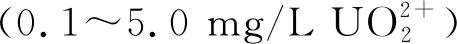
NPT和Cys富含巯基(-SH),该基团能够与进入细胞的游离铀酰离子配合形成无毒或低毒的化合物,并通过转运蛋白将这些化合物转运至胞外或储存于液泡中,从而降低其对植物细胞的毒害程度。采用水培方式研究不同质量浓度(0、0.1、1、5、10、20 mg/L)铀胁迫下香根草中NPT含量的变化,结果表明随着铀质量浓度增加,香根草植株内的NPT含量呈逐渐升高趋势[36]。豌豆在用25、50 μmol/L UO2(NO3)2溶液处理5 d后,其根和地上部分中的Cys含量都明显高于对照组[13]3516。这可能是由于低浓度铀胁迫条件下抗氧化酶系统可清除ROS,高浓度铀胁迫条件下抗氧化剂发挥主要作用。
4 植物响应铀胁迫的铀化学形态转化防御机制
随着水培溶液中铀质量浓度由0.5 mg/L升高至3.0 mg/L,满江红-鱼腥藻胞内生物毒性较大的乙醇提取态铀和去离子水提取态铀所占比例之和由60.3%降至56.4%,而毒性较小的醋酸提取态铀等所占比例之和由39.7%升至43.6%[14]293。这说明铀化学形态转化有利于满江红-鱼腥藻在铀胁迫下的生长,这是其应对铀胁迫的重要机制之一。
5 结语
对铀耐受性较好的植物能够通过功能区域化作用、螯合作用、抗氧化系统、铀化学形态转化机制,单独或联合将体内的游离铀转运到低代谢活性的器官、组织或细胞器中;但对于铀在植物体内复杂的转运系统、路径、分子机制尚不清楚。
——可作为磷酸盐库再利用!

