外生菌根真菌多样性对云杉根际土壤生化性质的影响
张晨洋,付双嘉,高浩英,王丽霞
(四川农业大学林学院/长江上游林业生态工程四川省重点实验室,成都 611130)
外生菌根(ectomycorrhizas, ECM)是高等植物根系与真菌形成的互惠共生体,它可通过菌丝扩大吸收面积或通过分泌有机酸风化原生矿物、分泌胞外酶活化有机质中固定的氮磷养分,从而增强宿主植物对养分的吸收[1-5]。ECM真菌具有丰富的多样性,不同种类或基因型的菌根真菌在生理特征、侵染程度、菌丝生长速度、分泌有机酸及胞外酶能力和类型上存在显著差异[6-7],例如K. Stuart 等[6]研究发现ECM 真菌Pisolithus albus和Pisolithus microcarpus可能由于分泌磷活化酶不同导致两者活化磷能力存在差异。此外也有研究发现[8],双色蜡蘑(Laccaria bicolor)、红褐乳菇(Lactarius rufus)和肝螺乳菇(Lactarius hepalicus)3 种不同类型的真菌对铵盐的吸收能力也明显的不同。上述菌根真菌种间差异导致菌根真菌之间出现生态位互补、竞争、促进和选择效应[7,9-11]。例如L. M. Jonsson等[10]的研究发现,由于宿主植物及土壤环境等对ECM真菌的选择作用,导致在ECM真菌群落中仅少数几种ECM真菌占据优势地位,从而与其他ECM真菌在土壤资源利用方面产生竞争作用,进而抑制了其他菌根真菌的繁殖及功能发挥。其次,关于菌根真菌物种间的互补作用,随宿主植物根系侵染的ECM 真菌种类的增多,能够分泌的有机酸和胞外酶等种类也将增多,其服务宿主植物吸收利用土壤养分的能力也将进一步增强。因此具有较高多样性的菌根真菌群落和其群落内的个体差异可能对寄主生长和营养获取有重要的影响[11]。且这些种内和种间效应也是支撑生物多样性-生态系统功能关系的主要机制,同时也赋予了生态系统应对环境变化的绝佳恢复力[12-13]。因此,研究外生菌根真菌的种内和种间多样性对生态系统功能的维持和提升有重要的作用[14-15]。目前对ECM真菌多样性的研究,主要集中在气候变化及环境因子对ECM真菌多样性的影响[16-18],以及ECM真菌丰度、丰富度、侵染率等对植物养分吸收及生长的影响[19-21]。关于ECM 真菌接种的研究较少,且接种试验研究多集中于单一ECM 真菌种类对植物生物量及生长特征的影响,或接种ECM真菌对提高宿主抗逆性的研究[21-24]。而关于不同多样性的ECM真菌接种对植物根际土壤生化性质影响的研究相对缺乏[25]。云杉(Picea asperata Mast.)隶属于松科云杉属,为四川亚高山区重要组成树种。近些年来,由于人类活动的影响,造成川西森林生态系统严重退化。虽然在原始林中进行了大规模的人工造林(已成为该区森林的重要组成部分),但是由于物种单一,生态功能难以恢复。因此导致该区域环境恶化、生物多样性锐减,森林生态逆向演替明显,因此加强恢复亚高山人工针叶林退化生态系统和生态功能,使其能够持续天然更新是当前面临的主要任务。而目前关于川西人工林天然更新的研究还主要集中于林窗形成对云杉种子萌发的影响[26];粗枝云杉的土壤微生物生物量碳、氮及功能群组成分析[27];以及云杉人工林分结构调控下植物与土壤动物多样性的调查等[28]。而在亚高山人工针叶林的生态恢复过程中,有重要调控作用的地下菌根真菌多样性还缺乏系统深入的认识。有大量研究表明宿主植物多样性与外生菌根真菌多样性呈显著正相关关系[29],同时我们在调查川西亚高山云杉人工林和天然林时发现,天然林的外生菌根真菌群落多样性要显著高于云杉人工林。基于上述研究和调查结果,针对川西亚高山人工针叶林在天然更新中所面临的土壤生态问题,我们提出川西亚高山人工林是不是由于地上宿主单一导致地下菌根真菌多样性低进而减缓土壤有机质分解而导致较低的土壤养分有效性?因此本文通过野外实践调查菌根真菌多样性与川西亚高山森林生物多样性之间的相关关系,确定对川西亚高山人工针叶林有重要影响的外生菌根真菌种类及组合,然后以川西亚高山人工针叶林主要树种云杉为研究对象,通过室内育苗培养,接种5 种多样性梯度的外生菌根真菌(对照、1、2、4和8种外生菌根真菌),并定期对土壤pH、含水率、总有机碳、可溶性有机碳、有机质、全氮(土壤中所有氮素含量)、可溶性全氮(稳定态有机氮与无机氮的中间产物)、铵态氮、硝态氮、无机氮(硝态氮和铵态氮之和)、全磷、微生物生物量碳和微生物生物量氮等物理生化性质进行测定,进而深入阐述地下菌根真菌多样性对土壤生化性质的影响机制。为菌根真菌多样性在川西亚高山人工针叶林土壤生态功能中的作用提供数据支撑。
1 材料和方法
1.1 土壤、外生菌根真菌子实体和云杉种子采集
于2019 年9 月初在四川省阿坝州理县米亚罗自然保护区人工云杉林(103°21'E,31°40'N)采集土壤(厚度约为15 cm)和云杉种子。将土壤风干后过5 mm 筛,进行高压灭菌后待用。同时,我们在云杉天然林中采集子实体8 种(图2),这些子实体在天然林中较为丰富,人工林中较为贫乏,每种采集10株至更多(经前期调查,与人工林相比,在天然林中出现频率和丰度都比较高的种类)。用毛刷将子实体附着的土壤颗粒及杂质去除,然后在40 ℃的烘箱烘至48 h,室温保存。将烘干菌株磨碎,用无菌水稀释至孢子浓度为1×106孢子/mL(利用血细胞计数器测量)时待用,具体操作参考文献[30]。
1.2 室内育苗及真菌接种
将采集的云杉种子,用30 % H2O2消毒30 min后用无菌水冲洗,将消毒并冲洗后的种子播种到含有1%葡萄糖的水琼脂培养皿上,在温度20 ℃以及连续荧光灯下萌发两周,直到主根长至10 mm 长。将云杉小幼苗移栽到含有泥炭土、珍珠岩和蛭石(2∶1∶1)的无菌植物组织培养瓶里,放置在2 m(长)×1 m(宽)×0.3 m(深)种子托盘中,在22 ℃恒温(日光:黑暗=16 h:8 h)人工气候箱中培养,每隔两周补充一次营养液,4 个月后选择长势一致的幼苗进行接种实验,接种前操作均需处于无菌环境中。将采集的亚高山针叶林云杉人工林自然生长环境的0~15 cm 表层土作为基质,风干后过2 mm 筛,进行两轮高压灭菌(121 ℃,20 min)。将土壤分装到46个花盆里,随后将上述长势一致的幼苗移栽到花盆中,每个花盆栽种一株云杉幼苗,放置在带空调气候室中培养,气候室恒定温度为20 ℃,全光谱生长灯从早晨7:30 亮至傍晚18:30,设有室内加湿器使室内湿度保持在60%。并每隔4 d给幼苗喷洒等量的水,46个花盆分为5种不同梯度的外生菌根真菌多样性接种处理,除空白对照14 个重复,其他接种处理皆是8 个重复(CK.无接种组;S1.1 种真菌接种组;S2.2种真菌接种组;S4.4种真菌接种组;S8.8种真菌接种组)。处理时用注射器将制备好的外生菌根真菌孢子液体喷洒至土壤表面,每种处理的外生菌根真菌组合见表1。如表1 所示,每种外生菌根真菌体积为25 mL(浓度为1×106孢子/mL),为了保持处理组之间的一致性,剩余体积用灭菌(无活性)的外生真菌孢子液进行补充(4 种接种处理补充100 mL;两种接种处理补充150 mL;一种接种处理补充175 mL;对照补充200 mL),具体方法参考文献[31]。

表1 外生菌根真菌种类及接种处理方式Table 1 Species and inoculation methods of ectomycorrhizal fungi mL
1.3 外生菌根真菌侵染判断及种类鉴定
从2019 年9 月接种后开始培养,直到2020 年7月按照实验处理分组收集培养后的云杉幼苗以及土壤(对照组14盆,其余处理组各8盆)。利用体式显微镜观察外生菌根真菌对云杉幼苗根系是否侵染成功。在显微镜下观察发现,S4和S8实验组各有2株幼苗未被外生菌根真菌侵染。剩余的S4均被侵染3~4 种外生菌根真菌,S8均被侵染5~8 种外生菌根真菌。S2实验组有1株幼苗未成功侵染。在S1实验组中,有2 株未成功定殖。CK 对照组中有1 株幼苗被Russula virescens侵染,因此与S1合并进行后续计算。CK 中有3 株幼苗被真菌污染,但无法用分子方法鉴定。因此,将它们从分析中删除。最后,CK 组有10 个花盆作为重复,S1、S2有7 个花盆作为重复,S4、S8试验组有6个花盆作为重复。侵染成功的外生菌根在显微镜下进行形态分类,并将每种外生菌根真菌所侵染的根尖在体式显微镜下计数,菌根侵染率(%)=(形成菌根根段数/被检根段总数)×100[32]。各处理间的外生菌根真菌侵染率见附图3。随后根据DNeasy plant mini kit(Qiagen)试剂盒的说明步骤对每种外生菌根真菌所侵染云杉根尖进行DNA 提取,再利用真菌特定引物ITS1F(CTTGGTCATTTAGAGGAAGTAA)和ITS4(TCCTCCGCTTATTGATATGC)进行扩增并测序,最终得到的序列通过NBCI(https://www.ncbi.nlm.nih.gov/)和Unite fungi(https://unite.ut.ee/)真菌鉴定网站进行比对,确认外生菌根真菌种类如下表,外生菌根真菌信息皆参考相关文献[33-40]。测序序列已储存在NBCI基因库中(登录号OL475404-OL475411)。
1.4 土壤物理生化性质测定
我们利用抖落法取云杉幼苗根际土壤[41],土壤过2 mm筛后,分为两部分,一部分鲜土用于测定土壤水分、铵态氮、硝态氮、微生物生物量碳氮、可溶性全氮和可溶性有机碳。剩余风干部分用于测定土壤pH、有机碳、全氮和全磷含量。利用电位法对土壤pH进行测定[42](水土比为2.5∶1);利用烘干法对土壤水分进行测定[43];风干土壤过100目(0.149 mm)筛后,取0.01 g,利用重铬酸钾容量法-外加热法对土壤总有机碳含量进行测定[44];取0.20 g(0.149 mm)风干土利用半微量凯氏定氮法对土壤全氮含量进行测定[45];取0.20 g(0.149 mm)风干土经过高氯酸-浓硫酸分解后,利用钼锑抗-比色法[46](波长:700 nm)对土壤全磷含量进行测定;微生物生物量碳和氮的测定采用氯仿熏蒸浸提法[47],熏蒸组用去乙醇氯仿熏蒸24 h,然后用0.5 mol/L K2SO4溶液浸提。对照组(未熏蒸),提取过程同熏蒸组。浸提液中的总有机碳和全氮采用全自动碳氮分析仪(Multi N/C 2100,Analytik Jena, Germany)测定。微生物生物量碳的转换系数采用0.45[48],微生物生物量氮的转换系数采用0.54[49]。可溶性有机碳和可溶性全氮含量使用对照组提取的总有机碳、全氮含量;取10 g 鲜土用50 mL 2 mol/L 氯化钾提取,硝态氮含量用紫外分光光度校正因数法测定[50(]波长:220 和275 nm;UV spectrophotometry(UV-1601, Shimadzu Inc.)),而铵态氮含量则用靛酚蓝-比色法进行测定[51(]波长:625 nm)。
1.5 数据处理
单因素方差分析前对数据进行正态分布及方差齐性检验,部分数据通过数据转换,当满足正态分布及方差齐性时,利用SPSS(statistical product and service solutions)软件对其进行单因素方差分析,使用LSD 方法进行事后两两比较,当满足正态分布及方差不齐时,使用塔姆黑尼方法进行事后两两比较。其余不符合正态分布数据两两比较利用非参数检验不同处理之间土壤理化指标的差异性,最后用Pearson 相关性分析检测各指标之间的相关关系,并结合Microsoft Excel 及Origin进行数据整理及绘图。
2 结果与分析
2.1 外生菌根真菌多样性对土壤理化性质的影响
图1a 表明,土壤含水率在CK 及各处理之间无显著差异,都保持在30%~35%之间。图1b 所示测得土壤pH 均呈弱酸性,其中S4的pH 值(5.44)要显著高于CK及其他处理(5.21~5.30)(P<0.05)。

图 1 外生菌根真菌多样性对土壤酸碱度和土壤含水率的影响Figure 1 Effect of ectomycorrhizal diversity on soil pH and soil moisture content
如图2a、图2b所示,CK对照组有机质(37.62 g/kg)和有机碳(21.82 g/kg)含量显著高于S8处理组(有机质22.81 g/kg;有机碳13.23 g/kg)(P<0.05),总体随ECM真菌接种多样性的增高呈下降趋势。据图2c所示,可溶性有机碳含量各处理之间无显著差异,但在趋势上呈现出ECM 真菌接种增加了可溶性有机碳含量,并随接种ECM真菌多样性的增加有所降低。
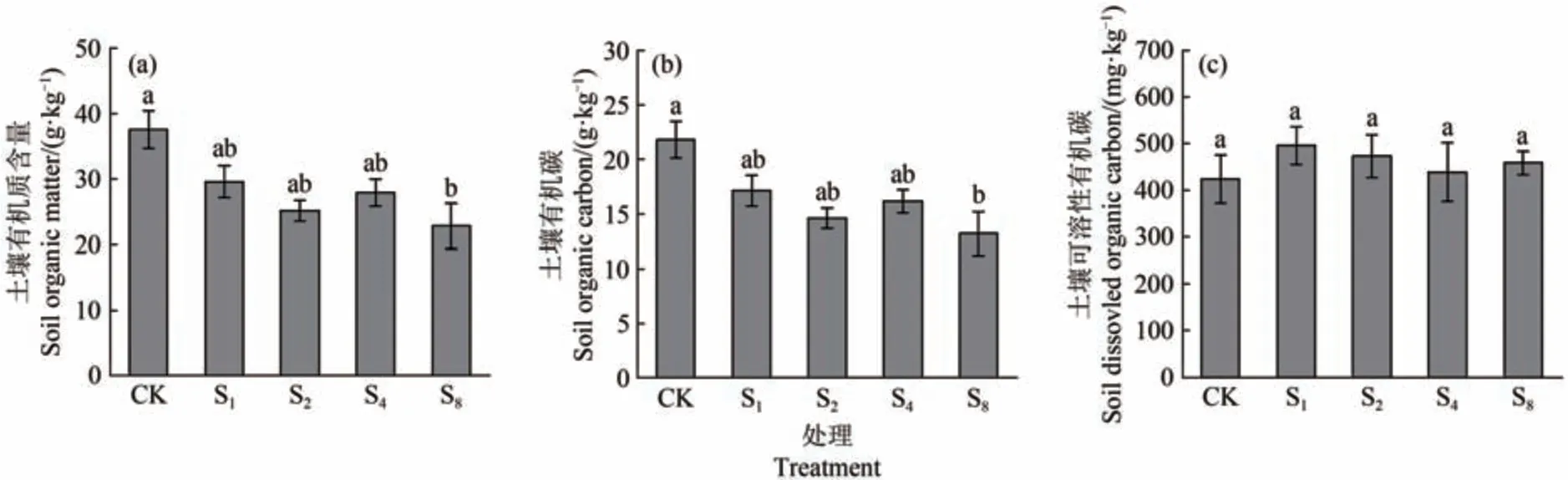
图2 外生菌根真菌多样性对有机质含量、有机碳含量和可溶性有机碳含量的影响Figure 2 Effect of ectomycorrhizal fungal diversity on organic matter content, organic carbon content, and dissolved organic carbon content
如图3a所示,总体趋势上,随ECM 真菌接种多样性的增高土壤硝态氮含量呈上升趋势,除S4(29.68 mg/kg)土壤硝态氮含量显著低于CK 及其他处理(P<0.05)之外,S2(53.15 mg/kg)和S8(64.56 mg/kg)土壤硝态氮含量显著高于CK(44.81 mg/kg)和S1(48.30 mg/kg)处理(P<0.05)。图3b 显示,S2(30.89 mg/kg)土壤铵态氮含量显著高于其他处理(P<0.05)。图3c 显示,土壤无机氮含量与土壤硝态氮含量的趋势相似,随ECM真菌接种多样性的增高呈上升趋势(S4除外),S8(87.23 mg/kg)(P<0.05)的无机氮含量显著高于S4(49.65 mg/kg)和CK(68.45 mg/kg);S4(49.65 mg/kg)的无机氮含量显著低于其他处理(P<0.05)(图3c)。除此之外,我们发现S2(483.72 mg/kg)和S8(424.12 mg/kg)的可溶性全氮含量要显著高于S4(181.18 mg/kg)(P<0.05)(图3d)。而土壤全氮和全磷含量在各处理组之间无显著差异(图3e和图3f)。

图3 外生菌根真菌多样性对土壤硝态氮、铵态氮、无机氮、可溶性全氮、全氮和全磷含量的影响Figure 3 Effect of ectomycorrhizal fungal diversity on nitrate nitrogen, ammonium nitrogen, inorganic nitrogen, total dissolved nitrogen, total nitrogen, and total phosphorus content
2.2 外生菌根真菌多样性对土壤生物性质的影响
图4a 所示,S4(620.1 mg/kg)土壤微生物生物量碳含量显著低于S2(1 140.45 mg/kg)(P<0.05),而与其他处理之间无显著差异。虽然土壤微生物生物量氮含量、微生物生物量碳氮比(微生物生物量C∶N)在各处理之间无显著差异,但S4的微生物生物量碳、氮(154.7 mg/kg)含量均最低,而微生物生物量C∶N却最高(6.31)(图4b、图4c)。
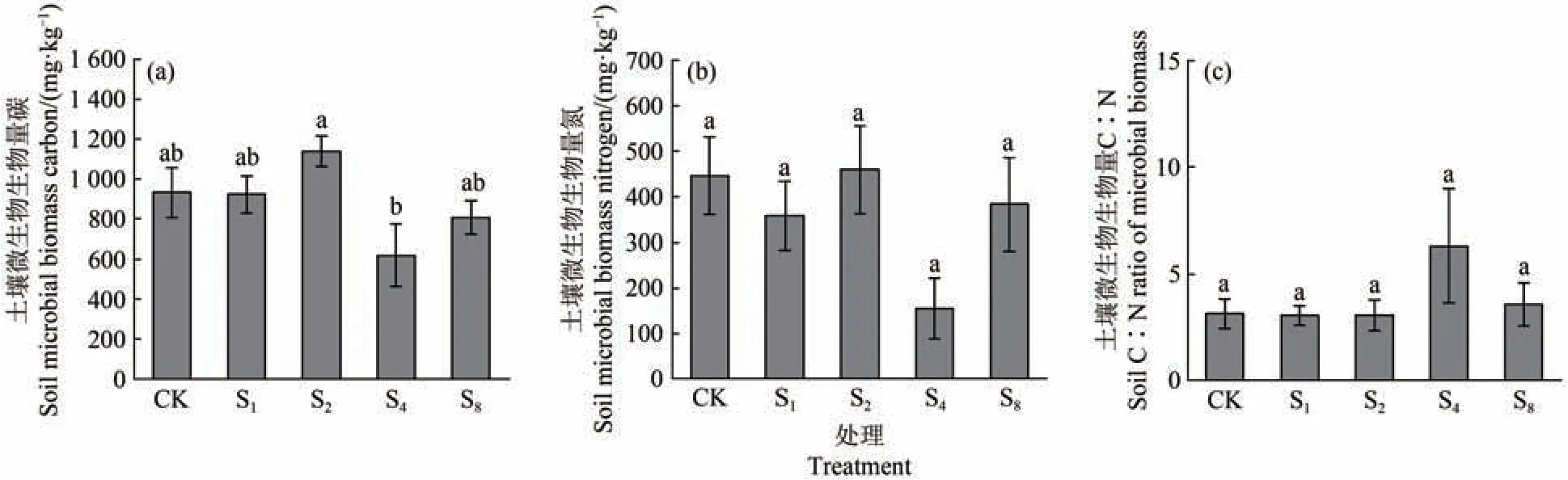
图4 外生菌根真菌多样性对土壤微生物生物量碳、微生物生物量氮和微生物生物量C∶N的影响Figure 4 Effect of ectomycorrhizal fungal diversity on microbial biomass carbon, microbial biomass nitrogen, and microbial biomass
2.3 土壤物理化学生物指标的双变量Pearson 相关关系分析
如表2 所示,土壤pH 与土壤含水率、微生物生物量C∶N 呈显著正相关关系,而与微生物生物量氮、土壤硝态氮及可溶性全氮含量呈显著负相关关系。此外,土壤微生物生物量氮还分别与微生物生物量碳、硝态氮及可溶性全氮具显著正相关关系。微生物生物量C∶N则与硝态氮呈显著负相关关系。可溶性有机碳与可溶性全氮呈中度正相关关系。土壤可溶性全氮与硝态氮呈中度正相关关系。土壤有机质与土壤有机碳呈高度正相关关系(|r|≥0.8,高度相关;0.5≤|r|<0.8,中度相关;0.3≤|r|<0.5,低度相关)。
3 讨论
3.1 外生菌根真菌多样性对根际土壤理化性质的影响
本实验人工控制培养室湿度,所以土壤含水率在各处理之间无显著差异。而图1b所示,S4接种处理的土壤pH却显著高于CK及其他接种处理,且由表2可知,可溶性全氮(P<0.01 ,R=-0.56**)、硝态氮(P<0.01,R=-0.75**)与pH 皆呈负相关。结合分析得出如下可能的解释:①较S4处理而言,其他ECM真菌接种处理下的物种间特殊作用使云杉根系及根际微生物分泌更多的有机酸[52],致使其他处理pH显著降低。②其次,在S4接种处理下,RV、LB、HL和RL 物种间作用,促进植物对养分的吸收(如等),植物在吸收同时为了保持电荷平衡,需释放OH-进而导致pH 值升高,这除了能解释pH变化外,还解释了其与可溶性全氮、硝态氮呈负相关的原因。我们的研究结果与R. Pena 的研究相一致[53]。
由图3 中土壤氮磷养分含量结果可知,川西亚高山人工云杉林土壤较为贫瘠[54]。与较养分肥沃环境相比,在贫瘠土壤环境中ECM真菌更能与宿主产生养分竞争关系,且更能与宿主达成功能互补关系去影响土壤养分[10,53]。当接种单种ECM 真菌时,对土壤有机质分解的影响程度取决于真菌种类[10]。如图2 所示,与CK 相比,S1土壤有机质和有机碳含量较低(无显著差异),而可溶性有机碳含量却有增高趋势,也许能说明RV 真菌能增强对土壤有机质的分解。当8 种ECM 真菌接种于宿主植物时显著降低了土壤有机质、有机碳含量,而可溶性有机碳含量却有增高趋势。这说明了SG、CR、IG 和TF 4 种ECM真菌的加入补充了S1、S2和S4中ECM真菌组合在碳转化方面的功能缺陷[55]。我们的关于碳转化相关酶的研究结果显示菌根真菌多样性显著影响了有关碳转化的酶活性(附表3),证明了ECM 多样性越高,对土壤有机质分解作用越强[4]。这与S. M.Velmala等[4]的研究结果一致,随挪威云杉接种ECM真菌多样性的增加,分泌如半纤维素酶、水解酶、漆酶和几丁质酶等胞外酶种类增加,ECM共生体为获取更多氮磷养分而对有机质的分解作用增强。而可溶性有机碳含量未随ECM 多样性的增加呈明显的递减趋势,可能是由于不同ECM 真菌组合接种,对土壤微生物生物量及群落结构的影响不同[56],导致其对土壤有机碳的利用产生不同程度的影响[57]。我们的解释得到如下研究的证实。有研究[58]指出不同ECM 真菌分类群分泌含碳化合物的类型和能力也各不相同,从而不同种类真菌组合会对根际土壤微生物群落组成产生不同的影响。

表2 土壤物理化学生物指标的双变量Pearson相关关系分析表Table 2 Bivariate Pearson correlation analysis table of soil physical, chemical, and biological indexes
由于ECM 真菌占据的生态位不同而导致其功能具有多样性[5],这也是我们探讨ECM 真菌多样性影响有机质分解、养分利用的重要因素。ECM真菌对于活化土壤氮磷养分的作用有两个方面,一方面是其能通过直接分泌酶活化土壤稳定养分,从而活化其中氮磷养分。另一方面,ECM宿主植物可通过维持一个相对封闭的营养循环,招募具有氮分解和矿化功能的微生物,从而间接活化氮磷养分[54,59-60]。在森林生态系统中,部分早期富集的氮,可能来源于凋落物所释放的溶质,这部分早期富集的氮不受大多数ECM真菌种类的影响[53],由于ECM真菌的这种趋于活化有机质氮养分的特性,使氮养分更易被宿主吸收利用[61]。图3c、图3d中可溶性全氮含量和无机氮含量变化趋势相同,都随着ECM真菌多样性的增加而增加(4种ECM 真菌接种处理除外),此研究结果说明接种多样性较高的菌根真菌群落能够提高土壤有效氮含量。这也与C. Truong等[7]的研究结果相吻合。其表明ECM 真菌物种丰富度与亮氨酸酶活性显著相关,表明较高多样性的ECM真菌群落在强氮限制的环境中有助于增加氮可利用性,且我们的研究结果也发现菌根真菌多样性显著提高了与氮转化相关的根系酶活性(N-acetyl-β-Dglucosaminidase 和Leucine aminopeptidase)(附表3)。此外我们的研究结果显示,S4可溶性全氮含量显著低于S2和S8,硝态氮含量更是显著低于CK,其原因可能是S4真菌组合并不利于有机质分解并活化其中固定的氮元素,但却有利于宿主吸收硝态氮[53,62]。如在R. Pena 等[53]关于山毛榉(Fagus sylvaticaL.)幼苗栽培试验中,发现ECM真菌组合的功能多样性具应力激活效应,即环境限制条件下,ECM 组合比非菌根更有利于对无机氮的吸收。土壤全氮含量在各处理组之间无显著差异,其原因可能是土壤中超过90%的氮以有机形式存在,即便ECM真菌活化其中的一小部分,也会对碳氮循环产生重大影响[55],而失去的这部分对于全氮而言微不足道,并不至于使各组之间产生显著差异。而全磷作为土壤养分的限制因子,含量极低,并与全氮一样大部分被固定且难以被利用,在C. Plassard 等[52]的研究中发现ECM 真菌会产生低分子量的有机阴离子可能对矿物结合磷的释放起决定性作用。但在本试验中,不同多样性梯度的外生菌根真菌群落接种对土壤全磷含量无显著影响,这可能是因为土壤磷含量较低的环境中,较简单的ECM真菌群落产生的根外菌丝有限,使全磷活化为有效磷的能力受到限制,因此对土壤全磷含量没有显著影响。
3.2 不同梯度ECM接种对根际微生物性质的影响
ECM真菌在服务宿主植物时可产生化感作用,能间接改变根际土壤微生物群落特征,这种作用称之为“菌根根际作用[56]”。当ECM 真菌接种时可能对其根际微生物群落会产生抑制[47]或促进作用[56]。“菌根根际作用”为我们理解此试验各处理间微生物生物量的差异提供了一种解释[63]。土壤微生物生物量C∶N 可以在一定程度上反映土壤微生物种类和区系[64],微生物生物量C∶N 一般是5~6[65],而细菌生物量C∶N要低于真菌[64,66],生物量C∶N越高,真菌所占比例越高。依据微生物生物量C∶N 的实验结果,我们可以猜测不同梯度多样性的ECM真菌群落接种影响了根际土壤中真菌与细菌的比例,如图4所示,虽然S4微生物生物量碳、微生物生物量氮及微生物生物量C∶N 与CK 无显著差异,但S4的微生物生物量碳和微生物生物量氮含量在趋势上却低于CK,S4的微生物生物量C∶N在趋势上高于CK,这也许是因为S4处理组的ECM 真菌对于土壤细菌具有抑制作用[63]。另一方面,可能由于S4中的ECM真菌在接受宿主植物高碳分配的条件下,与其他土壤微生物在吸收养分的竞争中处于优势[67]。而S1、S2可能是因为简单的ECM 真菌组成对其他包括细菌在内的微生物不构成养分竞争威胁。S8则更大程度上是因为ECM真菌的内部之间的竞争[11],导致真菌优势相较S4有所减弱。我们的研究结果也进一步表明微生物生物量氮、微生物生物量C∶N 与pH 分别呈显著负相关(P<0.01,R=-0.45**)和显著正相关(P<0.01,R= 0.45**)关系,与硝态氮含量分别呈显著正相关(P<0.01,R= 0.52**)和显著负相关(P<0.01,R=-0.45**)关系,微生物生物量氮与土壤可溶性全氮呈显著正相关(P<0.05,R=0.35*)关系。这些结果说明了由菌根真菌多样性变化导致的可利用性氮和pH的变化可能会间接地对根际微生物群落产生影响[56,63]。在R. H. Jongbloed 等[68]的研究中发现铵态氮的积累使营养基酸化增强,促进了嗜酸真菌繁殖生长,进而改变了微生物群落。
4 结论与展望
4 种ECM 真菌接种组合组可能与其他接种组合的分解吸收能力、分泌作用不同,从而影响土壤中酸性可溶性有机物质及矿质离子含量,最终导致pH值升高。由于其各真菌种类间功能互补性,较高多样性ECM真菌群落接种可促进土壤有机质分解,增加土壤可利用性氮,但是4种ECM真菌组合接种可能有利于宿主植物对氮的吸收,但不利于从有机质中活化氮组分。而在全氮、全磷含量极低的土壤中,较简单的ECM真菌群落并不会对全氮和全磷产生大的影响。ECM真菌多样性的不同,可能会通过真菌物种相互之间的促进或抑制作用使根际土壤微生物群落结构发生改变,特别是HL、RL、IG 和TF4 种ECM 真菌的接种对土壤微生物生物量C∶N影响较为明显。上述结果总体说明,与宿主共生的外生菌根真菌群落的多样性越高,其对土壤有机质分解以及提高土壤氮的可利用性有积极的作用。
我们本次试验的可在一定程度上为认识ECM真菌多样性在改良土壤理化生物性质的作用上提供科学依据。但对于幼苗的生长影响却很难等同于对成年树木的生长影响[4,53]。而且幼苗的试验栽培均处于人工设置的适宜生长的环境中,不同于野外存在的各种逆境条件,栽培土壤上也相较野外缺少了凋落物的覆盖,这些都启示我们在试验研究中要开拓的方向,要由室内转移到野外,让ECM 真菌多样性作用的研究能真正行使其在自然生态系统中。目前国内对ECM真菌多样性的研究相对较少,且室内接种的ECM 真菌种类较少,为对ECM 真菌多样性对云杉根际土壤物理生化性质的影响机制进行全面了解,之后的研究可定位于树种多样性或不同海拔的ECM 真菌多样性梯度设置,揭示ECM真菌多样性对土壤碳氮循环的潜在影响机制,以期进一步深入理解川西亚高山地下生态过程,并为区域退化森林生态系统恢复重建提供新的认识。

