甜玉米雄性不育突变体ms2020的表型分析和基因定位
熊才运,王 阳,裴 虎,莫海伟,汤蕴琦,黄 君,2
(1.华南农业大学 农学院,广东 广州 510640;2.广东省植物分子育种重点实验室,广东 广州 510640)
植物雄性不育(Male sterility,ms),是指植物在有性生殖阶段雄性生殖器官发育异常,不能产生正常的小孢子或雄配子的现象。目前,已经在玉米[1]、水稻[2]、油菜[3]、小麦[4]等多种主要农作物中观察到雄性不育现象。雄性不育不仅是研究植物生长发育的重要内容,同时也是杂交育种的有效工具。玉米(ZeamaysL.)是一种雌雄同株的异花授粉作物,由于玉米植株相对容易分离,利用玉米雄性不育系进行杂交制种已经成为提高产量的重要途径[5]。
玉米花药的发育过程极其复杂,在发育过程中任何时期发生异常都可能会对花粉的育性产生影响。拟南芥[6]、水稻[7-8]等模式植物的花药发育过程研究发现植物花药发育的过程基本一致。Warmke等[9]将玉米花药的形成过程大致分为以下8个时期:前胼胝质期、中心胼胝质期、减数分裂期、四分体时期、小孢子单核早期、小孢子单核晚期、二孢花粉时期、成熟花粉期。利用光学显微镜(Optical Microscope,OM)和电子显微镜(Electron Microscope,EM)观察玉米核不育材料的花药发育过程,发现育性相关基因主要影响花药结构的分化、花粉母细胞的减数分裂、花粉壁形成和小孢子发育等阶段,基因功能的异常最终导致败育表型的产生[10]。目前,已发现的玉米核不育基因在玉米的10条染色体上均有分布,而且部分基因已经完成了克隆,例如ZmMs7[11]、ZmMs33[12]、ZmMs44[13]、ZmMs26[14]、ZmMs30[15]、ZmMS45[16],对其功能有也有了一些认知。
甜玉米作为重要的鲜食玉米,因其具有营养丰富、甜、鲜、脆、嫩等特点而深受消费者青睐[17]。甜玉米种质资源开发对甜玉米制种尤为重要,优质的甜玉米雄性不育系可提高制种效率,但目前关于甜玉米雄性不育系的研究较少。本研究对甜玉米不育突变体ms2020的田间不育特征及遗传特性进行了分析,利用分子标记对该不育基因进行了精细定位,旨在为甜玉米雄性不育分子机理的研究鉴定理论基础,将雄性不育基因与杂种优势相结合直接服务于农业生产实践。
1 材料和方法
1.1 试验材料
本研究以源自甜玉米自交系K78的雄性不育自发突变体malesterility2020(ms2020)及华南农业大学甜玉米课题组提供的甜玉米自交系材料M08为试验材料。以ms2020作为母本,与M08杂交,构建F1及相应的F2遗传群体,进行表型观察、遗传规律分析和基因定位。所有试验材料种植于华南农业大学增城教学实验基地,常规管理。
1.2 试验方法
1.2.1ms2020突变体的表型鉴定和遗传分析 观察F2群体在营养生长阶段的植株形态差异;植株抽雄后,取即将开花的小穗,在解剖镜下观察花药的形态特征;用碘染法(1% I2-KI)鉴定花粉育性;取可育株和不育株的花药,用戊二醛固定后,委托武汉迈斯普生物科技有限公司进行扫描电镜,观察花药和花粉的外部形态。
于散粉期考察F2群体中各单株的育性表现,统计可育株和不育株株数,并计算其比例,通过卡方测验进行分离比检验。
1.2.2 基因定位 散粉期分别选取F2的可育株和不育株各30株,用CTAB法提取基因组DNA,将浓度相近的DNA等体积混合后分别构建“野生型池”和“突变体池”,利用40K靶向测序基因型分型GBTS(Genotyping by target sequencing)技术,通过SNP-index关联分析[18]和欧式距离(Euclidean Distance,ED)关联分析[19]得到目的基因的初定位区间。在MaizeGDB(https://www.maizegdb.org/)网站下载玉米参考基因组(B73 RefGen_v4),使用MISA(http://pgrc.ipk-gatersleben.de/misa/)软件在Perl语言环境下查找初定位区间内的SSR位点,利用Primer3Plus(https://www.primer3plus.com/index.html)在线设计引物,并由北京擎科生物有限公司广州分公司合成引物。扩大定位群体,通过聚丙烯酰胺凝胶电泳(PAGE)在初定位区间内筛选交换单株,通过加密标记进一步缩小定位区间。
2 结果与分析
2.1 ms2020突变体的表型特征
在营养生长阶段,ms2020植株与野生型植株无明显差异;生殖生长阶段,ms2020突变体植株虽能正常抽雄,但花药不开裂、不散粉(图1-A、B)。小穗解剖观察,发现与野生型花药相比,突变体花药瘦小且颜色淡黄(图1-B)。I2-KI(1%)染色,发现野生型花粉能够正常染色(图1-C),突变体花药中包含不能正常着色的败育花粉粒(图1-D,黑色箭头所指)。

A.野生型(左)和ms2020 (右)植株表型;B.散粉期野生型(左)和ms2020 (右)雄穗及小穗表型;C,D.野生型 (C)和ms2020 (D)花粉镜检,黑色箭头所指为突变体花药中的败育花粉粒。A.Plant phenotypes of wild type(left)and ms2020 (right);B.Tassel and spikelet phenotypes of wild type(left)and ms2020 (right)at the pollination stage;C,D.Microscopic examination of pollen of wild type(C)and ms2020 (D),black arrows point to abortive pollen grains in mutant anthers.图1 ms2020突变体和野生型表型Fig.1 Phenotypic of the ms2020 mutant and wild type
散粉期野生型和突变体花药扫描电镜结果显示,突变体花药外壁与野生型差异较大 (图2-A、B)。野生型花药外壁表皮细胞均匀且细长,被致密的角质层包裹,呈现立体网格状结构,这是玉米花药特有的表皮脊状结构(图2-C);而突变体花药外壁细胞形状不规则,且细胞表面无脊状结构,但其表面有气孔,如白色箭头所指(图2-D)。野生型花药内部的花粉粒呈球形(图2-E),突变体花药内部不可见完整的花粉粒(图2-F);野生型花粉外壁有细网-刺状复合结构(图2-G),突变体花粉粒已经解体(图2-H)。

A,C.野生型花药外壁;B,D.ms2020花药外壁。突变体花药表面有气孔,如白色箭头所示(D);E,G.野生型花粉外壁;F,H.ms2020花药内部。A,C.Wild type anther outer wall;B,D.ms2020 anther outer wall.Mutant anther has stomata on the surface,as indicated by white arrows(D); E,G.Wild type pollen exine;F,H.ms2020 anther interior.图2 ms2020和野生型花药组织学观察Fig.2 Histological observation of the ms2020 mutant and wild type
2.2 ms2020突变体遗传分析
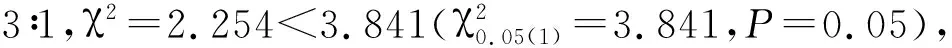
2.3 突变基因的定位
将测序数据进行过滤,质控后的数据与参考基因组(B73 RefGen_v4)对比,并进行区段SNP检测。通过SNP-index关联分析和欧式距离关联分析(图3),得到性状候选区间位于第7号染色体1~7 922 318 bp。

A.F2 Δ(SNP-index)全基因组分布图;B.ED关联值在全基因组上的分布。A.Distribution profile of Δ(SNP-index)in F2 generation on whole genome;B.Distribution profile of ED values on whole genome.图3 SNP-index关联分析和欧式距离关联分析Fig.3 SNP-index and Euclidean distance correlation analysis
在初定位区间内开发SSR标记,利用聚丙烯酰胺凝胶电泳筛选出在亲本之间具有多态性的可用标记,共筛选出13对多态性标记,利用96株F2隐性不育单株进行验证,发现在Y23和P6标记处的交换单株数目分别为9和11(图4-A)。进一步在Z5标记(位于Y23之前)和P6标记之间开发标记,筛选出7对多态性标记,最终将突变基因定位在S1和W10之间 (图4-B),物理距离约11.30 kb,包含Zm00001d018802和Zm00001d0188032个候选基因(图4-C)。精细定位中筛选到的部分隐性单株分子标记检测结果列于表1。
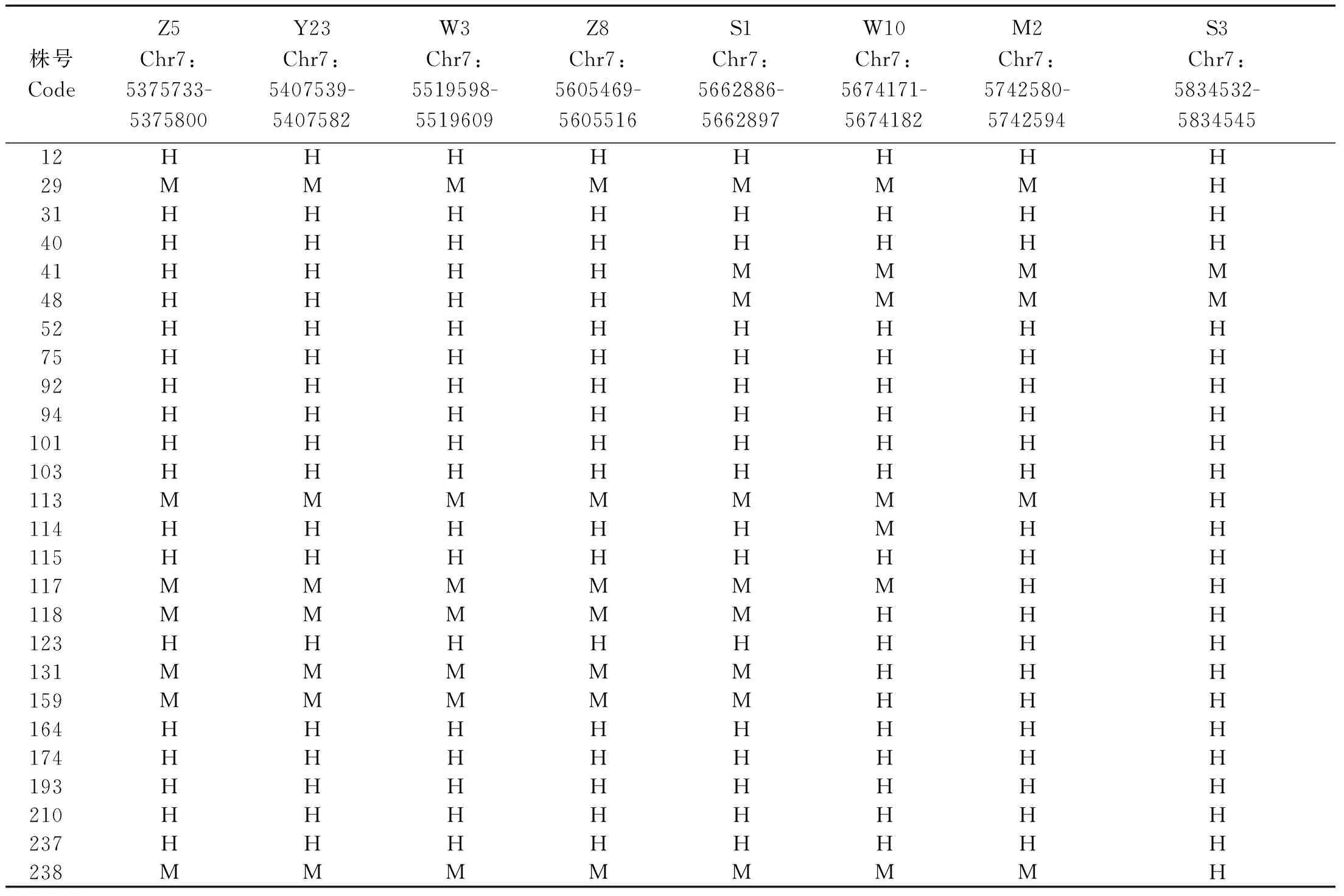
表1 部分隐性单株分子标记检测结果Tab.1 Test results of markers in partial recessive individual plants
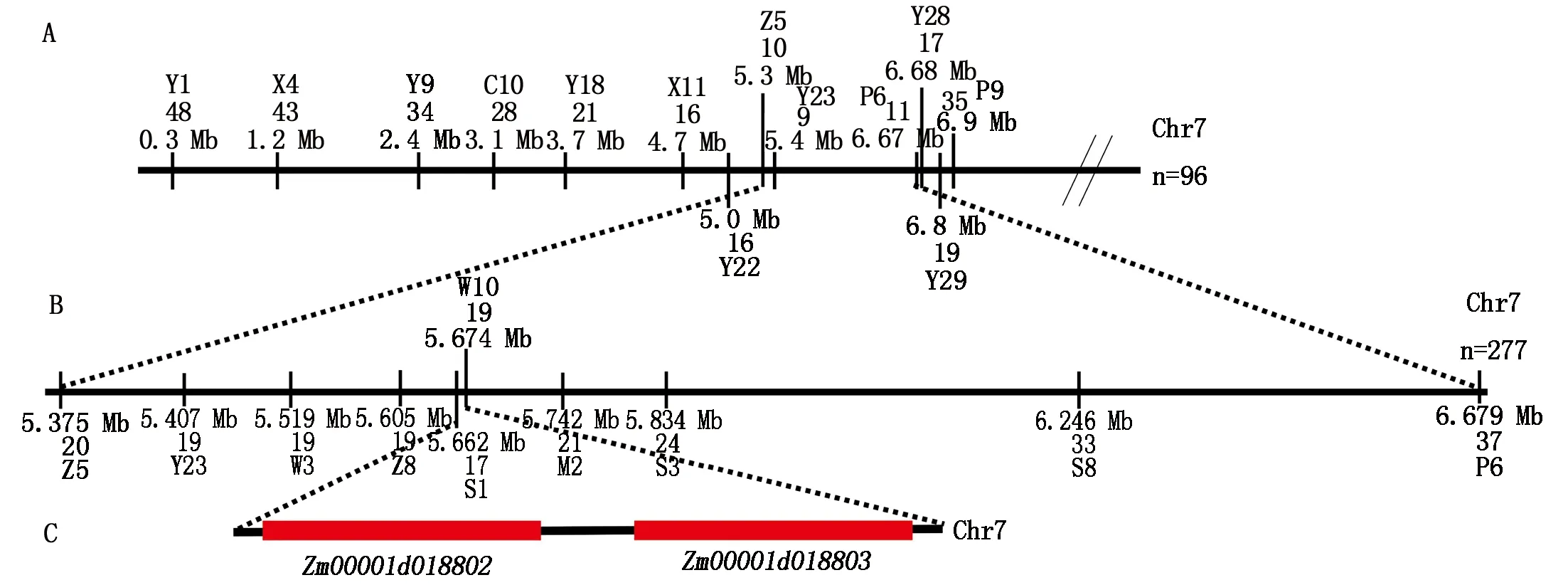
A.候选基因定位于7号染色体Y23和P6分子标记之间;B.候选基因精细定位在S1和W10之间的11.3 kb范围内; C.精细定位区间内包含2个候选基因。红色数字为交换单株数。A.Candidate gene was located between Y23 and P6 molecular markers on maize chromosome 7;B.Candidate gene was fine mapped to a 11.3 kb region delimited by S1 and W10 markers;C.Two candidate genes in the fine-mapped region.The red figures are the number of exchanged plants.图4 ms2020突变体的精细定位Fig.4 Fine mapping of ms2020 mutant
利用MaizeGDB(https://www.maizegdb.org/)网站对候选基因进行注释。Zm00001d018802注释为一个雄性不育基因Ms22(malesterile22),编码一个谷氧还蛋白(Glutaredoxin),导致花粉母细胞退化而造成雄性不育。Zm00001d018803功能未知。
3 结论与讨论
BSA在作物改良方面具有广阔前景,通过发展诊断和组成标记(Diagnostic and constitutive markers)、农艺基因组学(Agronomic genomics)、标记辅助选择(Marker-assisted selection)和表型选择(Selective phenotyping)来促进植物育种[20]。Zou等[20]结合BSA 和AFLP(Amplified fragment length polymorphism,扩增片段长度多态性),鉴定了玉米重组近交系中高粱霜霉病 (Sorghum downy mildew,SDM)抗性相关的4个AFLP标记,其中EM227、EM216、EM159为抗性标记,EM186为易感性标记。Agrama等[21]结合BSA和简单重复序列(Simple sequence repeat,SSR),鉴定高耐寒品种和低耐寒品种之间的遗传关系,其中bnlg1273、umc1124、dupssr21、mmc0251、mmc0181和phi041等SSR标记具有作为玉米耐寒性分子标记的巨大潜力。Klein等[22]结合BSA和单核苷酸多态性(Single nucleotide polymorphism,SNP),将narrowodddwarf鉴定为teosintebranched1的增强子,并鉴定到一个defectivekernel1的新等位基因。本研究采用 BSA结合SSR标记的定位策略,成功定位到ms2020突变体的候选基因。
在ms2020甜玉米雄性不育突变体的定位区间里包含2个候选基因,Zm00001d018803功能未知,Zm00001d018802注释为一个雄性不育基因ZmMs22,该基因也被注释为ZmMSCA1(MALESTERILECONVERTEDANTHER1),编码一个谷氧还蛋白(Glutaredoxin,GRX),参与了雄蕊原基的起始与花药原基的分化过程。ms22/msca1突变体虽然可以正常进行雄蕊原基的起始,但之后不能进行正常的细胞分裂和分化,而是形成了一些表面含有气孔的结构,包括实质细胞及异位的非功能性微管,这些结构通常不存在于正常玉米花药中[23]。本研究中,扫描电镜结果显示,ms2020突变体花药的表面存在与ms22/msca1突变体相似的气孔结构,因此将Zm00001d018802作为ms2020甜玉米雄性不育突变体的重要候选基因。
谷氧还蛋白(GRXs)是一种生物体中普遍存在的谷胱甘肽依赖氧化还原酶,在NADPH和谷胱甘肽还原酶(GSH)存在下催化二硫键的还原,以调节靶蛋白的活性[24]。谷氧还蛋白系统由GRX、GSH和还原NADPH组成,它们在植物体内参与维持细胞内的氧化还原状态,调节氧化还原反应所依赖的信号途径。ZmMSCA1/Ms22除了控制着玉米花药的发育,也被报道其转位会引起茎尖分生组织的大小改变[25]。该基因调节茎分生组织大小的机制已有报道[25-26],但其引起雄性不育的机制未见报道。本研究中,ms2020突变体的花药中包含不能正常着色的败育花粉粒,但高永钢[27]发现ms22突变体为无花粉型完全败育突变体,推测2个突变体的表型差异可能突变位点的不同导致的。高永钢[27]通过测序及序列比对,发现ms22突变体的不育表型并非由Ms22直接导致,而是该基因的TGA后900~1 300 bp处缺失62个碱基所导致。虽然缺失位点不在Ms22蛋白的翻译区段,但约400 bp的片段丢失可能导致玉米7号染色体短臂附近的其他基因,或相邻染色体同一染色体片段出现交换异常。本研究虽已明确ms2020突变体的突变基因为Zm00001d018802,但其突变位点和作用机制需进一步深入。
玉米雄性不育突变体在发育后期,小孢子或花粉都会塌陷,本研究的扫描电镜结果显示,ms2020突变体符合这一基本特征。但不同的雄性不育突变体其败育特征不尽相同,花粉壁和绒毡层结构的异常极可能导致雄性不育。花粉壁包含花粉内壁和外壁,外壁的主要组成成分为脂肪族物质及其衍生物[28],已报道的ZmMs26和ZmMs30基因都与脂质合成代谢有关,但败育过程略有差异。ZmMs26突变导致脂肪酸代谢途径异常,花药发育所必需的脂肪类物质供应不足,不能形成正常的花粉壁和花药角质,最终植株败育[14];ZmMs30编码一种具有不同催化残基的新型GDSL脂肪酶,在第7~9阶段玉米花药中特异性表达,其功能的丧失导致花药表皮缺陷、不规则的花粉外壁足层以致完全雄性不育[15]。研究表明,绒毡层细胞是植物花粉外壁发育过程的重要参与者,绒毡层细胞的程序化死亡为小孢子发育提供物质基础,其降解后产生的营养物质和胼胝质是合成花粉壁所需的[29],特别是由绒毡层合成并分泌的孢粉素(Sporopollenin)物质,是形成花粉壁的最主要物质[30]。此外,绒毡层和胼胝质的适时降解是小孢子正常发育的重要保障[31-32]。ZmAPV1在脂肪酸羟基化途径中起作用,该途径参与形成孢粉素前体和角质单体,这对玉米中花粉外壁和花药表皮的发育至关重要[33]。ZmMs7过早表达会造成绒毡层发育异常及花粉壁异常,最终导致小孢子解体[11]。ms2020突变体的败育机制和不育基因的调控机制有待深入研究。
本研究对甜玉米不育突变体ms2020进行了田间不育性状表型鉴定、遗传分析和基因精细定位,研究结果显示,ms2020的不育性状是的不育性状受单隐性核基因控制,突变体花粉表现为败育。通过构建分离群体,区间内开发SSR标记,最终将候选基因定位在S1和W10之间,物理距离约11.30 kb,包含Zm00001d018802和Zm00001d0188032个候选基因;通过候选基因分析,推测已报道为玉米雄性不育基因的Zm00001d018802(ZmMs22/ZmMSCA1)是导致ms2020甜玉米雄性不育突变体表型的功能基因,但其突变位点及发挥功能的作用机制有待进一步深入。本研究为进一步解析ms2020基因调控甜玉米雄性不育的分子机制奠定了基础,也为创造优良甜玉米雄性不育系提供了新的研究材料。

