TBBPA-DHEE暴露对大鼠肾上腺髓质嗜铬细胞瘤PC12细胞的影响及机制
曾政嘉, 冯伟伟, 丁阳阳, 钱显, 罗梦娜, 茆广华, 仰榴青, 吴向阳
(江苏大学 1. 环境与安全工程学院, 2. 实验动物中心, 3. 化学化工学院,江苏 镇江 212013)
四溴双酚A是全球使用最广泛、用量最大的一种溴代阻燃剂,约18%用于生产衍生物[1],四溴双酚A双(2-羟基乙基)醚[tetrabromobisphenol A bis(2-hydroxyetyl) ether,TBBPA-DHEE]是其主要衍生物之一。TBBPA-DHEE作为一种添加型阻燃剂,广泛用于聚苯乙烯泡沫、工程聚合物和热塑性聚酯等材料[2],易释放至环境中且稳定存在。研究发现,在各种环境介质中可检测到TBBPA-DHEE,包括工业废水[3]、河流[3-4]、土壤和生物(钉螺、克氏原螯虾、蚯蚓)[5]等样品中。
研究发现,四溴双酚A具有神经毒性[6-7],TBBPA-DHEE与其结构高度相似,但是否具有神经毒性有待探究。Liu等[1]采用大鼠嗜铬细胞瘤细胞模型研究发现,TBBPA-DHEE可破坏细胞膜的完整性,显著抑制多巴胺分泌和乙酰胆碱酯酶活性,产生潜在的神经毒性。随后的研究中,Liu等[8]采用新生SD大鼠模型发现,TBBPA-DHEE可改变其运动行为与脑神经功能,对幼年期大鼠产生神经毒性。但是,TBBPA-DHEE致神经毒性效应的机制尚不明确。因此,本研究以神经细胞株——大鼠肾上腺髓质嗜铬细胞瘤PC12细胞为实验对象,采用细胞生物学、分子生物学等方法研究TBBPA-DHEE暴露对PC12细胞的影响,并基于钙离子信号通路探明其潜在的作用机制。
1 材料与方法
1.1 细胞、主要试剂及仪器
大鼠肾上腺髓质嗜铬细胞瘤PC12细胞购于中国科学院上海生命科学研究院细胞库。
TBBPA-DHEE标准品(纯度98%)、MTT(美国Sigma公司);DMEM、胎牛血清(美国Hyclone公司);GAPDH、钙调蛋白(calmodulin,CaM)、磷酸化钙/钙调蛋白依赖性蛋白激酶Ⅱ(phospho-calcium/calmodulin-dependent protein kinase Ⅱ,p-CaMKⅡ)、磷酸化细胞外信号调节激酶1/2(phospho-extracellular signal-regulated kinase 1/2,p-ERK1/2)、磷酸化环磷腺苷效应元件结合蛋白(phospho-cAMP response element binding protein,p-CREB)抗体以及山羊抗兔二抗(美国CST公司);丝裂原活化蛋白激酶磷酸酶-1(mitogen-activated protein kinase phosphatase-1,MKP-1)抗体(美国Novus公司);超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛试剂盒(苏州科铭生物技术有限公司);BCA蛋白含量检测试剂盒、电压门控钙离子通道(voltage-gated calcium channel,VGCC)ELISA试剂盒(合肥博美生物科技有限责任公司);活性氧测定试剂盒、NO测定试剂盒、Ca2+含量测试盒(南京建成生物工程研究所有限公司);12% SDS-PAGE超快速配制试剂盒、RIPA裂解液(含1%蛋白酶抑制剂和1%磷酸酶抑制剂)、脱脂奶粉、5×蛋白上样缓冲液(上海碧云天生物技术有限公司);其余试剂购于国药集团,均为分析纯。
细胞培养用显微镜(日本Olympus公司);超净工作台(苏州净化设备有限公司);二氧化碳培养箱、超低温冰箱(日本Panasonic公司);冷冻高速离心机(美国Thermo公司);电子天平(德国Sartorius公司);PVDF膜、垂直电泳系统(美国Bio-rad公司);全自动化学发光图像分析系统(上海天能科技有限公司);立式压力蒸汽灭菌锅(上海博迅医疗生物仪器股份有限公司);多功能微孔板检测仪(美国BioTek公司)。
1.2 TBBPA-DHEE溶液配置
称取适量TBBPA-DHEE固体溶于溶剂二甲基亚砜(dimethyl sulfoxide,DMSO)中,分别制备浓度为2、10、20、30、40、50、60、80、100和120 mg/mL的TBBPA-DHEE储备液,避光保存。为排除DMSO对细胞的影响,实验时用含10%胎牛血清的DMEM将各浓度储备液中的DMSO含量稀释至0.05%,分别得到浓度为1、5、10、15、20、25、30、40、50和60 μg/mL TBBPA-DHEE的DMEM。
1.3 MTT法检测TBBPA-DHEE暴露对PC12细胞活力的影响
取对数生长期PC12细胞,分别加入1、5、10、15、20、25、30、40、50和60 μg/mL TBBPA-DHEE行TBBPA-DHEE暴露,同时设置空白对照和0.05% DMSO溶剂对照,培养箱孵育48 h;弃上清液,PBS清洗细胞2次;每孔加入100 μL MTT溶液(浓度1 mg/mL),37 ℃孵育4 h;弃上清液,加入100 μL DMSO,水平摇床缓慢振荡15 min;于酶标仪570 nm波长处测定光密度值。
1.4 TBBPA-DHEE暴露实验
1.4.1 细胞分组及处理 将PC12细胞用含10%胎牛血清的DMEM于37 ℃的5% CO2细胞培养箱中培养。基于MTT实验TBBPA-DHEE半数抑制浓度(IC50)结果,将细胞分为5组:空白对照组、溶剂对照组、5 μg/mL低剂量组、20 μg/mL中剂量组、35 μg/mL高剂量组,分别给予DMEM(10%胎牛血清)、DMEM(10%胎牛血清+0.05% DMSO)、5 μg/mL TBBPA-DHEE、20 μg/mL TBBPA-DHEE、35 μg/mL TBBPA-DHEE,孵育48 h。
1.4.2 细胞培养液中NO和Ca2+含量测定 取“1.4.1”分组细胞,孵育48 h;于25 ℃,2 500 r/min离心10 min,收集上清液;采用试剂盒测定上清液中NO和Ca2+含量。
1.4.3 ELISA法测定细胞VGCC含量 取“1.4.1”分组细胞,弃培养液,加入2 mL预冷PBS清洗细胞2次;于6孔板每孔加入50 μL RIPA裂解液(含1%蛋白酶抑制剂和1%磷酸酶抑制剂)裂解细胞,4 ℃振荡30 min充分裂解;13 000×g离心5 min;取上清液,采用ELISA试剂盒检测VGCC含量。
1.4.4 蛋白质免疫印迹法检测Ca2+信号通路中相关蛋白的表达 取“1.4.1”分组细胞,采用RIPA裂解液(含1%蛋白酶抑制剂和1%磷酸酶抑制剂)提取细胞蛋白,BCA检测试剂盒测定蛋白浓度,加入5×蛋白上样缓冲液将蛋白样品定量至1 mg/mL。5组样品各取10 μg置于12% SDS-PAGE加样孔中,80 V电泳2 h将蛋白分离;利用半干法转印20 min将蛋白转印至甲醇激活的PVDF膜;PBS清洗3次,每次5 min;置于TBST稀释的5%脱脂奶粉中封闭2 h;TBST清洗3次,每次5 min;分别置于使用1×TBST(含5%牛血清白蛋白)稀释1 000倍的GAPDH、CaM、p-CaMKⅡThr286、p-ERK1/2Thr202/Tyr204、p-CREBSer133和MKP-1一抗(兔抗大鼠)中4 ℃孵育12~16 h;TBST清洗6次,每次5 min;置于1×TBST稀释2 000倍的二抗(山羊抗兔)中25 ℃孵育2 h;TBST清洗6次,每次5 min;采用化学成像系统进行成像分析。
1.5 数据分析
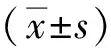
2 结果
2.1 TBBPA-DHEE暴露对细胞活力的影响
如图1所示,与空白对照组相比,20、25、30、40、50和60 μg/mL TBBPA-DHEE组细胞抑制率显著上升(P均<0.01),DMSO溶剂对照组和1、5、10、15 μg/mL TBBPA-DHEE组差异无统计学意义(P均>0.05)。经计算,TBBPA-DHEE对PC12细胞IC50为33.4 μg/mL。由此可见,TBBPA-DHEE暴露在一定浓度范围内(20~60 μg/mL)可显著抑制PC12细胞活力。
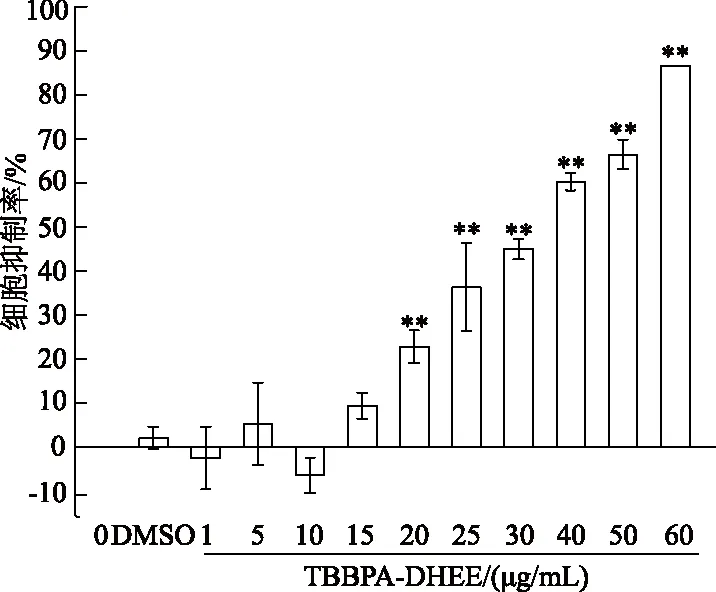
* *:P<0.01,与空白对照组相比
2.2 TBBPA-DHEE暴露对细胞氧化应激的影响
如图2所示,与空白对照组相比,5、20和35 μg/mL TBBPA-DHEE组细胞SOD活性和活性氧荧光强度均显著上升(P均<0.01),丙二醛含量显著升高(P<0.01或P<0.05);溶剂对照组与空白对照组间差异无统计学意义(P均>0.05)。随着TBBPA-DHEE剂量升高,细胞氧化应激指标均呈上升趋势。由此可见,暴露于TBBPA-DHEE可导致PC12细胞产生氧化应激损伤。
2.3 TBBPA-DHEE暴露对细胞NO和Ca2+含量的影响
如图3所示,与空白对照组相比,5、20、35 μg/mL TBBPA-DHEE组细胞培养液中NO和Ca2+含量显著升高(P<0.01或P<0.05);溶剂对照组与空白对照组间差异无统计学意义(P>0.05)。由此表明,TBBPA-DHEE可影响PC12细胞NO分泌和Ca2+转移。
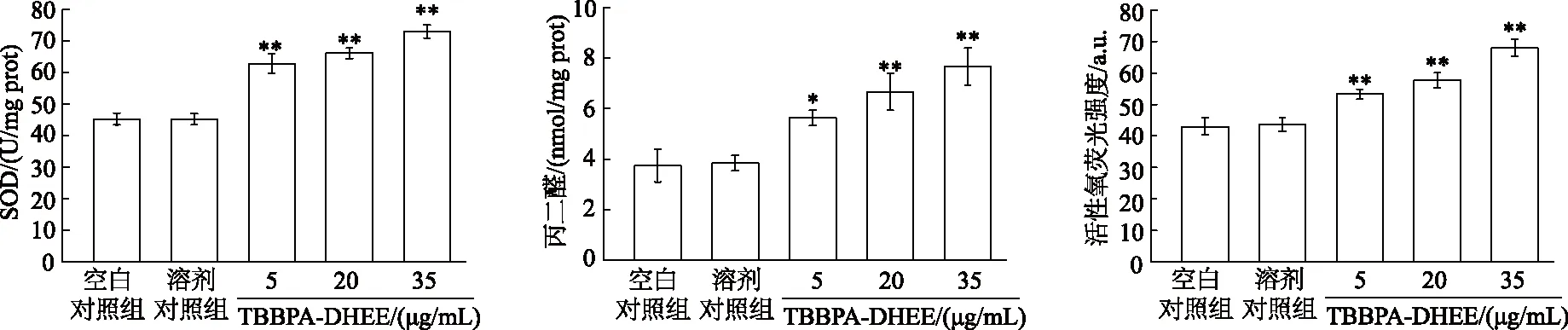
*:P<0.05,* *:P<0.01,与空白对照组相比
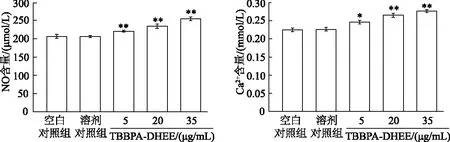
*:P<0.05,* *:P<0.01,与空白对照组相比
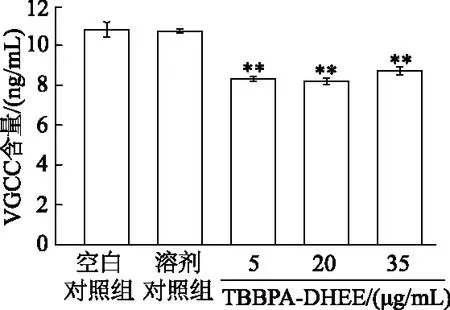
2.4 TBBPA-DHEE暴露对细胞VGCC含量的影响
如图4所示,与空白对照组相比,5、20和35 μg/mL TBBPA-DHEE组VGCC含量均显著下降(P<0.01);溶剂对照组与空白对照组间差异无统计学意义(P>0.05)。由此表明,TBBPA-DHEE可下调膜蛋白VGCC表达。
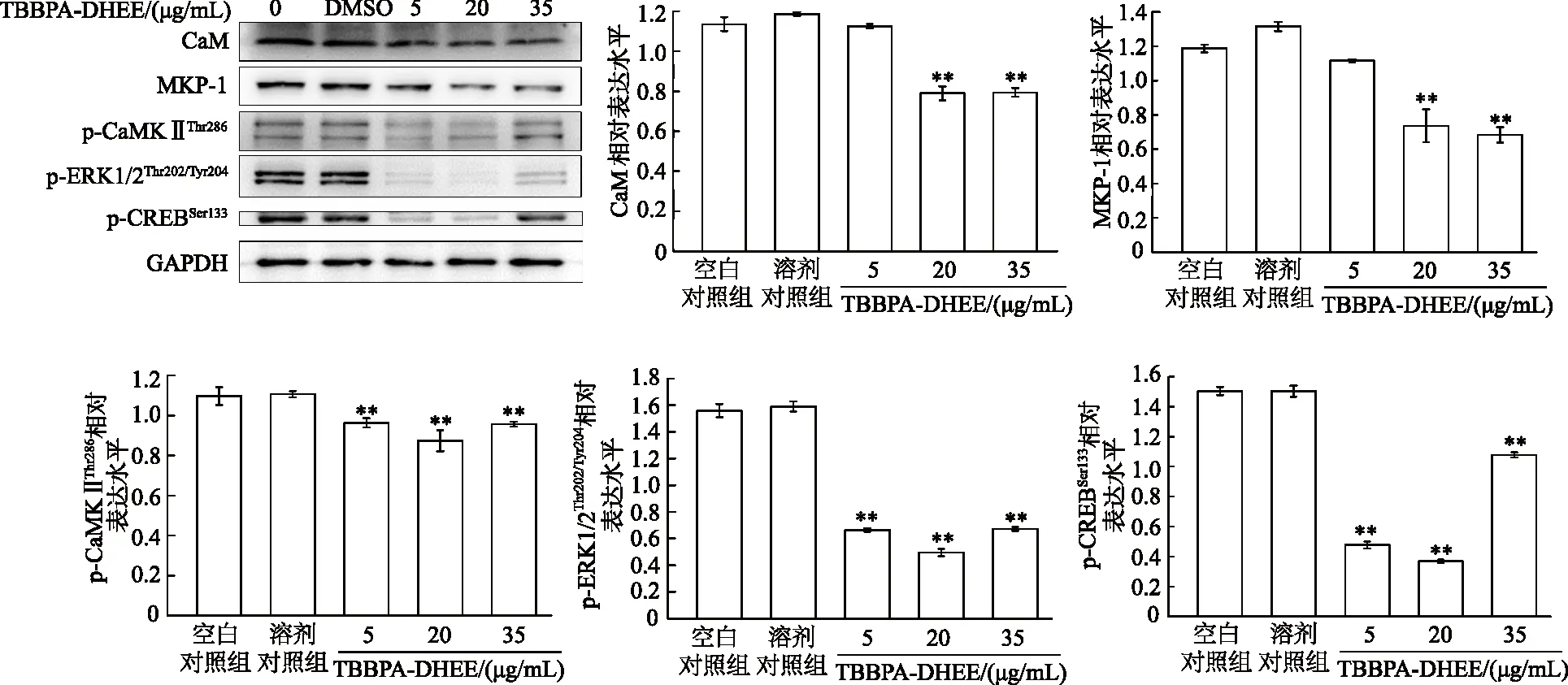
2.5 TBBPA-DHEE暴露对细胞Ca2+信号通路中相关蛋白表达的影响
如图5所示,与空白对照组相比,DMSO溶剂对照组所有蛋白表达水平差异均无统计学意义(P均>0.05),5 μg/mL TBBPA-DHEE组中CaM及MKP-1蛋白表达无显著变化、p-CaMKⅡThr286、p-ERK1/2Thr202/Tyr204和p-CREBSer133蛋白表达显著降低(P均<0.01),20和35 μg/mL TBBPA-DHEE组所有蛋白表达均显著降低(P均<0.01),且20 μg/mL组蛋白表达较5 μg/mL组存在下降趋势。由此可见,一定剂量的TBBPA-DHEE可显著影响Ca2+信号通路中相关蛋白的表达。
* *:P<0.01,与空白对照组相比
* *:P<0.01,与空白对照组相比
3 讨论
氧化应激与各种精神、行为、情绪和认知的异常相关[9],影响神经突触的可塑性[10],是引起神经毒性的重要因素。SOD在维持氧化和抗氧化的内部动态平衡方面起重要作用。本研究中SOD活性上升可能是由于TBBPA-DHEE通过细胞膜扩散到细胞质后,SOD自动激活以减轻氧化应激所导致,而未耗尽的活性自由基会继续损害抗氧化防御系统。徐彤等[2]将斑马鱼暴露于TBBPA-DHEE后,其SOD活性同样呈上升趋势,表明TBBPA-DHEE可引起生物体发生氧化失衡。丙二醛是氧化应激引起脂质过氧化的产物,可作为衡量脂质过氧化及细胞氧化损伤的指标[11]。Zhang等[11]将L02正常肝细胞暴露于四溴双酚A(TBBPA)后,丙二醛含量显著上升,表明细胞受到活性氧影响发生脂质过氧化,细胞膜受损。研究表明,溴代阻燃剂可引起严重的体外氧化应激反应,导致活性氧生成、细胞凋亡和坏死[12]。Liu等[1]研究发现,TBBPA-DHEE暴露可显著增加PC12细胞活性氧生成。本研究发现,TBBPA-DHEE暴露能够产生与TBBPA暴露相似的氧化应激反应,导致氧化损伤。NO是大脑发育的神经调节物质之一,可通过调节突触可塑性和脑血流量从而影响记忆能力[13]。Suh等[14]研究发现,TBBPA暴露可显著升高大鼠胰腺β细胞中NO水平,加重炎症反应,诱导细胞凋亡。本实验结果显示,TBBPA-DHEE显著促进NO分泌,由此表明,TBBPA-DHEE和TBBPA暴露对NO具有相似的毒性效应,可影响细胞信息传递及突触可塑性,产生神经毒性。
VGCC作为一种高分子复合蛋白,是神经系统中电信号和许多重要细胞过程之间的桥梁,介导细胞外Ca2+内流以响应质膜去极化[15]。已证明溴代阻燃剂可抑制VGCC表达,从而减少Ca2+流入细胞并减少神经递质分泌[16]。本研究结果显示,TBBPA-DHEE诱导细胞培养液中Ca2+含量上升和VGCC表达下调,抑制Ca2+内流进入胞内,与Hendriks等[16]研究毒性效应一致,表明诱导的PC12细胞神经毒性部分原因是TBBPA-DHEE可诱导VGCC表达降低和破坏Ca2+稳态。
CaM是钙信号的反应蛋白,介导Ca2+诱发反应,能与细胞内游离Ca2+结合,是Ca2+的关键传感器。CaM表达下调可导致神经递质释放、基因表达、突触可塑性等功能受影响[17]。MKP-1控制着许多炎症基因和转录因子的表达,在神经退行性疾病中起着神经保护作用,可通过调节线粒体功能、氧化应激和自噬从而调节细胞周期进程和凋亡[18]。Li等[18]研究发现,MKP-1缺失对神经发生有抑制作用,并可在中枢神经系统和神经干细胞中诱导自噬。CaMKⅡ在神经系统中的表达水平高,可被自磷酸化作用广泛调节,单个苏氨酸残基的快速自磷酸化可使其催化亚基中的催化单元保持活性[19]。Dingemans等[19]研究发现,溴代阻燃剂暴露可显著降低小鼠海马中p-CaMKⅡThr286水平,诱导神经元活性下降。本实验结果显示,TBBPA-DHEE同样下调p-CaMKⅡThr286水平,与溴代阻燃剂存在类似的毒性效应。Strack等[20]研究发现,TBBPA暴露可显著降低正常大鼠肾小管上皮细胞NRK-52E p-ERK水平;Kim等[21]将雄性小鼠暴露于TBBPA后,海马中p-CREB水平显著降低。本研究发现,TBBPA-DHEE暴露诱导p-CaMKⅡThr286、p-ERK1/2Thr202/Tyr204和p-CREBSer133蛋白下调,与TBBPA的调控作用相同;因此,TBBPA-DHEE对Ca2+信号通路中的部分蛋白具有类似于TBBPA的毒性效应。
由此可见,TBBPA-DHEE暴露可显著下调PC12细胞Ca2+信号通路从而产生神经毒性,如图6所示,PC12细胞经TBBPA-DHEE暴露后,抑制VGCC蛋白表达,导致Ca2+内流减少,致CaM、MKP-1、p-CaMKⅡThr286、p-ERK1/2Thr202/Tyr204和p-CREBSer133表达降低。
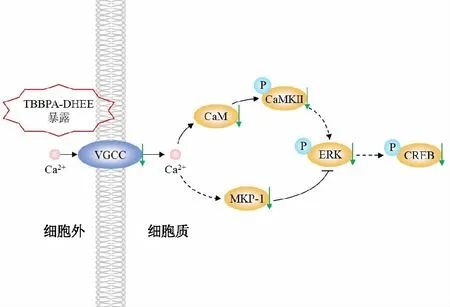
图6 TBBPA-DHEE下调钙离子信号通路相关蛋白
综上所述,TBBPA-DHEE具有与TBBPA相似的毒性效应,其可显著抑制PC12细胞活力并导致细胞氧化损伤,其可能通过下调VGCC表达,影响细胞Ca2+稳态,进而影响Ca2+信号通路相关蛋白的表达,从而产生神经毒性。

