温度和光照周期对硬头鳟幼鱼生长、生理及行为的影响
张旭,张佳,王婕,李海霞,胡雨,马真*
(1.设施渔业教育部重点实验室(大连海洋大学),辽宁 大连 116023;2.大连海洋大学 水产与生命学院,辽宁 大连 116023;3.大连海洋大学 海洋科技与环境学院,辽宁 大连 116023)
鲑鳟因其具有肉质鲜美、营养价值高等优点,深受国内外消费者的喜爱,2020年中国鲑鳟养殖产量达到39 456 t[1]。鲑鳟具有洄游习性,其生活史中最重要的环节之一就是从淡水向海水生活的转变,鲑鳟幼鱼为了适应这种转变,会在较短时期内经历一系列形态、行为和生理的变化,这一时期被称为“入海窗口期”[2]。温度和光照是影响鲑鳟幼鱼降海变态的关键因素,通过延长鲑鳟养殖光照时间和提高养殖温度等手段促进鲑鳟幼鱼的生长,调控其入海时间,已被广泛应用于鲑鳟养殖过程中[3-4]。研究表明,鲑鳟生活史早期淡水阶段的养殖条件也会影响鲑鳟的渗透压调节能力。Ge等[5]将虹鳟(Oncorhynchusmykiss)幼鱼分别在恒温和变温条件下驯化6周后,转移到海水环境中,结果发现,温度波动不超过2 ℃的试验组,表征幼鱼渗透调节能力的钠钾泵(sodium-potassium pump,Na+/K+-ATP酶,NKA)水平显著高于其他处理组。Van Rijn等[6]研究了大西洋鲑(Salmosalar)在不同光周期(8L∶16D、12L∶12D和16L∶8D)条件下渗透压调节能力的变化,结果显示,在经过8周的驯化后,16L∶8D试验组大西洋鲑的渗透压调节能力显著高于其他处理组。
鲑鳟从淡水到海水的过渡涉及一系列生理、形态和行为改变。以生长性能为主的光照(全光照)和温度条件(最适温度上限),可能会影响鱼类的生理表现,如应激耐受和渗透压调节能力[7-9]。李佳凯等[10]研究了大黄鱼(Larimichthyscrocea)幼鱼在低温(25 ℃)和高温(32 ℃)条件下血清生化指标的变化,结果显示,高温组幼鱼的谷丙转氨酶(alanine aminotransferase,ALT)活性显著高于低温组。Tian等[11]研究了团头鲂(Megalobramaamblycephala)幼鱼在不同光照周期(8L∶16D、12L∶12D和16L∶8D)条件下肝脏抗氧化酶活性的变化,结果显示,经过8周的养殖,16L∶8D处理组的肝脏超氧化物歧化酶(SOD)活性最低。而鱼的行为表现是鱼类适应环境和内在生理功能调节的综合表现[12-13],如硬头鳟幼鱼的觅食行为随着水温的升高而减弱[14];大西洋鲑在逆流条件下通过河口的游泳速度要比顺流条件下快0.14 m/s[15];欧洲舌齿鲈(Dicentrarchuslabrax)在较小规模养殖条件下的摄食半径显著低于大规模养殖条件下的摄食半径[16]。因此,在水产养殖中通过观察鱼类行为,可直观、快速地判断鱼类的状态,从而为水产养殖生产提供重要的指导信息[17-18]。
硬头鳟隶属于鲑形目(Salmoniformes)鲑科(Salmonidae)大马哈鱼属(Oncorhynchus),是一种冷水性洄游鱼类,也是虹鳟的降海洄游型。目前,温度和光照周期对鲑鳟生长影响的研究大多集中在其入海窗口期的渗透压能力调节方面[5-6],而硬头鳟作为鲑鳟鱼类的一种,对其生活史前期淡水阶段渗透压调节的研究较少,尤其是对养殖环境下的硬头鳟应对温度和光照周期的生理及行为响应研究更是鲜见报道。本研究中,以硬头鳟为研究对象,通过分析硬头鳟在不同温度和光照周期下的生长性能、生理变化和行为表现,研究了硬头鳟摄食前的行为表现及规律,以期为硬头鳟工业化水产养殖过程中适宜环境的设置,以及养殖效益和鱼类福利水平的提高提供重要参考依据。
1 材料与方法
1.1 材料
试验用硬头鳟购自山东省牟平市某鳟鱼养殖场,水温为(13±2)℃,养殖车间采用人工补光,光照周期为12L∶12D。试验在大连海洋大学设施渔业教育部重点实验室进行,在正式试验之前,硬头鳟幼鱼在塑料桶中暂养一周(与前期养殖场环境保持一致)。每天8:00和16:00各投喂一次,投喂量为鱼体质量的2%,投喂后1 h清理饵料残渣和粪便,早晚各换水1/2。
1.2 方法
1.2.1 试验设计 基于生产上普遍使用的温度和光照周期,分别设置13 ℃(低温)和16 ℃(高温)两个温度,以及16L∶8D(长光照)和12L∶12D(自然光照)两个光照周期,试验设置4个处理组,分别为13 ℃ &16L∶8D(T1)、16 ℃ &16L∶8D(T2)、13 ℃ &12L∶12D(T3)和16 ℃ &12L∶12D(T4),每个处理组设3个平行,共使用12个试验桶,试验系统见图1。暂养结束后,选择健康(体表无损伤,摄食正常)的硬头鳟幼鱼480尾,初始体质量为(8.0±0.5)g,初始体长为(7.1±0.5)cm,随机放入12个试验桶(直径为80 cm,高为60 cm,有效水体为250 L)中,每桶40尾。

图1 试验系统Fig.1 Experimental setup
试验期间,12L∶12D的光照时间为8:00—20:00,16L∶8D的光照时间为8:00—24:00,采用人工光源进行补光。根据前期研究结果设置光色和光强,采用白色LED灯(GK5A,深圳超频三科技股份有限公司),辐照度为9 W/m2[5]。每个试验桶正上方距水面90 cm处装有高清摄像机(HIKDS-2CD3T35D-I5,海康威视),用于记录试验期间硬头鳟的行为。
1.2.2 样品的采集与分析 分别于试验开始的第10、20、30、40天时采样,采样时,从每个养殖桶随机选取3尾鱼(每个处理组9尾鱼),经MS-222快速麻醉后,测量幼鱼体长和体质量,然后将其置于冰盘解剖,取肝脏和鳃组织迅速放入液氮中速冻后置于-80 ℃下保存。每次取样后,将同样数量和规格的幼鱼补回各试验桶中[16]。采集早晨摄食前10 min的幼鱼活动视频,用EthoVision XT 12.0软件分析和计算幼鱼的行为参数[19-20],分析方法为动态减影法,采集频率为12.5帧/s。
1.2.3 幼鱼行为指标及生长指标的计算 幼鱼的行为指标包括幼鱼运动过程中的平均游泳速度(v,cm/s)、最大瞬时加速度(a,cm/s2)、幼鱼到试验桶中心点的距离(dP,cm)、幼鱼间的平均距离(dF,cm)和活跃度(Aactivity,%),生长指标包括特定生长率(RSG,%/d)和增重率(GBW,%)。计算公式为
(1)
at=(vt-vt-1)/Δt,
(2)
(3)
(4)
ΔAt=(At-At-1)+(At-1-At),
(5)
Aactivity=ΔAt/(At-1+At)×100%,
(6)
RSG=(lnWt-lnW0)/t′×100%,
(7)
GBW=(Wt-W0)/W0×100%。
(8)
其中:Xt、Yt为目标鱼t时刻的坐标;Xt-1、Yt-1为目标鱼t-1时刻的坐标;△t为两次采样的时间差;Xa,t、Ya,t、Xr,t和Yr,t为目标鱼相邻个体t时刻的坐标;ΔAt为目标鱼t时刻的变化面积(cm2);At为目标鱼t时刻的面积(cm2);At-1为目标鱼t-1时刻的面积(cm2);Wt为终体质量(g);W0为初始体质量(g);t′为养殖时间(d)。
采用南京建成生物工程研究所的相关试剂盒,测定幼鱼肝脏中的葡萄糖(glucose,GLU)含量、SOD和ALT活性,以及鳃中的NKA活性。其中,采用氧化酶法测定GLU含量,采用羟胺法测定SOD活性,采用比色法测定ALT和NKA活性。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,采用SPSS 26.0软件进行双因素方差分析(two-way ANOVA),采用Tukey检验进行多重比较,显著性水平为0.05。
2 结果与分析
2.1 不同温度和光照周期下幼鱼生长指标的变化
从表1可见:试验结束时,T1处理组硬头鳟幼鱼的终体质量、特定生长率和增重率均显著高于其他处理组(P<0.05),而T4处理组最低;相同光照周期条件下,低温处理组(T1和T3)幼鱼的生长性能优于高温处理组(T2和T4)(P<0.05);相同温度条件下,长光照处理组(T1和T2)幼鱼的各项生长指标均显著高于自然光照处理组(T3和T4)(P<0.05)。双因素方差分析结果显示,温度和光照周期对幼鱼的终体质量和增重率存在显著的交互作用(P<0.05)(表2)。

表1 不同温度和光照周期对硬头鳟生长的影响Tab.1 Effects of different temperatures and photoperiods on growth of Oncorhynchus mykiss

表2 温度和光照周期对硬头鳟生长影响的双因素方差分析Tab.2 Summary of two-way ANOVA results on effects of temperature and photoperiods on growth of Oncorhynchus mykiss
2.2 不同温度和光照周期下幼鱼生理指标的变化
从图2可见:随着试验时间的持续,各组硬头鳟幼鱼肝脏的GLU含量呈下降趋势,试验结束时,各处理组GLU含量无显著性差异(P>0.05);试验期间各组幼鱼肝脏的SOD活性呈上升趋势,试验结束时,T4处理组的SOD活性显著高于其他处理组(P<0.05);试验期间各组幼鱼的ALT活性呈先上升后下降趋势,试验结束时,T1处理组的ALT活性显著高于T3和T4处理组(P<0.05);试验期间各组幼鱼鳃中的NKA活性呈上升趋势,试验结束时,不同处理组的NKA活性均达到最大值,且T1处理组的NKA活性显著高于其他处理组(P<0.05),而T4处理组NKA活性最低。
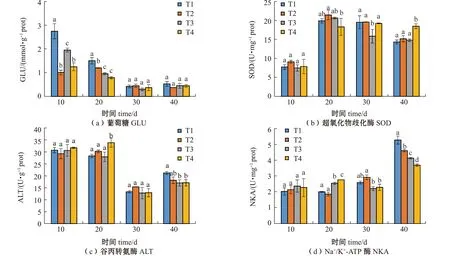
标有不同字母者表示同一时间下不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。The means with different letters in the same time are significant differences in different groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.图2 不同温度和光照周期对硬头鳟生理指标的影响Fig.2 Effects of different temperatures and photoperiods on the physiology of Oncorhynchus mykiss
双因素方差分析结果显示,试验结束时,温度和光照周期对硬头鳟幼鱼肝脏中的GLU含量和ALT活性不存在显著交互作用(P>0.05),而对幼鱼肝脏中SOD活性和鳃中NKA活性有显著的交互作用(P<0.05)(表3)。

表3 温度和光照周期对硬头鳟生理指标影响的双因素方差分析Tab.3 Summary of two-way ANOVA results on effects of temperature and photoperiod on the physiology of Oncorhynchus mykiss
2.3 不同温度和光照周期下硬头鳟幼鱼行为的变化
从图3可见:随着试验时间的持续,各处理组硬头鳟平均移动速度呈现降低趋势,试验结束时,T4处理组幼鱼的平均移动速度显著快于其他处理组(P<0.05);试验期间各处理组幼鱼的最大瞬时加速度变化差异较大,试验结束时,T4处理组的最大瞬时加速度显著低于T2处理组(P<0.05),但与T1和T3处理组无显著性差异(P>0.05);试验期间,除T3处理组外,其余处理组幼鱼到桶中心点的距离呈增大趋势,试验结束时,T4处理组幼鱼到中心点的距离显著大于其他处理组(P<0.05);试验期间,T1处理组幼鱼间的平均距离变化不大,其余处理组呈现增大趋势,试验结束时,T4处理组幼鱼间的距离显著大于T1处理组(P<0.05),但与T2、T3处理组间无显著性差异(P>0.05);试验期间,幼鱼活跃度呈现下降趋势,试验结束时,T4处理组幼鱼活跃度显著高于其他处理组(P<0.05)。
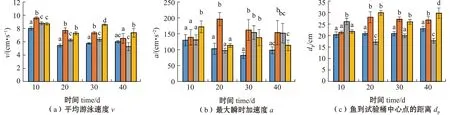
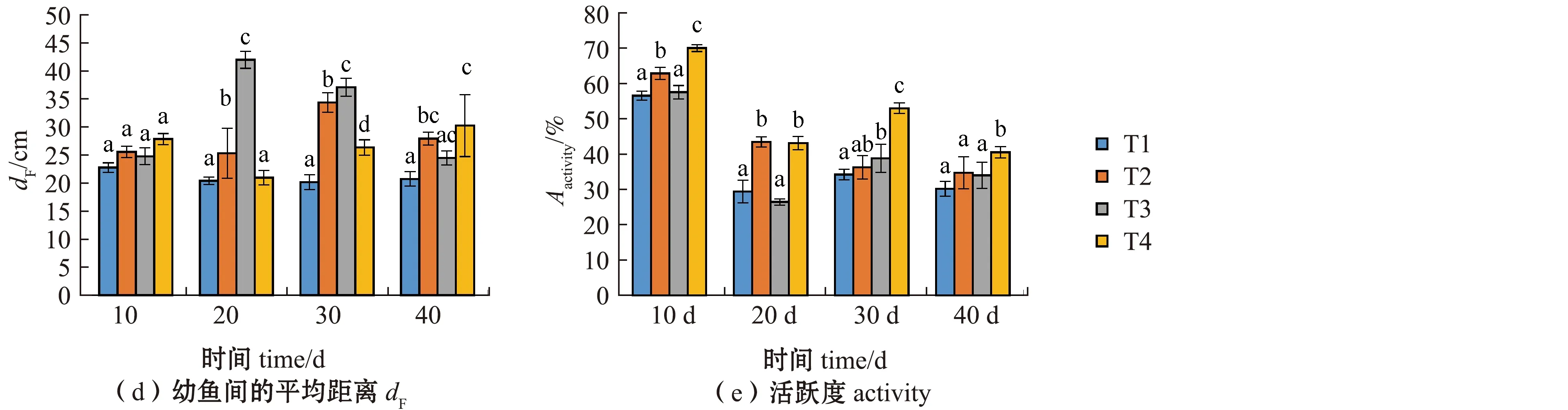
图3 不同温度和光照周期对硬头鳟行为的影响Fig.3 Effects of different temperatures and photoperiods on the behavior of Oncorhynchus mykiss
双因素方差分析结果显示,温度和光照周期对幼鱼游泳的平均速度、最大瞬时加速度及鱼到中心点的距离有显著的交互作用(P<0.05),对某一时间段的幼鱼间平均距离(20~40 d)和幼鱼活跃度(10~30 d)均有显著交互作用(P<0.05)(表4)。
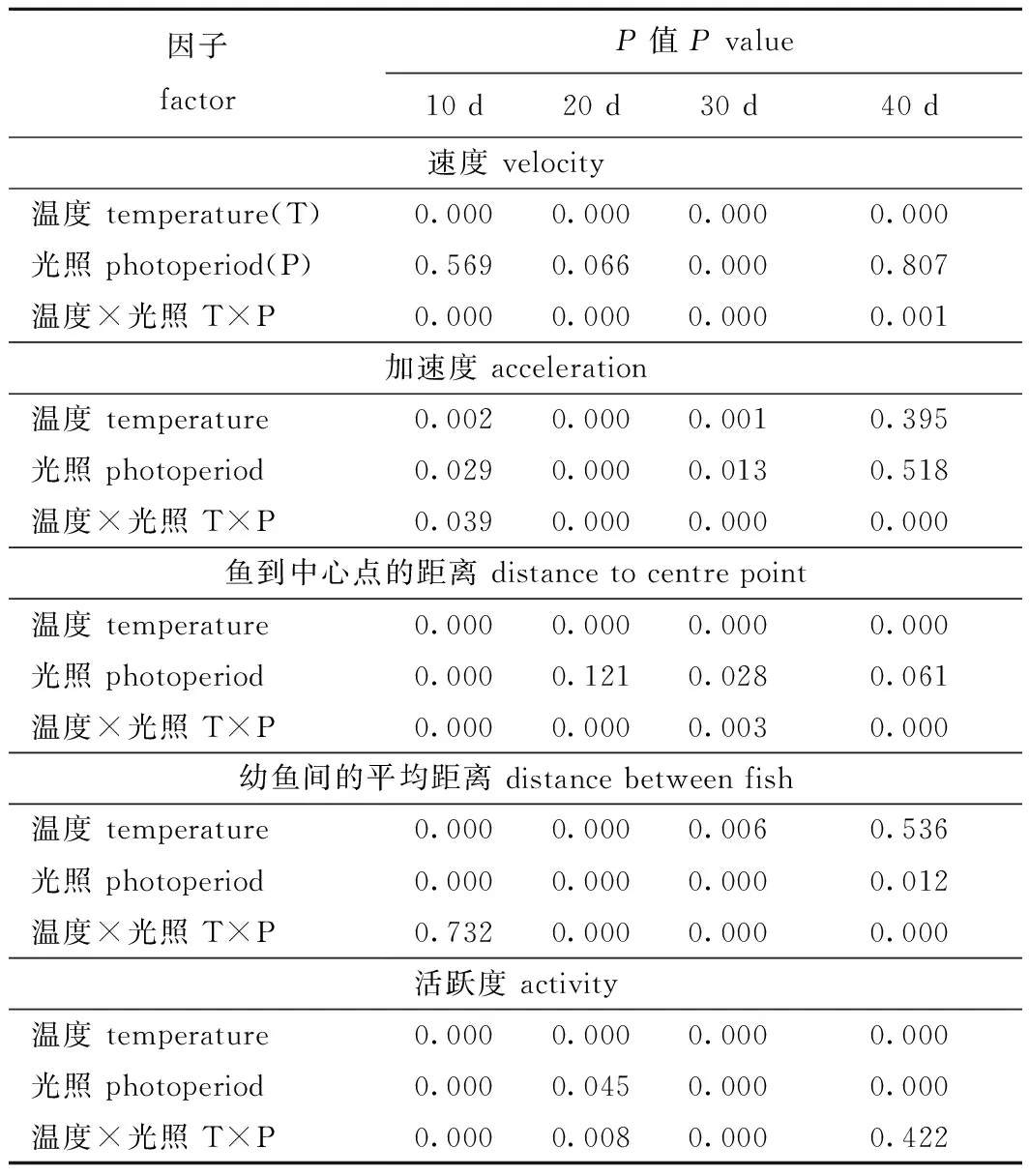
表4 温度和光照周期对硬头鳟行为影响的双因素方差分析Tab.4 Summary of two-way ANOVA results on effects of temperature and photoperiod on the behavior of Oncorhynchus mykiss
3 讨论
3.1 温度和光照周期对硬头鳟幼鱼生长的影响
养殖系统对环境因子的可控性较高,温度和光照周期是硬头鳟最敏感的两个环境因子,了解温度和光照周期的相互作用对硬头鳟幼鱼生长的影响,对于养殖生产实践具有重要的指导意义。本研究中,随着养殖时间的延长,低温长光照(13 ℃ &16L∶8D)处理组幼鱼的生长性能显著高于其他处理组,高温自然光照(16 ℃ &12L∶12D)处理组幼鱼的生长性能最低,这表明,即使在养殖过程中普遍采用的光照周期和温度条件下,硬头鳟幼鱼的生长也会产生明显的差异,即存在温度和光照周期的更优组合条件[21-22]。
本研究中,当温度条件相同时,长光照(16L∶8D)处理组幼鱼的生长性能显著高于自然光照(12L∶12D)处理组,说明光照周期的延长对鱼类生长有促进作用,这一结果与Handeland等[21]
的研究结果一致。当光照周期相同时,低温(13 ℃)处理组幼鱼的生长性能显著高于高温(16 ℃)处理组,说明在硬头鳟养殖过程中,适当地降低温度有利于硬头鳟的生长发育。
3.2 温度和光照周期对硬头鳟幼鱼生理的影响
GLU是机体代谢的供能物质,其变化反映出鱼类代谢水平和能量状态的适应性调整。本研究中,在试验结束时,各处理组硬头鳟肝脏中GLU含量无显著性差异,这表明各处理组幼鱼的代谢水平趋于一致,各处理组均处于适宜环境调节中,幼鱼肝脏GLU代谢受环境影响较小[23]。抗氧化机制在维持鱼类生理动态平衡方面具有重要作用,当外界环境发生变化时,鱼类会出现抗氧化水平失衡。SOD是机体抗氧化机制中的关键酶,能够清除过多的活性氧自由基,减少自身损伤并提高防御能力[24]。本研究中,在试验结束时,高温自然光照(16 ℃ &12L∶12D)处理组硬头鳟肝脏的SOD活性显著高于其他处理组,其余处理组SOD活性无显著性差异,这表明即使在适宜的养殖环境下,也应关注鱼类体内抗氧化指标的变化[25-26]。ALT是表征鱼类营养代谢的关键酶之一,其活性变化也可以反映鱼类的代谢水平[27]。本研究中,在试验结束时,13 ℃条件下,长光照(16L∶8D)处理组硬头鳟肝脏中的ALT活性显著高于自然光照(12L∶12D)处理组,表明光照周期的延长能够显著提高硬头鳟的代谢水平;但16 ℃条件下,长光照(16L∶8D)和自然光照(12L∶12D)处理组幼鱼的ALT活性无显著性差异,这可能是由于较高的温度对硬头鳟幼鱼的代谢起到了抑制作用[28]。渗透压调节能力被确认为是洄游鱼类生存的关键因素,鳃中NKA活性被认为是衡量渗透压调节能力的重要指标[29-30]。本研究中,在试验结束时,13 ℃条件下的两个光照周期处理组硬头鳟幼鱼鳃中的NKA活性显著高于16 ℃条件下相应的两个光照周期处理组,说明在光照周期相同条件下,13 ℃时硬头鳟的渗透调节能力优于16 ℃[31];当温度条件相同时,16L∶8D处理组NKA活性显著高于12L∶12D处理组,这一结果表明,在相同养殖温度条件下,延长光照周期能够提高硬头鳟幼鱼的渗透调节能力。与此类似,Imsland等[31]比较了大西洋鲑幼鱼在不同温度(8.3、12.7 ℃)和光照周期下(24L∶0D、12L∶12D)渗透压调节能力的变化,结果显示,相同温度条件下,长光照处理组大西洋鲑鳃NKA活性均高于自然光照处理组。这表明即使不在降海窗口期,延长光照时间也有利于增加鲑鳟的渗透压调节能力。
3.3 温度和光照周期对硬头鳟幼鱼行为的影响
随着鱼类行为和工业化养殖智能水平研究的深入,鱼类行为的监测已被广泛地应用于养殖中,用于提高鱼类资源的利用效率和鱼类的福利水平[32-33]。本研究结果显示,在试验结束时,高温自然光照(16 ℃ &12L∶12D)处理组硬头鳟幼鱼的平均游泳速度和活跃度显著高于其他处理组,这表明硬头鳟幼鱼在较高的温度下表现出了更多的自发性活动,这可能是由于较高的温度使鱼类的代谢提高,导致幼鱼耗能增加[34]。幼鱼到试验桶中心点的距离表征了幼鱼的活动半径,而幼鱼间的平均距离表征了鱼的聚集状况和相互作用。本研究中,在试验结束时,16 ℃条件下两个光照周期处理组硬头鳟幼鱼到试验桶中心点的距离和幼鱼间的平均距离显著高于13 ℃条件下的两个光照周期处理组,这说明在较高的温度条件下,鱼群间的互动频率次数减少,表现为幼鱼的移动范围增大和聚集性减弱[35]。
4 结论
1)硬头鳟幼鱼在低温和长光照(13 ℃ &16L∶8D)条件下的生长性能显著高于其他处理组,表明低温和较长光照时间有助于硬头鳟幼鱼在淡水阶段的生长发育。
2)高温和自然光照(16 ℃ &12L∶12D)条件下,硬头鳟幼鱼肝脏的SOD活性显著高于其他处理组,说明即使在生产中常用的养殖条件下,也应关注幼鱼的抗氧化指标;长光照处理组幼鱼的渗透压调节能力显著高于自然光照处理组,说明淡水阶段延长光照周期,有助于提高硬头鳟幼鱼的渗透压调节能力。
3)硬头鳟幼鱼在高温和自然光照周期(16 ℃ &12L∶12D)下的行为与其他处理组有显著性差异,具体表现为自发性活动的显著增加和集群性的显著降低。

