红豆杉中产紫杉醇及其类似物内生菌的分离与筛选
郑寒琪 沈诗媚 赵玉知 陈营

摘要 为了从红豆杉中分离筛选可以产紫杉醇及其类似物的内生菌,本研究以红豆杉为试验材料,对其针叶和枝条通过划线分离法共筛选得到9株内生菌,对所得菌株用不同发酵培养基进行摇瓶发酵培养,发酵液及菌体经乙酸乙酯萃取浓缩后以紫杉醇标准品为对照进行薄层层析(TLC)检测。试验发现9株内生菌中有4株可以产生紫杉醇及其类似物,其中内生真菌有3株,内生细菌有1株。通过细菌16S rDNA扩增测序和真菌Its扩增测序分析可知,3株内生真菌初步确定为1株链格孢菌(Alternaria sp.)和2株Paraconiothyrium brasiliense,1株细菌为枯草芽孢杆菌(Bacillus subtilis);相同菌株用不同发酵培养基时,样品Rf值不同,表明培养基成分会影响菌体进入次级代谢的时间,并进一步影响前体物质向紫杉醇的转化。试验结果为后续紫杉醇这一天然中药成分的生物合成及其代谢调控奠定了基础。
关键词 红豆杉;内生菌;紫杉醇;生物合成;代谢调控
中图分类号 Q949.9 文献标识号 A
文章编号 1007-7731(2023)05-0027-05
紫杉醇(Paclitaxel,商品名 Taxol)是一种复杂的含氮二萜类衍生物,于1971年被美国科学家Wani等[1]从短叶红豆杉(Taxus breviifolia)的树皮中分离出来。紫杉醇能抑制微管蛋白解聚,有效抑制癌细胞的增殖、迁移和侵袭,且抑制肿瘤生长的机理已被阐明,在临床上被广泛用于乳腺癌、卵巢癌和部分头颈癌和肺癌的治疗[2-3]。紫杉醇作为具有抗癌活性的二萜生物碱类化合物,其新颖复杂的化学结构、广泛显著的生物活性、全新独特的作用机制、奇缺的自然中药资源使其成为举世瞩目的抗癌明星和研究重点。
天然红豆杉树生长极其缓慢且不易繁殖,使得红豆杉的自然资源比较奇缺,且其作为中药成分的紫杉醇提取率很低,30 t干树皮才可以得到大约100 g紫杉醇,难以大规模实现药用价值,利用红豆杉内生菌发酵生产紫杉醇具有生产周期短、紫杉醇产率高等优点。国内外许多学者对红豆杉产紫杉醇的内生菌进行了大量的研究,研究目前主要集中在两个方面:一是分离出更多的产紫杉醇的高产菌株;二是对已有产紫杉醇内生真菌进行改良,使其适合产业化需求。1993年Stierle等[4]首次从短叶红豆杉中分离到产紫杉醇内生真菌并将其命名为Taxomyces andreanae;方荣锋等[5]分离到产紫杉醇的曲霉属烟曲霉(Aspergillus fumigatus)并將其命名为烟曲霉TMS-26;席晓圆等[6]在红豆杉树皮中分离到一株高产紫杉醇的内生真菌,并证明其为黑孢霉属(Nigrospora sp.)。
由于不同的培养基会对产物含量产生巨大影响,所以为了避免产物含量过低导致检测失误,本试验采用2种不同的发酵培养基,成功地从红豆杉中分离到可产生紫杉醇类化合物的3株内生真菌和1 株内生细菌,以期为产紫杉醇内生菌的研究提供科学依据,从而解决紫杉醇这一天然中药成分的供应危机和开发利用问题。
1 材料与方法
1.1 材料准备
新鲜采摘的加拿大曼地亚红豆杉针叶和枝条,冷藏保存备用。
1.2 试剂准备
青霉素(福州飞净生物科技有限公司)、链霉素(范德生物科技有限公司)、乙酸乙酯(国药集团化学试剂)、异丙醇(天津市永大化学试剂有限公司)、乙酸钠(国药集团化学试剂)、苯甲酸钠(天津市北辰方正试剂厂)、L-苯丙氨酸(上海如吉生物科技有限公司)、香草醛(天津市森源化学试剂有限公司)和紫杉醇33069-62-4标准品(纯度为98%,成都钠钶锂生物科技有限公司),其余试剂均为国产分析纯。
1.3 培养基准备
①PDA培养基:马铃薯(去皮煮汁,过滤取液)200 g,葡萄糖 20 g,琼脂20 g,蒸馏水1000 mL,自然pH,121℃,20 min灭菌。②发酵培养基A:蔗糖20 g蛋白胨1.5 g,KH2PO4 5 g,MgSO4 2 g,Na2HPO4 0.2 g,CaCl2 0.03 g,FeSO4 0.05 g,CuSO4·5H2O 0.005 g,MnSO4 0.001 g,苯甲酸0.02 g,乙酸钠0.2 g,苯丙氨酸0.02 g,蒸馏水1 000 mL,自然pH,121 ℃,20 min灭菌。③发酵培养基B:马铃薯200 g,酵母膏2 g,葡萄糖20 g,硫酸镁0.1 g,苯丙氨酸0.02 g,乙酸钠0.2 g,苯甲酸0.02 g,蒸馏水1 000 mL,自然pH,121 ℃,20 min灭菌。
1.4 红豆杉内生菌的分离与纯化
1.4.1 样品处理。用无菌水清洗红豆杉的枝条和针叶:将枝条用无菌水浸泡10 min,用消毒后的手术剪、手术刀将枝条去芯并截成0.5 cm左右的小段,将针叶用无菌水清洗后剪成1 cm长的小段,剪好的枝条和针叶先用75%酒精浸泡30 s,再用无菌水冲洗3~4次,在超净台内风干后备用。
1.4.2 内生真菌的接种培养。在超净台内将处理好的红豆杉枝条和针叶以切口断面垂直接种于加有青霉素和链霉素的PDA固体培养基中,每培养皿放置10块枝条或针叶,依次编号,置于28 ℃恒温培养箱中培养2~3 d。
1.4.3 内生细菌的接种培养。将处理好的红豆杉枝条和针叶分别浸泡于两支装有15 mL无菌水的灭菌试管中,在功率为10 KHz的超声波清洗器中震15 min,在超净台内各取两支试管中液体1 mL,分别涂布于两个不加青霉素和链霉素的PDA固体培养基表面。置于28 ℃恒温培养箱中培养2~3 d。
1.4.4 内生菌的分离纯化与保存。待观察到内生菌菌落从切口处长出后,用接种环挑取单菌落接种至新的PDA固体培养基上进行划线培养,培养出单菌落后,转化5~6次以纯化菌株。纯化后的菌株编号后,放入冰箱冷冻保存以留存菌种。
1.5 产紫杉醇及其类似物内生菌的筛选
1.5.1 分离菌种的发酵培养。将活化的菌体在超净台内用接种环接入装有50 mL发酵培养液的三角瓶中(接种于发酵培养基A和B中),置于28 ℃,3 000 r·min-1的全温振荡器中摇床培养,培养2~3 d。(因菌株不同培养时间略有差异,实际培养时间以摇瓶培养的菌丝球不再明显增加为限)。
1.5.2 发酵液和菌体的产物提取。待摇床培养至培养基中含有大块菌体、菌丝球不再明显增加后,采用离心的方法将菌体与发酵液分离。将分离得到的发酵液转移到三角瓶中加入1/2发酵液体积的乙酸乙酯静置萃取一夜,将上层萃取液分离出来作为样品。
将分离得到的菌体首先在烘干箱内50 ℃条件下烘干,随后用研钵进行研磨,使菌体破碎,内溶物释放,将研磨物转移至5 mL的EP管中加入2 mL乙酸乙酯静置萃取一夜,将上层萃取液分离出来作为样品用于薄层分析。
1.5.3 紫杉醇及其类似物的薄层层析(TLC)。将硅胶HSGF254板(烟台江友硅胶开发有限公司)放置105 ℃的烤箱中活化30 min,取出后冷却。用点样毛细管将分离得到的菌体萃取液和发酵液萃取液以及1 mg/L紫杉醇标准品于5 cm×10 cm规格的层析硅胶板中点样,点样量适中(菌体浸提液不少于20 μL,发酵液不少于40 μL),点样点距前端约1.5~2.0 cm,间距1.0~2.0 cm,直径约 1~2 mm。展层在100 mm×100 mm规格的P型密闭层析缸(上海垒固仪器有限公司)中进行,层析前预先在密闭层析缸中加入展开剂乙酸乙酯∶异丙醇(96∶6,V/V)进行预饱和30 min。
展开剂行至距硅胶板前沿1.5~2 cm时停止层析,将硅胶板拿出层析缸迅速风干,然后立即将显色剂(甲醇/浓硫酸/香草醛(90∶10∶1,V/V/M))均匀喷至硅胶板表面,随后放入100 ℃烤箱中加热干燥显色(或者用吹风机进行加热),实时观察紫杉醇标准品与样品的斑点大小、位置、颜色。分别量取标准品和样品原点至显色斑点间的距离,并计算层析斑点的 Rf 值,通过对比分析,初步判断红豆杉内生菌菌体及发酵液中是否含有紫杉醇类化合物。
1.6 内生菌的鉴定
对筛选得到的菌种进行分子鉴定,细菌采用16S rDNA扩增测序方法,真菌采用ITS扩增测序方法。测序由睿博兴科生物技术有限公司完成。测序结果拼接后在GenBank数据库中用Blast(http://blast.ncbi.nlm.nih.gov/Blast)进行在线比对分析,确定菌种的归属。
2 结果与分析
2.1 内生菌的分離和纯化
根据内生菌的菌落特征,经仔细鉴别,剔除可能重复的菌株,总共分离得到9株内生菌,其中有7株真菌和2株细菌。除1株细菌来源于针叶,其余均从枝条中分离,分离结果见表1。
2.2 产紫杉醇内生菌的筛选
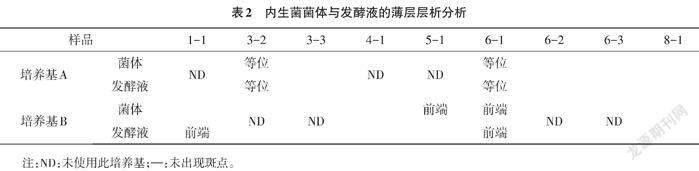
将纯化的菌株分别接种于发酵培养基A和发酵培养基B进行摇床培养2~3 d。以发酵液和菌体萃取处理后的样品与紫衫醇标准品进行薄层比较,结果见表2。
通过薄层层析筛选,9株内生菌中只有1-1、3-2、5-1、6-1菌株有明显斑点出现,且使用发酵培养基A时样品斑点与紫杉醇标准品斑点等位,而使用发酵培养基B的菌株斑点均处于标准品前端。
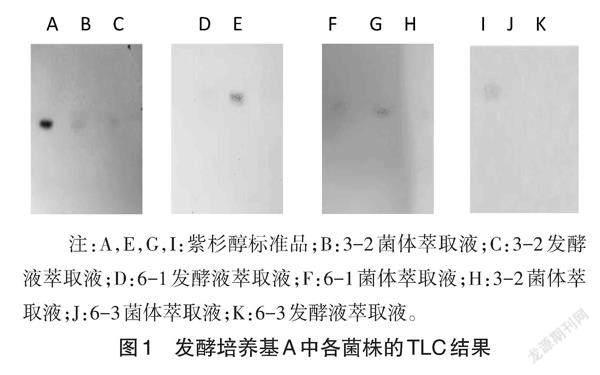
发酵培养基A中培养的3-2和6-1菌株的菌体及发酵液萃取液斑点Rf值在0.93~0.94之间,与紫杉醇标准样品的Rf值0.938相近,紫杉醇标准品斑点呈现靛紫色椭圆状,样品斑点与标准品斑点等位,大小相近,颜色稍浅,因而认为3-2和6-1菌株的菌体及发酵液萃取液中可能含有紫杉醇或紫杉烷类似物。而使用发酵培养基A培养的3-3、6-2、6-3、8-1四株菌的菌体及发酵液均无斑点出现,结果见图1。
发酵培养基B中培养的1-1和6-1菌株的发酵液萃取液以及5-1和6-1菌株的菌体萃取液斑点Rf值均略大于0.938,样品斑点位于标准品斑点前端,大小相近,颜色稍浅,因而认为1-1和6-1菌株的发酵液萃取液以及5-1和6-1菌株的菌体萃取液中可能含有紫杉醇类似物或者紫杉醇前体物质。4-1和8-1株菌无斑点出现,结果见图2。
2.3 内生菌株的鉴定
测序后,经Blast在线对比分析得出1-1株为链格孢菌(Alternaria sp.)、3-2和6-1株为Paraconiothyrium brasiliense、5-1株为枯草芽孢杆菌(Bacillus subtilis)。除枯草芽孢杆菌为细菌外,其余3株菌皆为真菌。
3 实验结果讨论
目前产紫杉醇内生真菌已报道有40多个属,如拟盘多毛孢属Pestalotiopsis microspora、树状多节孢Noduzisporium sylviforme、链格孢菌Alternaria、茎点霉属Phomopsis、曲霉属Aspergillus niger var等[7-11]。但关于红豆杉产紫杉醇内生细菌的相关报道还比较少。宋培勇等[12]曾使用划线分离法分离得到红豆杉内生细菌的优势菌属——芽孢杆菌。本试验与之分离方法不同,是对红豆杉枝条和针叶进行超声波振动处理后成功分离到内生枯草芽孢杆菌,并验证了其产紫杉醇类似物的能力。枯草芽孢杆菌一直以来被广泛关注的是其在植物病害防治中的作用,尚未发现有其代谢产物与紫杉醇合成有关的相关研究;本试验首次报道了从曼地亚红豆杉中分离出产紫杉醇类似物的枯草芽孢杆菌,丰富了产紫杉醇内生细菌的种群资源;另一方面,细菌较真菌的生长及代谢周期短,使紫杉醇的产率可以进一步提高,是未来紫杉醇产业化发展的一个重要方向。张智慧等[13]研究证明链格孢菌和Paraconiothyrium brasiliense为红豆杉内生真菌,且链格孢菌可以产生紫杉醇。本试验的结果不仅验证了链格孢菌产紫杉醇的能力,还证明了Paraconiothyrium brasiliense同样具有产紫杉醇的能力。在试验人员以及试验方法有异的情况下却同样分离得到链格孢菌属,由此可认为此菌易于分离,具有一定的开发利用价值,可以作为提高紫杉醇发酵生产含量的研究对象,为量产紫杉醇及其类似物奠定研究基础。
大部分关于紫杉醇发酵生产的研究是为了提高紫杉醇的产量以便使用,由本试验结果也可以清楚地看到所有样品斑点颜色均浅于标准品,这可能是发酵培养条件的限制使产物浓度过低所致。所以,为避免由于含量过低而导致检测失误,本试验使用了2种不同的发酵培养基。有研究表明培养基中碳源和氮源的不同会影响紫杉醇及其类似物质产生的含量,提高氮源浓度能够对红豆杉内生菌的生长起到促进作用,浓度过高则抑制次级代谢产物的形成,适量的Mg2+可促进紫杉醇的合成,并促进前体物向紫杉醇转化[14]。本试验中发酵培养基B的氮源丰富于A,且Mg2+少于培养基A,可以使菌体较晚进入次生代谢,导致前体物质尚未进一步转化成紫杉醇,所以出现发酵培养基A中菌株样品斑点与紫杉醇标准品斑点等位,而培养基B中样品斑点均高于标准品的现象。董慧茹等[15]分离纯化紫杉醇和三尖杉宁碱的TLC检测色谱图中显示,三尖杉宁碱斑点的位置高于紫杉醇标准品,故此推测本试验中所产生的紫杉醇前体物质为三尖杉宁碱。
4 结论
红豆杉是天然中药成分紫杉醇的重要来源,具有极大的开发利用价值,本研究采用2种不同的发酵培养基,以均含有紫杉醇生物合成途径中的部分前体物质以确保试验的顺利进行。本试验成功筛选到能够产紫杉醇及其类似物如三尖杉宁碱的红豆杉内生菌,为天然中药成分紫杉醇的开发利用以及量产使用奠定了一定的基础。
后续研究的重点将探究紫杉醇的生物合成及其代谢调控,探究培养基中前体物质和微量元素对菌体进入次级代谢产生紫杉醇及其类似物的影响,建立紫杉醇合成途径中关键酶的高效表达,使其尽可能减少副产物的生成,从而大量产生紫杉醇及合成紫杉醇的前体物质。
5 参考文献
[1] WANI M C,TAYLOR H L,WALL M E et al.Plant antitumor agents. VI. The isolation and structure of taxol,a novel antileukemic and antitumor agent from Taxus brevifolia[J]. Journal of the American Chemical Society,1971,93(9):2325-2327.
[2] 王振东. 紫杉醇在乳腺癌治疗中的应用[J]. 海南医学,2002,13(1):86-88.
[3] 王彦,黄荣丽,黄惠芳. 紫杉醇在卵巢癌治疗中的应用[J]. 中华妇产科杂志,1999,34(7):439-441.
[4] STIERLE A,STROBEL G,STIERLE D. Taxol and taxane production by Taxomyces andreanae,an endophytic fungus of pacific yew[J]. Science,1993,260(5105):214-216.
[5] 方荣锋,李浩浩,张培,等. 产紫杉醇内生真菌TMS-26的分离和鉴定[J].生物工程学报,2017,33(12):1945-1954.
[6] 席晓圆,赵盛英,张鹏,等. 产紫杉醇内生真菌N-15的分离及鉴定[J]. 天然产物研究与开发,2016,(8):1219-1222,1283.
[7] KUSARI S,SINGH S,JAYABASKARAN C. Rethinking production of Taxol? (paclitaxel) using endophyte biotechnology[J]. Trends in Biotechnology,2014,32(6):304-311.
[8] MU J H,BOLLON A P,SIDHU R S. Analysis of β-tubulin cDNAs from taxol-resistant Pestalotiopsis microspora and taxol-sensitive Pythium ultimum and comparison of the taxol-binding properties of their products[J]. MGG-Molecular and General Genetics,1999,262(4-5):857-868.
[9] SUN J,HANYING Y U,PENG Z,et al. The formation and regeneration of Nodulisporium sylviforme protoplast[J]. Chinese Journal of Applied & Environmental Biology,2001,7(4):375-381.
[10] 席曉圆,宋发军,张鹏,等. 产紫杉醇内生真菌MHZ-32的鉴定[J]. 中国生物化学与分子生物学报,2015,31(4):429-434.
[11] 郝胜楠. 产紫杉醇的HD86-9菌种鉴定及其相关酶基因的克隆[D].哈尔滨市:黑龙江大学,2009.
[12] 宋培勇,兰琴英,鲁卓越. 南方红豆杉内生细菌分离鉴定及系统发育分析[J]. 生物技术,2012,22(5):61-65.
[13] 张智慧,郑文艺,崔海超,等. 东北红豆杉一株产三尖杉宁碱内生真菌Xylaria Primorskensis Y32的分离与鉴定[J]. 黑龙江医药,2021,34(3):499-503.
[14] 赵赟鑫,高文,张欢,等. 提高红豆杉内生真菌及紫杉醇含量的途径分析[J]. 陕西农业科学,2015,61(10):13-17.
[15] 董慧茹,雒丽娜,郑云,等.薄层色谱法分离紫杉醇和三尖杉宁碱[J]. 理化检验(化学分册),2007(6):472-475.
(责编:张 蓓)
基金项目 烟台市重点研发计划。
陈营*通信作者
收稿日期 2022-05-12

